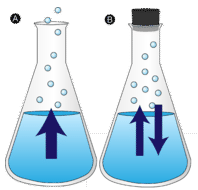
Avdunstning
En vattenpöl som lämnas ostörd försvinner till slut. Vätskemolekylerna flyr in i gasfasen och blir till vattenånga. Förångning är den process där en vätska omvandlas till en gas. Avdunstning är omvandlingen av en vätska till dess ånga under vätskans kokpunktstemperatur. Om vattnet i stället förvaras i en sluten behållare har vattenånga-molekylerna ingen chans att fly ut i omgivningen och vattennivån förändras därför inte. När en del vattenmolekyler blir ånga kondenseras lika många vattenånga-molekyler tillbaka till det flytande tillståndet. Kondensation är en förändring av tillståndet från en gas till en vätska.
För att en vätskemolekyl ska kunna fly till gastillståndet måste molekylen ha tillräckligt med kinetisk energi för att övervinna de intermolekylära attraktionskrafterna i vätskan. Kom ihåg att ett givet vätskeprov kommer att ha molekyler med ett brett spektrum av kinetiska energier. De vätskemolekyler som har en viss kinetisk tröskelenergi undslipper ytan och blir till ånga. Som ett resultat av detta har de vätskemolekyler som återstår nu lägre kinetisk energi. När avdunstning sker sjunker temperaturen hos den kvarvarande vätskan. Du har observerat effekterna av avdunstningskylning. En varm dag absorberar vattenmolekylerna i din svett kroppsvärme och avdunstar från hudytan. Förångningsprocessen gör att den kvarvarande svetten blir svalare, vilket i sin tur absorberar mer värme från din kropp.
En viss vätska kommer att avdunsta snabbare när den värms upp. Detta beror på att uppvärmningsprocessen resulterar i att en större andel av vätskemolekylerna har den nödvändiga kinetiska energin för att fly från vätskeytan. Figuren nedan visar den kinetiska energifördelningen för vätskemolekyler vid två temperaturer. Antalet molekyler som har den kinetiska energi som krävs för att avdunsta visas i det skuggade området under kurvan till höger. Den vätska med högre temperatur \(\left( T_2 \right)\) har fler molekyler som kan flyga ut i ångfasen än den vätska med lägre temperatur \(\left( T_1 \right)\).

Med 29 029 fot \(\left( 8848 \: \text{m} \right)\) är Mount Everest i Himalaya på gränsen mellan Kina och Nepal den högsta punkten på jorden. Dess höjd innebär många praktiska problem för klättrare. Luftens syrehalt är mycket lägre än på havsnivå, vilket gör det nödvändigt att ta med sig syretankar (även om ett fåtal klättrare har nått toppen utan syrgas). Ett annat problem är att koka vatten för att laga mat. Även om vatten kokar vid \(100^\text{o} \text{C}\) på havsnivå är kokpunkten på toppen av Mount Everest endast ca \(70^\text{o} \text{C}\). Denna skillnad gör det mycket svårt att få en anständig kopp te (vilket definitivt frustrerade några av de brittiska klättrarna).