Reella och ideala gaser
En idealisk gas är en gas som följer gaslagarna vid alla temperatur- och tryckförhållanden. För att göra det måste gasen helt och hållet följa den kinetisk-molekylära teorin. Gaspartiklarna skulle behöva uppta noll volym och de skulle behöva uppvisa inga som helst attraktionskrafter mot varandra. Eftersom inget av dessa villkor kan uppfyllas finns det ingen idealisk gas. En verklig gas är en gas som inte beter sig enligt antagandena i den kinetisk-molekylära teorin. Lyckligtvis tenderar riktiga gaser vid de temperatur- och tryckförhållanden som normalt förekommer i ett laboratorium att bete sig mycket likt ideala gaser.
Under vilka förhållanden beter sig gaser då minst idealt? När en gas utsätts för högt tryck tvingas dess molekyler närmare varandra eftersom det tomma utrymmet mellan partiklarna minskar. En minskning av det tomma utrymmet innebär att antagandet att själva partiklarnas volym är försumbar är mindre giltigt. När en gas kyls gör minskningen av partiklarnas rörelseenergi att de blir långsammare. Om partiklarna rör sig i långsammare hastigheter är de attraktiva krafterna mellan dem mer framträdande. Ett annat sätt att se på saken är att en fortsatt nedkylning av gasen så småningom kommer att förvandla den till en vätska, och en vätska är verkligen inte längre en idealisk gas (se flytande kväve i figuren nedan). Sammanfattningsvis avviker en verklig gas mest från en idealgas vid låga temperaturer och höga tryck. Gaser är mest idealiska vid hög temperatur och lågt tryck.

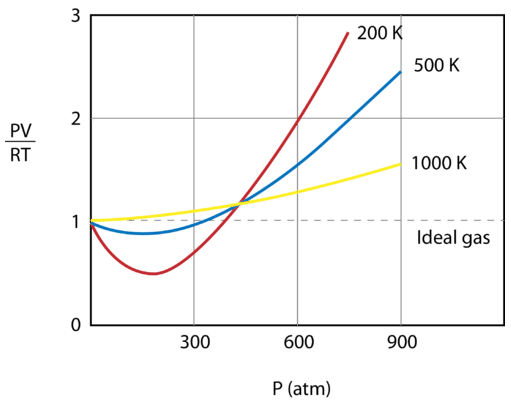
Figuren nedan visar ett diagram över \(\frac{PV}{RT}\\) plottat mot trycket för \(1 \: \text{mol}\) av en gas vid tre olika temperaturer – \(200 \: \text{K}}\), \(500 \: \text{K}}\) och 1000 \: \text{K}\). En idealisk gas skulle ha värdet 1 för detta förhållande vid alla temperaturer och tryck och grafen skulle helt enkelt vara en horisontell linje. Som framgår förekommer avvikelser från en idealisk gas. När trycket börjar stiga gör attraktionskrafterna att gasens volym blir mindre än förväntat och värdet på \(\frac{PV}{RT}\) sjunker under 1. Fortsatt tryckökning leder till att partiklarnas volym blir betydande och värdet på \(\frac{PV}{RT}\) stiger till över 1. Lägg märke till att storleken på avvikelserna från idealiteten är störst för gasen vid \(200 \: \text{K}\) och minst för gasen vid \(1000 \: \text{K}\).
En gass ideala egenskaper beror också på styrkan och typen av intermolekylära attraktionskrafter som finns mellan partiklarna. Gaser vars attraktionskrafter är svaga är mer idealiska än gaser med starka attraktionskrafter. Vid samma temperatur och tryck är neon mer idealiskt än vattenånga eftersom neons atomer endast attraheras av svaga dispersionskrafter, medan vattenångans molekyler attraheras av relativt starkare vätebindningar. Helium är en mer idealisk gas än neon eftersom dess mindre antal elektroner innebär att heliums dispersionskrafter är ännu svagare än neons.