Bindningsstyrka: Kovalenta bindningar
Stabila molekyler existerar eftersom kovalenta bindningar håller ihop atomerna. Vi mäter styrkan hos en kovalent bindning genom den energi som krävs för att bryta den, det vill säga den energi som krävs för att separera de bundna atomerna. Att separera ett par bundna atomer kräver energi; ju starkare en bindning är, desto större energi krävs för att bryta den. Den energi som krävs för att bryta en specifik kovalent bindning i en mol gasmolekyler kallas bindningsenergi eller bindningsdissociationsenergi. Bindningsenergin för en diatomär molekyl, \(D_{X-Y}\), definieras som standard entalpiändringen för den endoterma reaktionen:
\
Bindningsenergin för den rena kovalenta H-H-bindningen, \(\Delta_{H-H}\), är t.ex. 436 kJ per mol av bruten H-H-bindning:
\
För att bryta en bindning krävs alltid att energi tillförs molekylen. På motsvarande sätt frigör en bindning alltid energi.
Molekyler med tre eller fler atomer har två eller fler bindningar. Summan av alla bindningsenergier i en sådan molekyl är lika med standard entalpiändringen för den endoterma reaktion som bryter alla bindningar i molekylen. Till exempel är summan av de fyra C-H-bindningsenergierna i CH4, 1660 kJ, lika med standard entalpiförändringen för reaktionen:
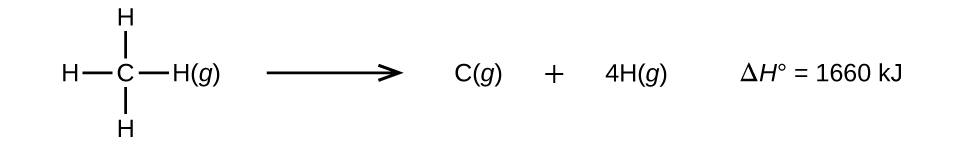
Den genomsnittliga C-H-bindningsenergin, \(D_{C-H}\), är 1660/4 = 415 kJ/mol eftersom det finns fyra mol C-H-bindningar som bryts per mol av reaktionen. Även om de fyra C-H-bindningarna är likvärdiga i den ursprungliga molekylen kräver de inte var och en samma energi för att brytas; när den första bindningen väl är bruten (vilket kräver 439 kJ/mol) är de återstående bindningarna lättare att bryta. Värdet 415 kJ/mol är ett medelvärde, inte det exakta värde som krävs för att bryta en enskild bindning.
Styrkan hos en bindning mellan två atomer ökar när antalet elektronpar i bindningen ökar. Generellt sett minskar bindningslängden när bindningsstyrkan ökar. Således finner vi att trippelbindningar är starkare och kortare än dubbelbindningar mellan samma två atomer; på samma sätt är dubbelbindningar starkare och kortare än enkelbindningar mellan samma två atomer. Genomsnittliga bindningsenergier för några vanliga bindningar finns i tabell \(\PageIndex{2}\), och en jämförelse av bindningslängder och bindningsstyrkor för några vanliga bindningar finns i tabell \(\PageIndex{2}\). När en atom binder till olika atomer i en grupp minskar bindningsstyrkan vanligtvis när vi rör oss nedåt i gruppen. Till exempel är C-F 439 kJ/mol, C-Cl 330 kJ/mol och C-Br 275 kJ/mol.
| Bindning | Bindningsenergi | Bindning | Bindningsenergi | Bindning | Bindningsenergi | Bindningsenergi | ||
|---|---|---|---|---|---|---|---|---|
| H-H | 436 | C-S | 260 | F-Cl | 255 | |||
| H-C | 415 | C-Cl | 330 | F-Br | 235 | |||
| H-N | 390 | C-Br | 275 | Si-Si | 230 | |||
| H-O | 464 | C-I | 240 | Si-P | 215 | |||
| H-F | 569 | N-N | 160 | Si-S | 225 | |||
| H-Si | 395 | \(\mathrm{N=N}\) | 418 | Si-Cl | 359 | |||
| H-P | 320 | \(\mathrm{N≡N}\) | 946 | Si-Br | 290 | |||
| H-S | 340 | N-O | 200 | Si-I | 215 | |||
| H-Cl | 432 | N-F | 270 | P-P | 215 | |||
| H-Br | 370 | N-P | 210 | P-S | 230 | |||
| H-I | 295 | N-Cl | 200 | P-Cl | 330 | |||
| C-C | 345 | N-Br | 245 | P-Br | 270 | |||
| (\mathrm{C=C}\) | 611 | O-O | 140 | P-I | 215 | |||
| \(\mathrm{C≡C}\) | 837 | \(\mathrm{O=O}\) | 498 | S-S | 215 | |||
| C-N | 290 | O-F | 160 | S-Cl | 250 | |||
| \(\mathrm{C=N}\) | 615 | O-Si | 370 | S-Br | 215 | |||
| \(\mathrm{C≡N}\) | 891 | O-P | 350 | Cl-Cl | 243 | |||
| C-O | 350 | O-Cl | 205 | Cl-Br | 220 | |||
| \(\mathrm{C=O}\) | 741 | O-I | 200 | Cl-I | 210 | |||
| \(\mathrm{C≡O}\) | 1080 | F-F | 160 | Br-Br | 190 | |||
| C-F | 439 | F-Si | 540 | Br-I | 180 | |||
| C-Si | 360 | F-P | 489 | I-I | 150 | |||
| C-P | 265 | F-S | 285 |
| Bindning | Bindningslängd (Å) | Bindningsenergi (kJ/mol) |
|---|---|---|
| C-C | 1.54 | 345 |
| \(\mathrm{C=C}\) | 1.34 | 611 |
| \(\mathrm{C≡C}\) | 1.20 | 837 |
| C-N | 1.43 | 290 |
| \(\mathrm{C=N}\) | 1.38 | 615 |
| \(\mathrm{C≡N}\) | 1.16 | 891 |
| C-O | 1.43 | 350 |
| \(\mathrm{C=O}\) | 1.23 | 741 |
| \(\mathrm{C≡O}\) | 1.13 | 1080 |
Vi kan använda bindningsenergier för att beräkna ungefärliga entalpiförändringar för reaktioner där bildningsenthalpier inte är tillgängliga. Beräkningar av denna typ ger oss också besked om huruvida en reaktion är exotermisk eller endotermisk.
- En exotermisk reaktion (ΔH negativ, värme som produceras) uppstår när bindningarna i produkterna är starkare än bindningarna i reaktanterna.
- En endotermisk reaktion (ΔH positiv, värme som absorberas) uppstår när bindningarna i produkterna är svagare än bindningarna i reaktanterna.
Enthalpiförändringen, ΔH, för en kemisk reaktion är ungefär lika med summan av den energi som krävs för att bryta alla bindningar i reaktanterna (energi ”in”, positivt tecken) plus den energi som frigörs när alla bindningar bildas i produkterna (energi ”ut”, negativt tecken). Detta kan uttryckas matematiskt på följande sätt:
\
I detta uttryck betyder symbolen \(\Sigma\) ”summan av” och D representerar bindningsenergin i kilojoule per mol, vilket alltid är ett positivt tal. Bindningsenergin fås från en tabell och beror på om bindningen är en enkel-, dubbel- eller trippelbindning. Vid beräkning av entalpi på detta sätt är det därför viktigt att vi tar hänsyn till bindningarna i alla reaktanter och produkter. Eftersom D-värden vanligtvis är medelvärden för en typ av bindning i många olika molekyler ger denna beräkning en grov uppskattning, inte ett exakt värde, för reaktionsenthalpin.
Tänk på följande reaktion:
eller
\
För att bilda två mol HCl måste ett mol H-H-bindningar och ett mol Cl-Cl-bindningar brytas. Den energi som krävs för att bryta dessa bindningar är summan av bindningsenergin för H-H-bindningen (436 kJ/mol) och Cl-Cl-bindningen (243 kJ/mol). Under reaktionen bildas två mol H-Cl-bindningar (bindningsenergi = 432 kJ/mol), vilket frigör 2 × 432 kJ eller 864 kJ. Eftersom bindningarna i produkterna är starkare än i reaktanterna frigör reaktionen mer energi än den förbrukar:
\-2D_{H-Cl}}\\\
&=\mathrm{-2(432)=-185\:kJ}
\end {align*}\]
Denna överskottsenergi frigörs som värme, så reaktionen är exotermisk. Tabell T2 ger ett värde för den standardmässiga molära entalpen för bildning av HCl(g), \(ΔH^\circ_\ce f\), på -92,307 kJ/mol. Det dubbla värdet är -184,6 kJ, vilket stämmer väl överens med det tidigare erhållna svaret för bildningen av två mol HCl.
Exempel \(\PageIndex{1}\): Användning av bindningsenergier för att approximera entalpiförändringar
Metanol, CH3OH, kan vara ett utmärkt alternativt bränsle. Reaktionen av ånga och kol vid hög temperatur ger en blandning av gaserna kolmonoxid, CO, och väte, H2, från vilken metanol kan framställas. Med hjälp av bindningsenergierna i tabell \(\PageIndex{2}\), beräkna den ungefärliga entalpiförändringen, ΔH, för reaktionen här:
\
Lösning
Först måste vi skriva Lewisstrukturerna för reaktanterna och produkterna:
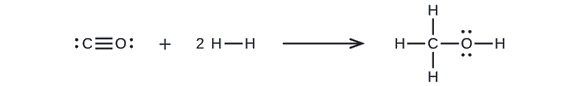
Därav ser vi att ΔH för denna reaktion innefattar den energi som krävs för att bryta en C-O trippelbindning och två H-H enkelbindningar, samt den energi som produceras av bildandet av tre C-H enkelbindningar, en C-O enkelbindning och en O-H enkelbindning. Vi kan uttrycka detta på följande sätt (via ekvation \ref{EQ3}):
\-}
\end {align*}\]
Med hjälp av bindningsenergivärdena i tabell \(\PageIndex{2}\) får vi:
&=\ce{-107\:kJ}
\end {align*}\]
Vi kan jämföra detta värde med det värde som beräknats utifrån \(ΔH^\circ_\ce f\ce f\) data från Appendix G:
&=-\\\\
&=\mathrm{-90.5\:kJ}
\end {align*}\]
Notera att det finns en ganska stor skillnad mellan de värden som beräknats med de två olika metoderna. Detta beror på att D-värdena är ett genomsnitt av olika bindningsstyrkor; därför ger de ofta bara en grov överensstämmelse med andra data.
Övningsuppgift \(\PageIndex{1}\)
Ethylalkohol, CH3CH2OH, var en av de första organiska kemikalierna som avsiktligt syntetiserades av människor. Den har många användningsområden inom industrin och är den alkohol som ingår i alkoholhaltiga drycker. Den kan erhållas genom jäsning av socker eller syntetiseras genom hydrering av etylen i följande reaktion:

Beräkna en ungefärlig entalpiändring, ΔH, för denna reaktion med hjälp av bindningsenergierna i tabell \(\PageIndex{2}\).
Sammanfattning
Video \(\PageIndex{2}\): En genomgång av atomära bindningar.
Kovalenta bindningar bildas när elektroner delas mellan atomer och attraheras av kärnorna i båda atomerna. I rena kovalenta bindningar delas elektronerna lika mycket. I polära kovalenta bindningar delas elektronerna ojämnt, eftersom den ena atomen utövar en starkare attraktionskraft på elektronerna än den andra.
Styrkan hos en kovalent bindning mäts med hjälp av dess bindningsdissocieringsenergi, det vill säga den energimängd som krävs för att bryta just den bindningen i en mol av molekyler. Flera bindningar är starkare än enskilda bindningar mellan samma atomer. En reaktionens entalpi kan uppskattas utifrån den energiåtgång som krävs för att bryta bindningar och den energi som frigörs när nya bindningar bildas.
Nyckelekvationer
- Bindningsenergi för en diatomär molekyl: \(\ce{XY}(g)⟶\ce{X}(g)+\ce{Y}(g)\hspace{20px}\ce{D_{X–Y}}=ΔH°\)
- Enthalpy change: ΔH = ƩBindningar som bryts – ƩBindningar som bildas
Fotnoter
- Denna fråga är hämtad från Chemistry Advanced Placement Examination och används med tillstånd av Educational Testing Service.
Glossar
bindningsenergi (även, bindningsdissociationsenergi) energi som krävs för att bryta en kovalent bindning i ett gasformigt ämne
Medverkande
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) och Richard Langley (Stephen F. Austin State University) med medverkande författare. Läroboksinnehåll producerat av OpenStax College är licensierat under en Creative Commons Attribution License 4.0-licens. Ladda ner gratis på http://cnx.org/contents/85abf193-2bd…[email protected]).
- Adelaide Clark, Oregon Institute of Technology
- Fuse School, Open Educational Resource gratis, under en Creative Commons License: Attribution-NonCommercial CC BY-NC (View License Deed: https://creativecommons.org/licenses/by-nc/4.0/)
- Crash Course Chemistry: Crash Course är en division av Complexly and videos are free to stream for educational purposes.
Feedback
Har du feedback att ge om den här texten? Klicka här.
Hittade du ett stavfel och vill ha extra beröm? Klicka här.