Kekuléstruktur för bensen
Bensen hade molekylformeln C6H6, men dess strukturformel var okänd.
Om bensen var ett rätkedjigt omättat kolväte borde det lätt genomgå additionsreaktioner (precis som andra alkener och alkyner).
Till exempel borde brom, Br2, addera över dubbel- eller trippelbindningen enligt nedanstående:
| Möjlig additionsreaktion med rätkedjig struktur: | |||
| CH3-C≡C-C≡C-CH3 | + Br2 | → | CH3-CBr=CBr-C≡C-CH3 |
Men, När brom tillsätts till bensen vid 25 °C och 1 atm (101.3 kPa) tryck verkar ingen reaktion inträffa.
Så de möjliga strukturerna för bensen som innefattar dubbel- och/eller trippelbindningar arrangerade i en kedja verkade högst osannolika eftersom dessa borde genomgå additionsreaktioner.
Om brom läggs till bensen i närvaro av FeBr3 genomgår det en substitutionsreaktion där en av väteatomerna ersätts med en bromatom för att producera en förening med formeln C6H5Br, enligt nedan:
| känd substitutionsreaktion: | ||||||||
| C6H6 | + Br2 | FeBr3 → |
C6H5Br | + HBr | ||||
I detta avseende, beter sig bensen mycket mer som ett mättat kolväte (endast enkla bindningar mellan kolatomerna).
Den första struktur som Kekulé föreslog för bensen 1865 innehöll alltså inga dubbelbindningar, men arrangerade de 6 kolatomerna i en ring enligt nedan:
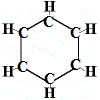
Kekulé insåg att denna molekyl bryter mot tetravalensregeln för kol, det vill säga varje kolatom bildar endast 3 bindningar i stället för 4.
Så 1872 föreslog Kekulé en bensenstruktur som består av tre alternerande enkel- och dubbelbindningar enligt nedan:

Observera att även om kolatomerna inte står skrivna i strukturen, så förstås alltid att det finns en cabonatom där två rader i sexhörningen sammanfogas, så att det finns 6 ”sammanfogningar”, 6 vinklar, och därmed 6 kolatomer.
I denna struktur är varje kolatom bunden till en väteatom och till två andra kolatomer. En av kol-kol-bindningarna är en enkelbindning, den andra kol-kol-bindningen är en dubbelbindning. Varje kolatom har gjort 4 bindningar.
Men även om denna struktur inte förklarar varför bensen inte genomgår additionsreaktioner kan den förklara varför bensen bildar endast en strukturell isomer när bensen reagerar med brom i en substitutionsreaktion som visas nedan:
 föreslagen bensenstruktur |
+ Br2 | → |  Endast en strukturell isomer |
+ HBr |
De andra föreslagna ringstrukturerna för bensen skulle ha förutsagt mer än en strukturell isomer för produkten av substitutionsreaktionen enligt nedan:
| Andra föreslagna ringstrukturer för reaktionen: | 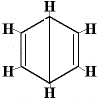 |
Br2 → |
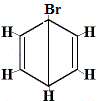 strukturell isomer 1 |
+ | 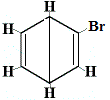 strukturell isomer 2 |
Vad skulle hända om ytterligare en väteatom ersattes (substituerades) med en bromatom?
| C6H5Br | + Br2 | FeBr3 → |
C6H4Br2 | + HBr |
Hur många strukturella isomerer av C6H4Br2 skulle bildas?
 |
Br2 → FeBr3 |
 strukturell isomer 1 |
+ | 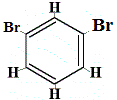 strukturell isomer 2 |
+ | 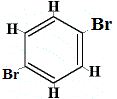 strukturell isomer 3 |
+ |  strukturell isomer 4 |
De strukturella isomererna 1 och 4 skiljer sig från varandra eftersom de två br-atomerna i isomer 1 är bundna till kolatomer på en C-C-bindning, medan de två Br-atomerna i isomer 4 är bundna till kolatomer i en C=C-bindning.
När C6H5Br tillverkat av bensen reagerar med brom i en substitutionsreaktion bildas emellertid endast 3 strukturella isomerer av C6H4Br2!
För att lösa detta problem föreslog Kekulé att bensenringen befinner sig i snabb jämvikt mellan strukturer där dubbelbindningarna befinner sig i de alternativa positionerna enligt nedan:
 |
⇋ | 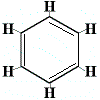 |
Så när brom reagerar med C6H5Br i en substitutionsreaktion för att producera C6H4Br2, befinner sig par av strukturella isomerer av C6H4Br2 i jämvikt med varandra.
Detta innebär att de strukturella isomererna 1 och 4 som visas ovan, vilka endast skiljer sig åt genom att Br-atomerna är bundna över en enkelbindning eller en dubbelbindning, nu befinner sig i snabb jämvikt med varandra som visas nedan:
| Br-atomer på intilliggande C-atomer, strukturell isomer 1 har Br-atomer över C-C strukturell isomer 4 har Br-atomer över C=C |
 strukturell isomer 1 |
⇋ |  strukturell isomer 4 |
Enligt Kekulé, är dessa två strukturella isomerer av C6H4Br2 i så snabb jämvikt att de inte kan separeras som två separata molekyler, så det verkar som om det bara finns tre isomerer i stället för fyra.
Även om denna snabba jämviktsstruktur för bensen, känd som Kekulé-strukturen, visade sig vara användbar, förklarar den inte bensenringens unika stabilitet (brist på reaktivitet), den förklarar inte varför bensen inte lätt genomgår additionsreaktioner men kan induceras att genomgå additionsreaktioner.
Förstår du det här?
Gör AUS-e-TUTE!
Ta testet nu!