Chefredaktör: C. Michael Gibson, M.S., M.D. ; Medredaktör(er): C. Michael Gibson, M.S., M.D. ; Medredaktör(er): Aparna Vuppala, M.B.B.S.
Disclaimer
WikiDoc ger ingen garanti för giltighet. WikiDoc är inte en professionell vårdgivare och är inte heller en lämplig ersättning för en licensierad vårdgivare. WikiDoc är avsett att vara ett utbildningsverktyg, inte ett verktyg för någon form av vårdleverans. Det pedagogiska innehållet på WikiDocs läkemedelssidor är baserat på FDA:s bipacksedel, National Library of Medicine-innehåll och praxisriktlinjer/konsensusuttalanden. WikiDoc främjar inte administrering av något läkemedel eller någon anordning som inte överensstämmer med dess märkning. Läs vår fullständiga ansvarsfriskrivning här.
Översikt
Butalbital är en kombination som är FDA-godkänd för behandling av för lindring av symtomkomplexet spänningshuvudvärk (eller muskelkontraktion). Vanliga biverkningar inkluderar yrsel och gastrointestinala störningar inklusive illamående, kräkningar och flatulens, toxisk epidermal nekrolys och erythema multiforme.
Vuxna indikationer och dosering
FDA-märkta indikationer och dosering (vuxna)
huvudvärk
- Butalbital-, aspirin- och koffeintabletter är indicerade för lindring av symtomkomplexet spänningshuvudvärk (eller muskelsammandragning).
- Det finns inga belägg för effekt och säkerhet av butalbital, aspirin och koffein vid behandling av multipel återkommande huvudvärk. Försiktighet i detta avseende krävs eftersom butalbital är vanebildande och potentiellt missbrukbart.
Off-Label Användning och dosering (Vuxen)
Guideline-Supported Use
Det finns begränsad information om Off-Label Guideline-Supported Use av butalbital hos vuxna patienter.
Icke-vägledarstödd användning
Det finns begränsad information om Off-Label Icke-vägledarstödd användning av Butalbital hos vuxna patienter.
Pediatriska indikationer och dosering
FDA-märkta indikationer och dosering (pediatrisk)
Det finns begränsad information om FDA-märkt användning av Butalbital hos pediatriska patienter.
Off-Label Use and Dosage (Pediatric)
Guideline-Supported Use
Det finns begränsad information om Off-Label Guideline-Supported Use av Butalbital hos pediatriska patienter.
Icke-vägledarstödd användning
Det finns begränsad information om Off-Label Icke-vägledarstödd användning av Butalbital hos pediatriska patienter.
Kontraindikationer
- Överkänslighet mot aspirin, koffein eller barbiturater. Patienter med porfyri.
Varningar
Drogberoende:
- Långvarig användning av barbiturater kan ge läkemedelsberoende, som kännetecknas av psykiskt beroende och mer sällan fysiskt beroende och tolerans. Missbruksansvaret för butalbital, aspirin och koffein liknar det för andra barbituratinnehållande läkemedelskombinationer. Försiktighet bör iakttas vid förskrivning av läkemedel till patienter med känd benägenhet att ta överdrivna mängder läkemedel, vilket inte är ovanligt hos patienter med kronisk spänningshuvudvärk.
Användning hos ambulerande patienter:
- Butalbital, aspirin och koffein kan försämra de mentala och/eller fysiska förmågor som krävs för utförandet av potentiellt farliga arbetsuppgifter, såsom att köra bil eller använda maskiner. Patienten bör varnas i enlighet med detta. Centralnervösa depressiva effekter av butalbital kan vara additiva med de av andra CNS-depressiva medel. Samtidig användning med andra lugnande hypnotika eller alkohol bör undvikas. När sådan kombinerad behandling är nödvändig kan dosen av ett eller flera medel behöva minskas.
Försiktighetsåtgärder
- Salicylater ska användas med yttersta försiktighet vid förekomst av peptiskt ulcus eller koagulationsavvikelser.
Biverkningar
Erfarenheter från kliniska prövningar
- De vanligaste biverkningarna är dåsighet och yrsel. Mindre vanliga biverkningar är yrsel och gastrointestinala störningar inklusive illamående, kräkningar och flatulens. En enstaka incidens av benmärgssuppression har rapporterats vid användning av butalbital, aspirin och koffein. Flera fall av dermatologiska reaktioner inklusive toxisk epidermal nekrolys och erythema multiforme har rapporterats.
Postmarketing Experience
Det finns begränsad information om Postmarketing Experience of Butalbital i läkemedelslistan.
Läkemedelsinteraktioner
Det finns begränsad information om Butalbital läkemedelsinteraktioner i läkemedelsetiketten.
Användning hos specifika populationer
Graviditet
Graviditetskategori (FDA): C
- Att adekvata studier har inte utförts på djur för att avgöra om detta läkemedel påverkar fertiliteten hos hanar eller honor, har teratogen potential eller har andra negativa effekter på fostret. Även om det inte finns några välkontrollerade studier på gravida kvinnor, innehåller över tjugo års marknadsföring och klinisk erfarenhet inga positiva bevis för negativa effekter på fostret. Även om det inte finns någon klart definierad risk kan sådana erfarenheter inte utesluta möjligheten av sällsynta eller subtila skador på det mänskliga fostret. Butalbital, aspirin och koffein bör användas hos gravida kvinnor endast vid tydligt behov.
Graviditetskategori (AUS): Det finns ingen vägledning från Australian Drug Evaluation Committee (ADEC) om användning av butalbital hos kvinnor som är gravida.
Arbete och förlossning
Det finns ingen FDA-vägledning om användning av butalbital under arbete och förlossning.
Sjuksköterskor som ammar
- Effekterna av butalbital, aspirin och koffein på spädbarn till ammande mödrar är inte kända. Salicylater och barbiturater utsöndras i bröstmjölken hos ammande mödrar. Serumnivåerna hos spädbarn anses vara obetydliga med terapeutiska doser.
Pediatrisk användning
- Säkerheten och effektiviteten hos pediatriska patienter under 12 år har inte fastställts.
Geriatisk användning
Det finns ingen FDA-vägledning om användning av Butalbital med avseende på geriatriska patienter.
Kön
Det finns ingen FDA-vägledning om användning av Butalbital med avseende på specifika könspopulationer.
Race
Det finns ingen FDA-riktlinje om användningen av Butalbital med avseende på specifika raspopulationer.
Renal Impairment
Det finns ingen FDA-riktlinje om användningen av Butalbital hos patienter med nedsatt njurfunktion.
Hepatisk nedsättning
Det finns ingen FDA-vägledning om användningen av Butalbital hos patienter med nedsatt leverfunktion.
Förmildrande kvinnor och män
Det finns ingen FDA-vägledning om användningen av Butalbital hos kvinnor med reproduktiv potential och män.
Immunokomprometterade patienter
Det finns ingen FDA-vägledning om användningen av Butalbital hos patienter som är immunokomprometterade.
Administrering och övervakning
Administrering
- Oral
Övervakning
Det finns begränsad information om övervakning av Butalbital i läkemedelsförteckningen.
IV-kompatibilitet
Det finns begränsad information om IV-kompatibilitet för butalbital i läkemedelsetiketten.
Överdosering
- De toxiska effekterna av akut överdosering av butalbital, aspirin och koffein kan främst tillskrivas dess barbituratkomponent, och i mindre utsträckning aspirin. Eftersom toxiska effekter av koffein endast uppträder i mycket höga doser är det osannolikt att det finns en möjlighet till betydande koffeintoxicitet vid överdosering av butalbital, aspirin och koffein. Symtom som kan hänföras till akut barbituratförgiftning är sömnighet, förvirring och koma, andningsdepression, hypotoni och chock. Symtom vid akut aspirinförgiftning är bl.a. hyperpné, syra-basstörningar med utveckling av metabolisk acidos, kräkningar och buksmärtor, tinnitus, hypertermi, hypoprotrombinemi, rastlöshet, delirium och kramper. Akut koffeinförgiftning kan orsaka sömnlöshet, rastlöshet, tremor och delirium; takykardi och extrasystoler. Behandlingen består främst av hantering av barbituratintoxikation och korrigering av syra-basobalansen på grund av salicylism. Kräkningar bör framkallas mekaniskt eller med kräkmedel hos den medvetna patienten. Magsköljning kan användas om reflexer i svalget och larynx är närvarande och om mindre än 4 timmar har förflutit sedan intaget. Ett endotrakealt rör med manschett ska sättas in före magsköljning av den medvetslösa patienten och när det är nödvändigt för att ge assisterad andning. Diures, alkalinisering av urinen och korrigering av elektrolytstörningar bör åstadkommas genom administrering av intravenösa vätskor, t.ex. 1 % natriumbikarbonat i 5 % dextros i vatten. Noggrann uppmärksamhet bör ägnas åt att upprätthålla adekvat lungventilation. Korrigering av hypotension kan kräva administrering av levartherenolbitartrat eller fenylefrinhydroklorid genom intravenös infusion . I allvarliga fall av förgiftning kan peritonealdialys, hemodialys eller utbytestransfusion vara livräddande. Hypoprotrombinemi bör behandlas med K-vitamin, intravenöst.
Det finns begränsad information om kronisk överdosering av Butalbital i läkemedelsförteckningen.
Farmakologi
Det finns begränsad information om Butalbital Farmakologi i läkemedelsförteckningen.
Aktionsmekanism
- Farmakologiskt sett kombinerar butalbital, aspirin och koffein de analgetiska egenskaperna hos aspirin med de anxiolytiska och muskelavslappnande egenskaperna hos butalbital.
Den kliniska effekten av butalbital, aspirin och koffein vid spänningshuvudvärk har fastställts i dubbelblinda, placebokontrollerade, multikliniska prövningar. I en studie med faktoriell design jämfördes butalbital, aspirin och koffein med var och en av dess huvudkomponenter. Denna studie visade att varje komponent bidrar till effekten av butalbital, aspirin och koffein vid behandling av målsymptomen vid spänningshuvudvärk (huvudvärkssmärta, psykisk spänning och muskelkontraktion i huvud-, nack- och axelregionen). För varje symtom och för symtomkomplexet som helhet har butalbital, aspirin och koffein visat sig ha betydligt bättre kliniska effekter än någon av komponenterna ensamma.
Struktur
- Beteendet hos de enskilda komponenterna beskrivs nedan.
- Den systemiska tillgängligheten av aspirin efter en oral dos är starkt beroende av doseringsformen, närvaron av föda, gastrisk tömningstid, gastriskt pH, antacida, buffertmedel och partikelstorlek. Dessa faktorer påverkar inte nödvändigtvis omfattningen av absorptionen av totala salicylater utan mer stabiliteten hos aspirin före absorptionen.
- Under absorptionsprocessen och efter absorptionen hydrolyseras aspirin huvudsakligen till salicylsyra och distribueras till alla kroppsvävnader och vätskor, inklusive fostervävnader, bröstmjölk och det centrala nervsystemet (CNS). De högsta koncentrationerna finns i plasma, lever, njurcortex, hjärta och lungor. I plasma är cirka 50-80 % av salicylsyran och dess metaboliter löst bundna till plasmaproteiner.
- Clearance av totala salicylater är föremål för mättad kinetik; första ordningens elimineringskinetik är dock fortfarande en god approximation för doser upp till 650 mg. Plasmahalveringstiden för aspirin är cirka 12 minuter och för salicylsyra och/eller totala salicylater är cirka 3,0 timmar.
- Eliminering av terapeutiska doser sker via njurarna antingen som salicylsyra eller andra biotransformationsprodukter. Njurclearance ökas kraftigt av en alkalisk urin som produceras genom samtidig administrering av natriumbikarbonat eller kaliumcitrat.
- Biotransformationen av aspirin sker främst i hepatocyterna. De viktigaste metaboliterna är salicylurinsyra (75 %), fenol- och acylglukuroniderna av salicylat (15 %) samt gentisic- och gentisurinsyra (1 %). Biotillgängligheten för aspirinkomponenten butalbital, aspirin och koffein är likvärdig med den för en lösning med undantag för en långsammare absorptionshastighet. En toppkoncentration på 8,80 mcg/ml erhölls 40 minuter efter en dos på 650 mg.
- Butalbital absorberas väl från mag-tarmkanalen och förväntas distribueras till de flesta vävnader i kroppen. Barbiturater kan i allmänhet förekomma i bröstmjölk och passerar lätt placentabarriären. De är bundna till plasma- och vävnadsproteiner i varierande grad och bindningen ökar direkt som en funktion av lipidlösligheten.
- Eliminering av butalbital sker främst via njurarna (59 %-88 % av dosen) som oförändrat läkemedel eller metaboliter. Plasmahalveringstiden är cirka 35 timmar. Urinutsöndringsprodukterna omfattade moderläkemedel (ca 3,6 % av dosen), 5-isobutyl-5-(2,3-dihydroxypropyl) barbitursyra (ca 24 % av dosen), 5-allyl-5-(3-hydroxi-2-metyl-1-propyl) barbitursyra (ca 4,8 % av dosen), produkter med barbitursyraringen hydrolyserad med utsöndring av urea (ca 14 % av dosen) samt oidentifierade material. Av det material som utsöndrades i urinen var 32 % konjugerat.
- Biotillgängligheten för butalbitalkomponenten i butalbital, aspirin och koffein är likvärdig med den för en lösning med undantag för en minskning av absorptionshastigheten. En toppkoncentration på 2020 ng/ml erhålls vid cirka 1,5 timmar efter en 100 mg-dos.
- Butalbitalets plasmaproteinbindning in vitro är 45 % över koncentrationsområdet 0,5 till 20 mcg/ml. Detta faller inom intervallet för plasmaproteinbindning (20 % till 45 %) som rapporterats med andra barbiturater såsom fenobarbital, pentobarbital och sekobarbitalnatrium. Förhållandet mellan plasma- och blodkoncentrationen var nästan enhetligt, vilket tyder på att det inte finns någon preferentiell fördelning av butalbital i vare sig plasma eller blodceller. (se ÖVERDOSERING för information om toxicitet).
- Likt de flesta xantiner absorberas och distribueras koffein snabbt i alla kroppsvävnader och vätskor, inklusive CNS, fostervävnader och bröstmjölk.
- Koffein elimineras snabbt genom metabolism och utsöndring i urinen. Plasmahalveringstiden är cirka 3,0 timmar. Hepatisk biotransformation före utsöndring resulterar i ungefär lika stora mängder 1-metyl-xantin och 1-metylurinsyra. Av de 70 % av dosen som har återfunnits i urinen var endast 3 % oförändrat läkemedel.
- Biotillgängligheten av koffeinkomponenten för butalbital, aspirin och koffein är likvärdig med den för en lösning med undantag för en något längre tid till toppen. En toppkoncentration på 1660 ng/mL erhölls på mindre än en timme för en dos på 80 mg
- Butalbital-, aspirin- och koffeintabletter, USP 50 mg/325 mg/40 mg är vita, runda, oskurna komprimerade tabletter med trycket ”West-ward 785”.
- Lagra vid 20-25oC (68-77oF) . Skydda mot ljus och fukt.
- Dispensera i en tät, ljusbeständig behållare enligt definitionen i USP med en barnsäker förslutning.
- Interaktion mellan alkohol och Butalbital har inte fastställts. Prata med din läkare om effekterna av att ta alkohol tillsammans med detta läkemedel.
Farmakodynamik
Det finns begränsad information om Farmakodynamik för Butalbital i läkemedelslistan.
Farmakokinetik
Aspirin:
Butalbital:
Koffein:
Nonklinisk toxikologi
Det finns begränsad information om icke-klinisk toxikologi för butalbital i läkemedelsetiketten.
Kliniska studier
Det finns begränsad information om kliniska studier för butalbital i läkemedelsetiketten.
Hur man får det
Flaskor med 30 tabletterFlaskor med 50 tabletterFlaskor med 100 tabletterFlaskor med 500 tabletterFlaskor med 1000 tabletterEnhetsdos Boxar med 100 tabletter
Lagring
Det finns begränsad information om lagring av butalbital i läkemedelsetiketten.
Bilder
Läkemedelsbilder
Läkemedelsnamn: Butalbital, paracetaminofen och koffein
Ingredienser: Butalbital, paracetaminofen och koffein
Ingrediens(er): BUTALBITAL, ACETAMINOPEN, KAFFEIN
Imprint: West;ward;787
Dosering: 50 mg
Färg:: Varmt, blått, blått, blått, blått: Färg: Blå
Förm: Rund
Storlek (mm): 11
Score: 1
NDC:01431787
Läkemedelsetikett Författare:
Denna tablettbild tillhandahålls av National Library of Medicine’s PillBox.

Läkemedelsnamn: Butalbital, aspirin och koffein
Ingregering(er): BUTALBITAL, ASPIRIN, KAFFEIN
Imprint: 785
Dosering: 50 mg
Färg: Färg: Vit: Färg: Vit
Förm: Rund
Storlek (mm): 11
Score: 1
NDC:01431785
Läkemedelsetikett Författare:
Denna tablettbild tillhandahålls av National Library of Medicine’s PillBox.

Läkemedelsnamn: Butalbital, aspirin och koffein
Ingregering(er): BUTALBITAL, ASPIRIN, KAFFEIN
Imprint: WATSON;3219
Dosage: 50 mg
Färg: Vaddå? Färg: Grön, Gul
Förm: Kapsel
Storlek (mm): 22
Score: 1
NDC:05913219
Läkemedelsetikett Författare: Watson Laboratories, Inc.
Denna tablettbild tillhandahålls av National Library of Medicine’s PillBox.
Läkemedelsnamn: Butalbital, aspirin och koffein tabletter
Ingredienser: Butalbital, aspirin och koffein tabletter
Ingrediens(er): Butalbital, aspirin och koffein tabletter: ASPIRIN, BUTALBITAL, KAFFEIN
Imprint: West;ward;785
Dosering: 50 mg
Färg: Färg: Vit, vit, vit, vit, vit, vit, vit, vit, vit, vit: Färg: Vit
Förm: Rund
Storlek (mm): 7
Score: 1
NDC:06032548
Författare av läkemedelsetikett: Denna tablettbild tillhandahålls av National Library of Medicine’s PillBox.
Package and Label Display Panel
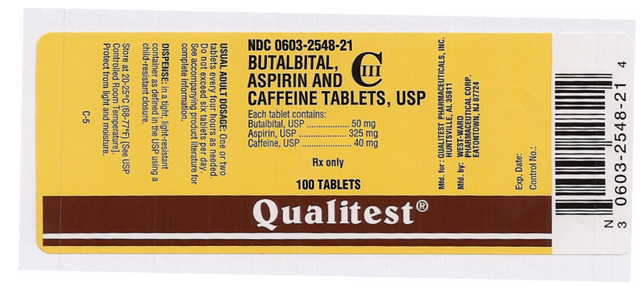
Denna bild av FDA-etiketten tillhandahålls av National Library of Medicine.

Denna bild av FDA:s etikett tillhandahålls av National Library of Medicine.
Patientrådgivning
Det finns begränsad information om patientrådgivning för Butalbital i läkemedelsetiketten.
Försiktighet med alkohol
Märkesnamn
Det finns begränsad information om Butalbitals märkesnamn i läkemedelsetiketten.
Look-Alike Drug Names
Det finns begränsad information om Butalbitals Look-Alike Drug Names i läkemedelsetiketten.
Status för läkemedelsbrist
.