Vad är kobolt
Kobolt (uttal: KO-bolt) är ett hårt, glänsande silverblått grundämne som tillhör gruppen av övergångsmetaller och representeras av den kemiska symbolen Co . Det är kemiskt aktivt och kan bilda många föreningar . Det är en ferromagnetisk metall som kan magnetiseras och legeras med nickel och aluminium för att producera kraftfulla magneter .

Kobolt Symbol
Isotoper
Den har en stabil, naturligt förekommande isotop, 59Co och 28 radioisotoper varav de mest stabila är 60Co, 57Co, 56Co och 58Co med halveringstider på 5,2714 år, 271,8 dagar, 77,27 dagar respektive 70,86 dagar . Halveringstiderna för övriga radioisotoper är mindre än 18 timmar.
Var finns kobolt
Kobolt förekommer naturligt i kombination med andra grundämnen i mineraliska malmer som kobaltit (en sulfid som innehåller kobolt, arsenik, järn och nickel), erytrit (hydratiserad koboltarsenat) och skutterudit (koboltarsenat). Det erhålls i allmänhet som en biprodukt vid koppar- och nickelbrytning .
De manganknölar som finns på havsbottnarna är enorma reserver av övergångsmetaller, som innehåller tonvis med kobolt . De tre största länderna med koboltreserver är Demokratiska republiken Kongo (DRC), Australien och Kuba, medan de tre största producenterna är DRC, Kina och Zambia .

Kobolt
Historia
Namnets ursprung: Namnet kommer från ”kobald”, tyska för ”troll” och från ”cobalos”, ett grekiskt ord som betyder ”gruva” .
Vem upptäckte den? När och hur det upptäcktes
Tutankhamons grav, den forntida egyptiska faraon som regerade 1361-1352 f.Kr., innehöll ett djupblått glasföremål som var tillverkat av kobolt. I Kina användes koboltblått för att göra keramikglasyrer.
Bortsett från dess antika ursprung går dess upptäckt på senare tid tillbaka till 1730-talet när Georg Brandt var intresserad av blå malm från några av de lokala gruvorna . Slutligen lyckades han bevisa att den blå malmen innehöll en ny metall . Han beskrev dess egenskaper och publicerade resultaten 1739.
Hans upptäckt var kontroversiell, eftersom andra kemister ifrågasatte hans resultat under många år. Hans svenska kemikerkollega Torbern Bergman genomförde dock ytterligare studier och bekräftade Georg Brandts upptäckt 1780 .
Kobolt Identifiering |
|||
| Atomnummer | 27 | ||
| CAS-nummer | 7440-48-4 | ||
| Position i det periodiska systemet | Grupp | Period | Block |
| 9 | 4 | d | |
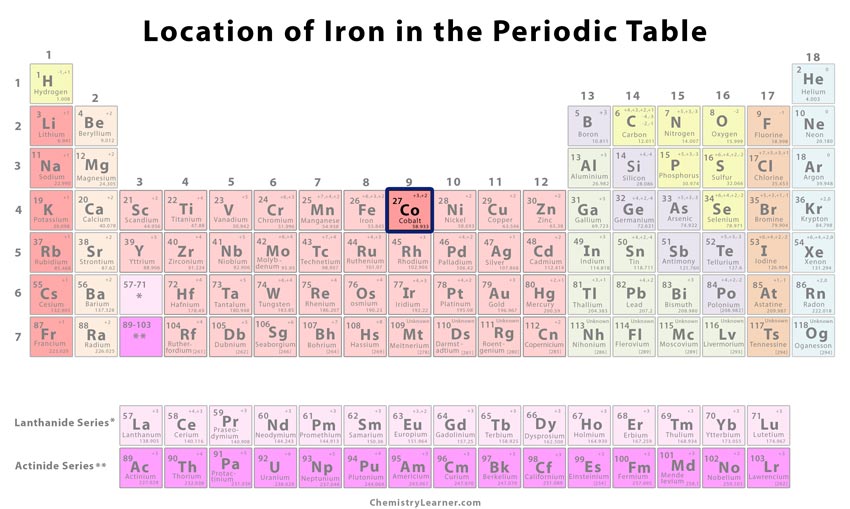
Varifrån? är kobolt placerat i det periodiska systemet
Egenskaper och kännetecken för kobolt
Allmänna egenskaper |
||||||||||||||||
| Relativ atommassa | 58.933 | |||||||||||||||
| Atomvikt | 58,933 amu | |||||||||||||||
| Molarmassa | 58,9331950 ± 0,0000050 g/mol | |||||||||||||||
| Molmassa | 58.933 g/mol | |||||||||||||||
Fysikaliska egenskaper |
||||||||||||||||
| Färg | Silverblått, blåaktigt vitt | |||||||||||||||
| Smältpunkt/fryspunkt | 1495 °C, 2723 °F | |||||||||||||||
| Kokpunkt | 2927 °C, 5301 °F | |||||||||||||||
| Densitet | 8.86 g cm-3 | |||||||||||||||
| Materialtillstånd vid rumstemperatur (fast/flytande/gas) | Fasta | |||||||||||||||
| Hårdhet | ||||||||||||||||
| – Brinell | 700 MPa | |||||||||||||||
| – Mohs | 5 | |||||||||||||||
| – Vickers | 1043 MPa | |||||||||||||||
| Elektisk ledningsförmåga | 1.7 X 107 S/m | |||||||||||||||
| Ionisk laddning | 3+ | |||||||||||||||
| Thermisk (värme)konduktivitet | 100 W/(m K) | |||||||||||||||
| Specifik värme | 421 J kg-1 K-.1 | |||||||||||||||
| Bulkmodul | Okänd | |||||||||||||||
| Skärmodul | Okänd | |||||||||||||||
| Youngs modul | Okänd | |||||||||||||||
| Damptryck | ||||||||||||||||
| – Temperatur (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | |||||
| – Tryck (Pa) | – | – | – | 2.09 X 10-10 | 1,00 X 10-6 | 4,19 X 10-4 | 0,0379 | 1.15 | 16 | – | – | |||||
Kemiska egenskaper |
||||||||||||||||
| Oxidationstillstånd | 3, 2, 0, -1 | |||||||||||||||
| Isotoper | Isotop | Massa | Antal (%) | Halveringstid | Sönderfallssätt | |||||||||||
| 59Co | 58.933 | 100 | – | – | ||||||||||||
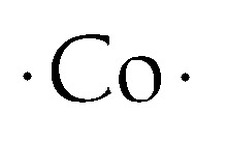
Kobolt Lewis Dot Structure
Atomdata för kobolt (element 27)
| Valenceelektroner | 9 | |||||||
| Kvantantal | ||||||||
| Kvantantal | ||||||||
| – n | 3 | |||||||
| – ℓ | 2 | |||||||
| – mℓ | -1 | |||||||
| – ms | -1/2 | |||||||
| Elektronkonfiguration (ädelgaskonfiguration) | 3d74s2 | |||||||
| Atomstruktur | ||||||||
| – Antal elektroner | 27 | |||||||
| – Antal neutroner | 32 | |||||||
| – Antal protoner | 27 | |||||||
| Atomens radie | ||||||||
| – Atomens radie | 2.00 Å | |||||||
| – Kovalent radie | 1,18 Å | |||||||
| Elektronegativitet (Pauling-skala) | 1,88 | |||||||
| Elektronaffinitet | 63.873 kJ mol-1 | |||||||
| Ioniseringsenergi (kJ mol-1) | 1st | 2nd | 3rd | 4th | 5th | 6th | 7th | 8th |
| 760.402 | 1648.356 | 3232.3 | 4949.7 | 7670.6 | 9842 | 12437 | 15225.4 | |
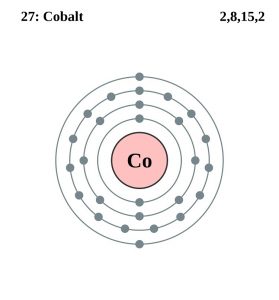
Kobolt elektronkonfiguration (Bohr-modellen)
Vad används kobolt till
- Kobolt legeras för att användas i gasturbingeneratorer och jetmotorer på grund av dess hållfasthet vid höga temperaturer och motståndskraft mot korrosion .
- Kobolt används ibland i galvanisering på grund av dess hårdhet och attraktiva utseende.
- Det används vanligen som katodmaterial i litiumjonbatterier .
- Kobaltsalter används för att ge intensiva blå färger i glas, porslin, keramik, emalj och färg .
- Radioaktivt 60Co används för behandling av cancer och vid bestrålning av livsmedel för att kontrollera patogener och förlänga hållbarheten .
- Stellite superlegeringar, som består av krom, kobolt och volfram, används för att tillverka skärverktyg med hög temperatur och hög slitstyrka .
Toxicitet och hälsoeffekter av kobolt
Koboltförgiftning kan inträffa när man oavsiktligt får i sig, andas in det, eller om man har det i kontakt med huden i stora mängder . I stora mängder kan kobolt vara cancerframkallande hos människor och vissa djur .
Det finns i spårmängder hos människor och är en viktig komponent i vitamin B12 . Små doser av kobolt ges också till vissa djur för att förebygga mineralbrist hos dem .

Koboltmineral (kobaltit)
Interessanta fakta
- Kobolt representeras grafiskt av en ”kobold” eller trollkarl (som ansågs vara besvärlig av de tyska gruvarbetarna under medeltiden) med lite kinesiskt porslin i bakgrunden, vilket hänvisar till att det användes som glasyr för keramik i det gamla Kina .
- Kobolt kan behålla sina magnetiska egenskaper upp till en temperatur (Curiepunkten) på 1 121 °C (2049.8 °F), den högsta av alla ferromagnetiska grundämnen .
- 2010 använde tyska forskare en koboltatom för att fånga de första bilderna av spinnförändringar .
Priset på kobolt
Kostnaden för ren kobolt är cirka 0,21 dollar per gram, och i lösvikt kostar den cirka 0 dollar.044 per gram .
- http://www.rsc.org/periodic-table/element/27/cobalt
- https://education.jlab.org/itselemental/ele027.html
- https://www.livescience.com/29275-cobalt.html
- https://www.chemicool.com/elements/cobalt.html
- https://education.jlab.org/itselemental/iso027.html
- https://www.webqc.org/molecular-weight-of-Co%28cobalt%29.html
- https://pubchem.ncbi.nlm.nih.gov/compound/cobalt#section=Top
- http://periodictable.com/Elements/027/data.html
- http://www.gpb.org/files/pdfs/gpbclassroom/chemistry/ionicChargesChart.pdf
- http://dwb4.unl.edu/Chem/CHEM869B/CHEM869BLinks/learn.chem.vt.edu/tutorials/bonding/valence.html
- http://chemistry-reference.com/q_elements.asp?Symbol=Co&language=en
- https://medlineplus.gov/ency/article/002495.htm