Varje elektron i en atom kan identifieras entydigt med en uppsättning av fyra kvantnummer.

Trots att deras upptäckt krävde avancerad matematik är de alla konventionella tal: tre av dem kan bara anta enkla heltalsvärden; det fjärde är en enkel bråkdel.
De tre första kvanttalen uppstår ur vågfunktionen, Ψ, som erhålls genom att lösa Schrödingerekvationen.
Det fjärde kvantantalet, elektronspinn, uppstår genom upptäckten att elektroner har två möjliga orienteringar.
Talen och deras definitioner är följande:
Kvanttalen
| Kvanttal | Namn | Möjliga värden | Information |
|---|---|---|---|
| n | Principalt kvanttal | 1, 2, 3,…, n | Definierar det energiskal som elektronen intar. Skalen närmast kärnan har det lägsta värdet på n och den lägsta potentiella energin.n är det första talet som skrivs i elektronkonfigurationer som magnesiums: 1s2 2s2 2p6 3s2 |
| l | orbitalt vridmomentkvanttal (även kallat azimutalt kvanttal) |
0, 1, 2,…, (n-1) | Definierar delskalet med energi – i system med mer än en elektron har delskalen olika energier. l definierar bokstaven för delskalet i elektronkonfigurationer. Till exempel: 1s2 2s2 2p6 3s2 l = 0 ger ett s-underskal. l = 1 ger ett p-underskal. l = 2 ger ett d-underskal, osv. |
| ml | magnetiskt kvanttal | -l, (l+1), …, 0, …. , (l+1), l | Definierar orienteringen av subshellorbitalet. Det p-subskalet, med l = 1, har tre ml-värden: Dessa anger att det finns tre p-orbitaler, dvs. orbitalerna px, py och pz. Den d-subskaliga skalan, med l = 2, har fem ml-värden: -Dessa anger att det finns fem d-orbitaler. |
| ms | Elektronspinnkvanttal | -½ eller +½ | Elektroner har två möjliga spinnriktningar. |
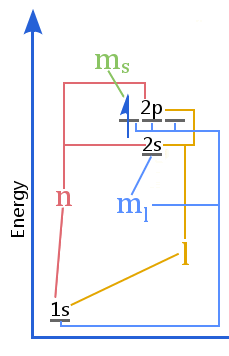
Energinivådiagrammet visar förhållandet mellan kvantnummer kontra skal, underskal, orbitaler och elektronspinn i en atom.
Ingen elektron i en atom delar alla fyra kvantnummer.Varje elektron kan identifieras entydigt genom sitt kvantnummer – se Paulis uteslutningsprincip.
Orbitalernas former ges inte av kvantnumren, utan är sannolikhetstätheter – tredimensionella kartor över utrymmet runt kärnan där en elektron kommer att befinna sig i 99 procent av fallen.Orbitalformerna erhålls från kvadraten på vågfunktionen, Ψ2.Den exakta platsen och rörelsen för en elektron kan aldrig vara känd – se Heisenbergs osäkerhetsprincip.
