Introduktion
Gram-positiva bakterier av släktena Bacillus och Clostridium kan differentiera sig för att bilda en endospor (spor), en metaboliskt vilande cell som produceras som svar på förhållanden som inte tillåter celltillväxt (McKenney et al., 2012). När sporen väl släpps ut i miljön överlever den i sitt vilande tillstånd under extremt långa perioder och motstår ett stort antal påfrestningar som höga temperaturer, uttorkning, avsaknad av näringsämnen och närvaron av giftiga kemikalier (McKenney et al., 2012). Den vilande sporen kan dock kontinuerligt övervaka miljön och reagera på närvaron av vatten och näringsämnen genom att gro och ge upphov till en vegetativ cell som kan växa och sporulera (McKenney et al., 2012). Motståndskraften mot icke-fysiologiska förhållanden beror delvis på sporernas ytstrukturer. I Bacillus subtilis, modellsystemet för sporbildare, är sporytan organiserad i ett flerskiktat hölje och i en skorpa, ett nyligen upptäckt skikt som omger sporhöljet (McKenney et al., 2012). B. subtilis sporer är negativt laddade (Huang et al., 2010; Pesce et al., 2014) och har en relativ hydrofobicitet som delvis beror på glykosylering av vissa proteiner på sporsytan (Cangiano et al., 2014; Rusciano et al., 2014). Hos flera Bacillus- och Clostridium-arter, inklusive B. cereus, B. anthracis, B. megaterium och C. difficile, är den yttersta sporstrukturen exosporium, ett morfologiskt distinkt skikt bestående av proteiner och glykoproteiner som omger höljet (Díaz-González et al., 2015; Manetsberger et al, 2015b; Stewart, 2015).
Bakteriesporen har föreslagits som en plattform för att visa upp heterologa proteiner, med potentiella tillämpningar som sträcker sig från utveckling av vacciner för slemhinnor till återanvändbara biokatalysatorer, diagnostiska verktyg och anordningar för biologisk sanering (Knecht et al., 2011; Isticato och Ricca, 2014; Ricca et al., 2014). Den anmärkningsvärda och väldokumenterade resistensen hos sporerna (McKenney et al., 2012), flera sporbildande arters lämplighet för genetisk manipulation (Harwood och Cutting, 1990) och flera arters säkerhet (Cutting, 2011; Baccigalupi et al., 2015) stöder användningen av sporerna som ett visnings- och leveranssystem. Två strategier har utvecklats för att visa upp heterologa proteiner på sporens yta. En rekombinant strategi, som bygger på konstruktion av genfusioner mellan DNA som kodar för ett utvalt protein på sporsytan och DNA som kodar för det protein som ska visas, har under årens lopp använts för att visa upp en mängd olika heterologa proteiner (Isticato och Ricca, 2014). Ett icke-rekombinant tillvägagångssätt, baserat på spontan adsorption mellan renade sporer och renade proteiner, har också använts för att visa olika enzymer och antigener (Ricca et al., 2014). De molekylära detaljer som styr adsorptionen av sporer har inte helt klarlagts. Det är känt att adsorptionen är effektivare när pH i bindningsbufferten är surt (pH 4) (Huang et al., 2010; Sirec et al., 2012) och att en kombination av elektrostatiska och hydrofoba interaktioner sannolikt är inblandade i interaktionen (Huang et al., 2010; Sirec et al., 2012). Det är också känt att mutantsporer med kraftigt förändrade sporytor interagerar mer effektivt än isogena vildtypssporer med modellproteiner (Sirec et al., 2012; Donadio et al, 2016).
Här använde vi ett fluorescerande protein, den monomera formen av det röda fluorescerande proteinet (mRFP) från korallen Discosoma sp. (Campbell et al., 2002), för att utvärdera om sporer av B. megaterium kan interagera med och adsorbera ett heterologt modellprotein. B. megaterium består av ett antal morfologiskt distinkta stammar som delar de ovanligt stora dimensionerna hos både celler (längd upp till 4 μm och en diameter på 1,5 μm) och sporer (längd upp till 3 μm och en diameter på 1 μm) (Di Luccia et al., 2016). Sporer av vissa stammar av B. megaterium omges av ett exosporium, och eftersom hittills endast sporer av arter som saknar exosporium har betraktats som adsorptionsplattformar, finns det inga uppgifter om exosporiets inverkan på interaktionen med heterologa proteiner.
Stammen QM B1551 är den bäst karakteriserade stammen av B. megaterium. Denna stam bär omkring 11 % av sitt genom på sju inhemska plasmider (Rosso och Vary, 2005; Vary et al., 2007; Eppinger et al., 2011), varav två – pBM500 och pBM600 – har identifierats som bärare av gener som är väsentliga för bildandet av denna stams karakteristiska ”valnötsformade” exosporium (Manetsberger et al., 2015a). Proteinsammansättningen i QM B1551:s exosporium är ännu dåligt karakteriserad, och endast ett fåtal gener som kodar för ortologer av erkända exosporieproteiner i sporer av andra arter har identifierats genom genomiska analyser. Dessa inkluderar gener som kodar för BclA nap-proteiner, som bildar en lokaliserad nap i B. megaterium QM B1551-sporer, plus en ortolog av BxpB-proteinet som bildar det basala skiktet av exosporium i sporer från B. cereus-familjen. Det sistnämnda tycks fylla en annan roll i B. megaterium QM B1551-sporer, eftersom en nollmutantstam behöll ett till synes normalt exosporium (Manetsberger et al, 2015a).
I den här artikeln presenterar vi data som visar att sporer av B. megaterium QM B1551 effektivt kan adsorbera mRFP och ger bevis för att proteinmolekyler kan korsa den permeabilitetsbarriär som exosporiumet utgör för att lokalisera sig i mellanskiktets utrymme.
Material och metoder
Bakteriestammar, sporer och RFP-produktion
De B. megateriumstammar som används i denna studie är QM B1551 och dess plasmidlösa derivat PV361 (Rosso och Vary, 2005). Den B. subtilis-stam som användes i denna studie var PY79 (Youngman et al., 1984). Sporulering av alla Bacillus-stammar inducerades genom utmattningsmetoden (Cutting och Vander Horn, 1990). Efter 30 timmars tillväxt i Difco Sporulation (DS) medium vid 37°C med kraftig skakning samlades sporerna in och renades enligt beskrivningen av Nicholson och Setlow (1990) med hjälp av inkubation över natten i H2O vid 4°C för att lysera kvarvarande sporangialceller. Antalet renade sporer som erhölls mättes genom direkträkning med en Bürker-kammare under ett optiskt mikroskop (Olympus BH-2 med 40×-objektiv).
För mRFP-produktion användes celler av Escherichia coli stam RH161 (Donadio et al, 2016), som bär uttrycksvektorn pRSET-A med en inframe-fusion av 5′-änden av den rfp-kodande regionen till sex histidin-kodoner under transkriptionskontroll av en T7-promotor, odlades i 18 timmar vid 37 °C i 100 ml autoinduktionsmedium för att uttrycka det heterologa proteinet (Isticato et al., 2010). Det His6-märkta RFP-proteinet renades under nativa förhållanden med hjälp av en His-Trap-kolonn enligt tillverkarens rekommendation (GE Healthcare Life Science). Det renade proteinet avsaltades med hjälp av en PD10-kolonn (GE Healthcare Life Science) för att avlägsna höga NaCl- och imidazolkoncentrationer.
Adsorptionsreaktion
Om inte annat anges tillsattes 5 μg renat rekombinant mRFP till en suspension av sporer (5 × 108) i 50 mM natriumcitrat pH 4,0 vid 25 °C i en slutvolym på 200 μl. Efter 1 h inkubation centrifugerades bindningsblandningen (10 min vid 13 000 g) för att fraktionera mRFP-bundna sporer i pelletsen från fritt mRFP i supernatanten.
Western- och Dot-Blot-analys
Sporepellets från adsorptionsreaktioner resuspenderades i 40 μl sporpälsutvinningsbuffert (Nicholson och Setlow, 1990; Giglio et al, 2011), inkuberades vid 68 °C i 1 timme för att lösa upp proteiner från sporskaft och laddades på en 12-procentig SDS-PAGE-gel. Proteinerna elektroöverfördes sedan till nitrocellulosafilter (Amersham Pharmacia Biotech) och användes för Western blot-analys som tidigare rapporterats (Isticato et al., 2008) med hjälp av monoklonala mRFP-igenkännande anti-His-antikroppar (Sigma). En kvantitativ bestämning av mängden mRFP erhölls genom dot blot-experiment där man jämförde serieutspädningar av renad mRFP och supernatant från bindningsanalysen. Filtren visualiserades sedan med ECL-prime-metoden (Amersham Pharmacia Biotech) och utsattes för densitometrisk analys med Quantity One 1-D Analysis Software (Bio-Rad). Dot blot och relativa densitometriska analyser utfördes tre gånger för att verifiera resultatens signifikans.
Fluorescens och immunofluorescensmikroskopi
Post-adsorptionssporer resuspenderades i 50 μl 1x PBS pH 4,0 och 5 μl av suspensionen placerades på mikroskopglas och täcktes med ett täckglas som tidigare behandlats i 30 s med poly-L-lysin (Sigma). Immunofluorescens utfördes enligt beskrivningen av Isticato et al. (2013), med följande ändringar: 2,0 × 106 RFP-adsorberade sporer av QM B1551 och PV361 B. megaterium-stammar förbehandlades med 1 % bovint serumalbumin (BSA) – 1x PBS pH 4,0 i 30 minuter före 2 h inkubation vid 4 °C med anti-polyHistidin-antikroppar (mus; Sigma) utspädda 1:20 i 1x PBS pH 4,0-1 % BSA. Som en kontroll av denna tekniks specificitet behandlades icke adsorberade sporer direkt med anti-His-antikroppar. Efter tre tvättar inkuberades proverna med en 64-faldigt utspädd sekundär antikropp mot mus som är konjugerad med fluoresceinisotiocyanat, FITC (Santa Cruz Biotechnology, Inc.) och tvättades fyra gånger med 1x PBS pH 4,0. Tvättade prover resuspenderades i 20 μl 1x PBS pH 4,0 och 10 μl analyserades. Alla prover observerades med ett Olympus BX51-fluorescensmikroskop utrustat med ett 100× UPlan F1-oljeobjektiv; U-MNG- eller U-MWIBBP-kuberfilter användes för att detektera den röda fluorescensemissionen från mRFP respektive den gröna emissionen från FITC-konjugerade antikroppar. Exponeringstiderna låg mellan 200 och 3000 ms. Bilderna togs med en Olympus DP70 digitalkamera och bearbetades med Image Analysis Software (Olympus) för mindre justeringar av ljusstyrka, kontrast och färgbalans (McCloy et al., 2014). ImageJ (v1.48, NIH) användes för att rita en kontur runt 80 sporer för varje stam och lägsta, högsta och genomsnittliga fluorescensvärden per pixel registrerades för varje spor. Värden för fluorescensintensitet visades därefter som boxplots med 5-95 % konfidensintervall (McCloy et al., 2014).
Statistisk analys
Resultaten från dot blot- och fluorescensmikroskopianalysen är medelvärden från tre oberoende experiment. Statistisk signifikans bestämdes med Student t-testet och signifikansnivån sattes till P < 0,05.
Resultat
mRFP från Discosoma sp. adsorberas av B. megaterium-sporer
För att verifiera om sporer av B. megaterium QM B1551 kunde adsorbera mRFP inkuberades 5 μg av det renade proteinet (Material och metoder) med 5,0 × 108 renade sporer. Adsorptionsreaktionen utfördes i 50 mM natriumcitrat vid pH 4,0 enligt tidigare beskrivning (Sirec et al., 2012). Efter reaktionen tvättades sporerna noggrant med 1x PBS pH 4,0, sporernas ytproteiner extraherades enligt beskrivningen i Material och metoder och analyserades genom western blotting med anti-polyHistidin-Peroxidas-antikropp (Sigma), som känner igen den histidin-taggade N-terminalen av mRFP. Som visas i figur 1A extraherades mRFP från sporer, vilket tyder på att den absorberades under reaktionen och sedan frigjordes genom extraktionsbehandlingen. För att utvärdera adsorptionens effektivitet analyserade vi mängden mRFP som lämnades obunden, dvs. post-adsorberade sporer samlades upp genom centrifugering och supernatanten späddes seriellt och analyserades genom dot blotting (figur 1B). En densitometrisk analys av dot blot (kompletterande tabell 1) visade att när 5 μg mRFP användes i adsorptionsreaktionen lämnades mindre än 1 % obundet, vilket tyder på att cirka 99 % av det heterologa proteinet adsorberades till B. megaterium-sporer.

FIGUR 1. Bacillus megaterium QM B1551-sporer adsorberar mRFP. 5 × 108 sporer inkuberades med 5 μg renad mRFP och proverna centrifugerades sedan. (A) Sporernas ytproteiner extraherades från pelletfraktionen genom SDS-DTT-behandling, fraktionerades på SDS-PAGE och analyserades med Western blot. Renad mRFP (20 μg) användes som markör. (B) Supernatanten, som innehöll obundet mRFP, späddes seriellt och analyserades med dot blot (QM B1551). Serieutspädningar av renad mRFP (mRFP) användes som standard. (C) Sporer som adsorberats med mRFP tvättades två gånger (W1 och W2) med PBS-buffert vid pH 3,0 eller pH 7,0, eller med en 1M NaCl, 0,1% Triton X-100-lösning. Serieutspädningar av renad mRFP och obunden mRFP (UN-mRFP) användes som standarder. Immunreaktioner i alla paneler utfördes med mRFP-igenkännande anti-His-antikropp konjugerad med pepparrotsperoxidas.
För att analysera om adsorberade mRFP-molekyler var tätt bundna till sporernas yta tvättades sporerna efter adsorptionsreaktionen två gånger med PBS-buffert vid pH 3,0 eller pH 7,0, eller med en lösning med 1M NaCl, 0,1 % Triton X-100 som tidigare beskrivits (Donadio et al., 2016). Som visas i figur 1C, och stöds av densitometrisk analys av dot blot (kompletterande tabell 2), orsakade tvättarna vid pH 3,0 ingen frigörelse av den adsorberade mRFP, medan tvättarna vid pH 7,0 eller med 1M NaCl, 0,1% Triton X-100 orsakade en minimal, mindre än 1%, frigörelse av mRFP-molekyler. De resultat som presenteras i figur 1 tyder därför på att mRFP adsorberades effektivt och var fast bunden till B. megaterium-sporer. För att bedöma om spor-adsorberade mRFP-molekyler behöll sina fluorescensegenskaper utförde vi en fluorescensmikroskopisk analys. Som visas i figur 2 var reaktionssporerna efter adsorptionen förknippade med en stark fluorescenssignal som var synlig runt hela sporsytan.
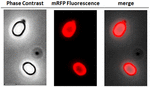
FIGUR 2. Fluorescensmikroskopisk analys av B. megaterium QM B1551-mRFP-sporer. QM B1551-sporer som inkuberats med mRFP (5 μg) och därefter tvättats analyserades med fluorescensmikroskopi. Samma mikroskopifält observerades med faskontrast och fluorescensmikroskopi. Skala 1 μm. Den sammanslagna panelen redovisas. Exponeringstiden var 200 ms.
Exosporium har en viktig roll i mRFP-adsorption
Stammen QM B1551 av B. megaterium innehåller sju inhemska plasmider (Rosso och Vary, 2005; Eppinger et al., 2011) och plasmid-kodade gener är viktiga för exosporiumbildningen (Manetsberger et al., 2015a). PV361 är en QM B1551-härdad stam som saknar alla sju plasmider och som följaktligen helt saknar exosporium (Manetsberger et al., 2015a). Vi använde sporer av stam PV361 för att analysera exosporiets roll i mRFP-adsorptionen. Parallellt använde vi också sporer av B. subtilis PY79 som i en tidigare studie har visat sig adsorbera mRFP (Donadio et al., 2016). För att jämföra adsorptionseffektiviteten hos sporer av stammarna B. subtilis PY79 och B. megaterium QM B1551 och PV361 adsorberade vi 5 μg renad mRFP med 5,0 × 108 sporer av var och en av de tre stammarna. Efter adsorptionsreaktionerna samlades sporer upp genom centrifugering, proteiner extraherades genom SDS-DTT-behandling och analyserades genom western blotting med mRFP-igenkännande anti-His-antikropp. Som framgår av figur 3A extraherades mRFP uppenbarligen i större mängder från sporer från QM B1551 än från sporer från de andra två stammarna. I ett försök att kvantifiera dessa uppenbara skillnader späddes obundet mRFP från adsorptionsreaktionerna seriellt och analyserades genom dot blotting (figur 3B). En densitometrisk analys av dot blot-analysen i figur 3B (kompletterande tabell 3) visade att PY79- och PV361-sporer adsorberade cirka 90 % av den totala mRFP medan QM B1551-sporer adsorberade nästan all (över 99 %) renad mRFP.
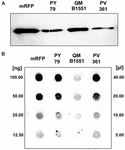
FIGUR 3. Monomeric Red Fluorescent Protein adsorption till sporer av B. megaterium QM B1551 och PV361 och B. subtilis PY79. 5 × 108 sporer av varje stam inkuberades med 5 μg renat mRFP och proverna centrifugerades sedan. Sporer i pelletfraktionerna användes för att extrahera ytproteiner som därefter analyserades med western blot (A), medan supernatanterna späddes seriellt och analyserades med dot blot (B). Seriella utspädningar av renad mRFP användes som standarder. Immunreaktionerna i båda panelerna utfördes med anti-His-antikropp konjugerad med pepparrotsperoxidas.
Absorptionseffektiviteten hos sporer från de tre stammarna analyserades också med fluorescensmikroskopi (figur 4A och kompletterande figur S1). Mikroskopibilderna analyserades med ImageJ-programvaran (v1.48, NIH) för att utföra kvantitativ fluorescensbildanalys och sporfluorescensen beräknades enligt beskrivningen i Material och metoder. Analysen av 80 sporer av varje stam visade ett genomsnittligt fluorescensvärde per pixel på 52,43 (± 5,94), 20,81 (± 2,71) och 32,33 (± 2.97; godtyckliga enheter) för QM B1551, PV361 respektive PY79 (figur 4B), vilket ger ytterligare bevis för att QM B1551-sporer adsorberade mer mRFP än sporer från de andra två stammarna.
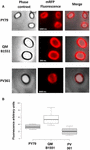
FIGUR 4. Effektiv adsorption av mRFP till sporer av B. megaterium QM B1551 och PV361 och B. subtilis PY79. (A) Fluorescensmikroskopiska bilder av PY79-, QM B1551- och PV361-sporer efter mRFP-adsorption och tvättning. Exponeringstiderna är angivna. Faskkontrast och överlagring av röd fluorescens visas (sammanslagna panelen). Skala 1 μm. (B) Box plots som visar fluorescensintensiteten hos åttio olika sporer av varje stam. Gränserna i varje ruta representerar den första och tredje kvartilen (25 och 75 %) och värdena utanför rutorna representerar de högsta och lägsta värdena. Linjen som delar boxen anger medianvärdet för varje stam. P-värdet är mindre än 0,0001.
Baserat på resultaten i figurerna 3 och 4 drar vi slutsatsen att det exosporium som finns i QM B1551 och saknas i PV361 har en relevant roll i adsorptionen av mRFP.
För övrigt visade resultaten i figur 4 att B. subtilis PY79-sporer är effektivare än B. megaterium PV361-sporer när det gäller att adsorbera mRFP, medan dot blotting som redovisas i figur 3B visade på liknande adsorptionseffektivitet för de två stammarna. Vi tror att denna diskrepans beror på en stark minskning av fluorescensen när mRFP binds till PV361 men inte till PY79- eller QM B1551-sporer (se nedan).
Kvantitativ bedömning av mRFP-adsorption till QM B1551-sporer
Dot blot-experiment (figur 3B) visade att när 5 μg renad mRFP användes i adsorptionsreaktioner med 5,0 × 108 sporer av QM B1551-stammen var nästan allt heterologt protein bundet till sporen. För att fastställa den maximala mängden mRFP som kan adsorberas till QM B1551-sporer upprepade vi reaktionerna med ökande koncentrationer av renad mRFP, dvs. 5,0 × 108 QM B1551-sporer reagerades med 5, 10, 20, 40, 80 och 160 μg renad mRFP. Efter reaktionerna samlades sporerna upp genom centrifugering och supernatanterna som innehöll obundet mRFP späddes seriellt och analyserades genom dot blotting (figur 5A). Figur 5B visar resultaten av en densitometrisk analys av dot blot (??), som visar att när 5-80 μg mRFP reagerade med 5 × 108 sporer var andelen protein som var bundet till sporer över 90 %. En minskning av bundet mRFP observerades när 160 μg renat protein användes i reaktionen. Även när 160 μg renad mRFP användes absorberades dock över 60 % av proteinet, vilket tyder på att 5,0 × 108 sporer av QM B1551 kan adsorbera cirka 100 μg mRFP.
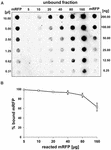
FIGUR 5. Kvantitativ bedömning av mRFP-adsorption till B. megaterium QM B1551-sporer. 5 × 108 sporer inkuberades med 5, 10, 20, 40, 80 och 160 μg renad mRFP. Reaktionsblandningarna centrifugerades därefter och supernatanterna späddes seriellt och analyserades med dot blot (A). Seriella utspädningar av renad mRFP användes som standarder. Immunreaktionerna i båda panelerna utfördes med anti-His-antikropp konjugerad med pepparrotsperoxidas. (B) Procentuell andel mRFP som adsorberas på sporer efter reaktion med definierade mängder endogen mRFP. Felstaplarna visar standardfel för medelvärdet från tre experiment och P-värdet aldrig över 0,0025.
mRFP lokaliseras till intercoatutrymmet i B. megaterium QM B1551-sporer
En immunfluorescensmikroskopisk metod användes för att bedöma om adsorberade mRFP-molekyler exponerades på ytan av B. megaterium QM B1551-sporer. QM B1551-sporer adsorberade med olika mängder mRFP reagerades med monoklonal anti-His-antikropp som känner igen den rekombinanta mRFP, sedan med fluorescerande sekundär antikropp mot mus (Santa Cruz Biotechnology, Inc.) och observerades i fluorescensmikroskop (figur 6). Med den lägsta mängden mRFP som användes i detta experiment (2 μg) observerades mRFP-fluorescenssignalen (röd) runt hela sporen medan immunofluorescenssignalen (grön) var svag och huvudsakligen koncentrerad till sporens poler, vilket tyder på att mRFP exponerades på sporens yta endast i dessa punkter. Med ökad mängd mRFP i reaktionen ökade antalet gröna fläckar (5 och 10 μg) och med den högsta mängden mRFP i reaktionen (20 μg) observerades en nästan fullständig grön ring runt sporerna. Baserat på de resultat som presenteras i figur 6 antog vi att mRFP-molekylerna infiltrerar genom exosporium och lokaliseras i mellanskiktutrymmet mellan ytterskiktet och exosporium, dvs. när en låg mängd mRFP används är nästan alla proteinmolekyler interna i exosporium och är tillgängliga för antikroppen på endast några få ställen. Ökade mängder mRFP i adsorptionsreaktioner leder till att utrymmet mellan skiktet ”fylls på”, tills slutligen fler mRFP-molekyler är tillgängliga för antikroppen på sporernas yta. Denna hypotes innebär att om exosporium saknas bör all mRFP vara tillgänglig för antikroppen. För att testa detta jämförde vi genom immunofluorescensmikroskopi lika många sporer av QM B1551 (med exosporium) och av PV361 (utan exosporium) som inkuberats med samma mängd mRFP (5 μg). När exosporium fanns (QM B1551) var mRFP endast delvis tillgängligt för antikroppen och gröna fläckar observerades (figur 7 och kompletterande figur S2). När exosporium inte var närvarande (PV361) var adsorberad mRFP tillgänglig för antikroppen runt hela sporen och en fullständig grön ring bildades, vilket stödjer hypotesen att mRFP är intern i exosporium i QM B1551-sporer.
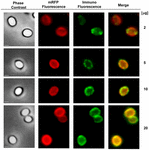
FIGUR 6. Immunofluorescensanalys av mRFP-adsorberade B. megaterium QM B1551-sporer. Alikvots av 5 × 108 QM B1551-sporer inkuberades med varierande koncentrationer av mRFP och analyserades därefter med faskontrast-, fluorescens- och immunofluorescensmikroskopi enligt beskrivningen i Material och metoder. Samma mikroskopifält för varje reaktion redovisas tillsammans med sammanslagningspanelen. Exponeringstiden var 200 ms för alla bilder. Skalstreck, 1 μm.
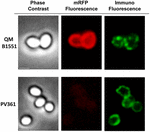
FIGUR 7. Immunofluorescens av mRFP adsorberad på B. megaterium QM B1551 och PV361-sporer. 5 × 108 QM B1551- och PV361-sporer inkuberades med 5 μg mRFP och analyserades sedan med immunofluorescensmikroskopi enligt beskrivningen i Material och metoder. För varje fält visas faskontrast och immunofluorescensmikroskopi. Exponeringstiden var 200 ms för alla bilder. Skalstreck, 1 μm.
Men medan QM B1551-sporer som användes i experimenten i figur 7 visade en fullständig röd fluorescerande ring som i figur 2, visade PV361-sporer en mycket svag röd fluorescerande signal. Med PV361-sporer observerades en röd signal endast med långa exponeringstider i fluorescensmikroskopet (figur 4). Eftersom mRFP finns runt PV361-sporer (figurerna 3 och 7) drar vi slutsatsen att mRFP-fluorescensen försvagas när proteinet adsorberas till PV361-sporer. Ytterligare experiment kommer att behövas för att fullt ut ta ställning till denna punkt.
Diskussion
De viktigaste resultaten i denna rapport är att sporer av B. megaterium är extremt effektiva när det gäller att adsorbera det heterologa modellproteinet mRFP, att exosporiumet har en viktig roll i denna process och att mRFP-molekyler infiltrerar genom exosporiumet och lokaliserar sig mellan det yttre höljet och exosporiumet. Dessa resultat utvidgar tidigare arbete som utförts på sporer av B. subtilis och visar att sporer av en annan art också kan användas för att leverera heterologa proteiner via adsorptionsmetoden. Den höga adsorptionseffektivitet som observerats med B. megateriums sporer beror delvis på den stora storleken på dess sporer jämfört med B. subtilis. B. megateriums sporers yta är ungefär 2,5 gånger större än B. subtilis sporers, med en yta på 5,33 μm2 (h: 1,60 ± 0,16 w: 0,84 ± 0,07) jämfört med 1,98 μm2 (h: 1,07 ± 0,09 w: 0,48 ± 0,03). De stora dimensionerna möjliggör adsorption av upp till 100 μg mRFP när 160 μg protein reagerar med sporer.
Observationen av att mRFP korsar exosporium tyder på att det är genomsläppligt för mRFP, ett 27 kDa-protein. Exosporiets genomsläpplighet är inte helt förvånande eftersom groddar som finns i miljön måste korsa sporens yttre skikt för att nå sina receptorer, även om groddarna vanligtvis är små molekyler med en molekylmassa som typiskt sett är <200 Da. Dessutom stämmer mRFP-data i stort sett överens med resultaten från tidigare studier som utförts med märkta dextrans och besläktade molekyler (Koshikawa et al., 1984; Nishihara et al., 1989). I dessa studier föreslogs B. megaterium QM B1551 exosporium utgöra en permeabilitetsbarriär för molekyler med molekylvikter större än 100 KDa, samtidigt som det påverkade passagen av molekyler med massor någonstans mellan 2 och 40 kDa (Koshikawa et al, 1984; Nishihara et al., 1989).
En intressant utmaning för framtida arbete blir att fastställa den mekanism eller infiltrationsväg som mRFP, och därmed andra heterologa proteiner av intresse, tar för att komma in i mellanskiktet. Undersökning med transmissionselektronmikroskopi av sektionerade B. megaterium QM B1551-sporer visar att exosporiet består av två identiska ”skal” (Manetsberger et al., 2015a), och det kan vara så att gränssnittet mellan var och en av dessa strukturer (som beskrivs som ”apikala öppningar” i tidiga artiklar) tillåter intrång av relativt stora molekyler. Det kommer också att vara av intresse att fastställa grunden för den uppenbara förlusten av mRFP-fluorescens vid adsorption till PV361-sporer, och om mRFP-molekyler kan infiltrera de yttre höljeskikten, vilket observerades för B. subtilis-sporer (Donadio et al., 2016).
I den aktuella studien ställer vi oss bakom hypotesen att mRFP-molekyler företrädesvis passerar över exosporium och ackumuleras i mellanskiktet mellan yttre hölje och exosporium. I denna modell adsorberas och visas mRFP-molekylerna på sporernas yta först när adsorptionsplatserna (eller den volymetriska kapaciteten?) i intercoat-utrymmet är tillräckligt upptagna. Detta innebär att adsorptionsmetoden för visning på ytan kan användas med B. megaterium QM B1551-sporer, även om systemet är beroende av förhållandet mellan sporer och protein som används i adsorptionsreaktionerna. Eftersom olika stammar av B. megaterium länge har använts industriellt för produktion av enzymer som amylaser och dehydrogenaser, vitaminer och antimikrobiella molekyler (Vary et al, 2007), tyder våra data på en ny bioteknisk tillämpning för B. megaterium-sporen som ett medel för att binda och leverera heterologa proteiner.
Författarnas bidrag
ML och GD – utförde de flesta av experimenten; RA och AS – bidrog till tolkningen av data för arbetet; GiC, LB och GrC – bidrog till att utforma arbetet och revidera det kritiskt; ER – bidrog till diskussioner och förslag under arbetets gång och bidrog till att skriva manuskriptet; RI – ledde arbetet och bidrog till att skriva manuskriptet. Alla författare läste och godkände det slutliga manuskriptet.
Finansiering
Detta arbete stöddes av ett stipendium (STAR Linea1- 2014) från Federico II University of Naples och Compagnia di San Paolo, Italien till RI.
Intressekonfliktförklaring
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller finansiella relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Supplementärt material
Supplementärt material för denna artikel finns online på: https://www.frontiersin.org/article/10.3389/fmicb.2016.01752/full#supplementary-material
FIGUR S1 | Helfältsbilder av fluorescensmikroskopianalysen som redovisas i figur 4. Samma mikroskopifält observerades med faskontrast och fluorescensmikroskopi. Skala 5 μm. Den sammanslagna panelen rapporteras. Exponeringstiden anges.
FIGUR S2 | Helhetsbilder av immunofluorescensanalys som redovisas i figur 7. Samma mikroskopifält observerades med faskontrast- och fluorescensmikroskopi. Skalstreck 5 μm. Exponeringstiden var 200 ms för alla bilder.
TABELL S1 | Densitometrisk analys av dot blot-experiment med supernatanten från adsorptionsreaktionen med QM B1551-sporer (figur 1B).
TABELL S2 | Densitometrisk analys av dot blot-experiment med supernatanterna från olika tvättar efter adsorptionsreaktionen (figur 1C).
TABELL S3 | Densitometrisk analys av dot blot-experiment med supernatanterna från adsorptionsreaktionen som utförts med sporer av stammarna PY79, QM B1551 och PV361 (figur 3B).
TABELL S4 | Densitometrisk analys av dot blot-experiment med supernatanten från adsorptionsreaktionen utförd med olika mängder mRFP.
Baccigalupi, L., Ricca, E. och Ghelardi, E. (2015). ”Non-LAB probiotics: sporformers”, i Probiotics and Prebiotics: Current Research and Future Trends, eds K. Venema and A. P. do Carmo (Norfolk, VA: Caister Academic Press), 93-103. doi: 10.21775/9781910190098.06
CrossRef Full Text | Google Scholar
Campbell, R. E., Tour, O., Palmer, A. E., Steinbach, P. A., Baird, G. S., Zacharias, D. A., et al. (2002). Ett monomeriskt rött fluorescerande protein. Proc. Natl. Acad. Sci. U.S.A. 99, 7877-7882. doi: 10.1073/pnas.082243699
PubMed Abstract | CrossRef Full Text | Google Scholar
Cangiano, G., Sirec, T., Panarella, C., Isticato, R., Baccigalupi, L., De Felice, M., et al. (2014). Genprodukterna sps påverkar groning, hydrofobicitet och proteinadsorption av Bacillus subtilis sporer. Appl. Environ. Microbiol. 80, 7293-7302. doi: 10.1128/AEM.02893-14
PubMed Abstract | CrossRef Full Text | Google Scholar
Cutting, S. M. (2011). Bacillus probiotika. Food Microbiol. 28, 214-220. doi: 10.1016/j.fm.2010.03.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Cutting, S., and Vander Horn, P. B. (1990). ”Genetic analysis,” in Molecular Biological Methods for Bacillus, eds C. Harwood and S. Cutting (Chichester: John Wiley and Sons), 27-74.
Google Scholar
Díaz-González, F., Milano, M., Olguin-Araneda, V., Pizarro-Cerda, J., Castro-Córdova, P., Tzeng, S. C., et al. (2015). Proteinsammansättning av det yttersta exosporiumliknande skiktet av Clostridium difficile 630-sporer. J. Proteom. 123, 1-13. doi: 10.1016/j.jprot.2015.03.035
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Luccia, B., D’Apuzzo, E., Varriale, F., Baccigalupi, L., Ricca, E. och Pollice, A. (2016). Bacillus megaterium SF185 inducerar stressvägar och påverkar cellcykelfördelningen hos mänskliga tarmepitelceller. Benef. Microb. 7, 609-620. doi: 10.3920/BM2016.0020
PubMed Abstract | CrossRef Full Text | Google Scholar
Donadio, G., Lanzilli, M., Sirec, T., Ricca, E. och Isticato, R. (2016) Protein adsorption och lokalisering på vildtyp- och mutantsporer av Bacillus subtilis. Microb. Cell Fact. 15:153. doi: 10.1186/s12934-016-0551-2
PubMed Abstract | CrossRef Full Text
Eppinger, M., Bunk, B., Johns, M. A., Edirisinghe, J. N., Kutumbaka, K. K., Koenig, S. S., et al. (2011). Genomsekvenser av de biotekniskt viktiga Bacillus megaterium-stammarna QM B1551 och DSM319. J. Bacteriol. 193, 4199-4213. doi: 10.1128/JB.00449-11
PubMed Abstract | CrossRef Full Text | Google Scholar
Giglio, R., Fani, R., Isticato, R., De Felice, M., Ricca, E. och Baccigalupi, L. (2011). Organisation och evolution av cotG- och cotH-generna i Bacillus subtilis. J. Bacteriol. 193, 6664-6673. doi: 10.1128/jb.06121-11
PubMed Abstract | CrossRef Full Text | Google Scholar
Harwood, C. R., and Cutting, S. M. (1990). Molekylärbiologiska metoder för Bacillus. Chichester: John Wiley and Sons.
Google Scholar
Huang, J. M., Hong, H. A., Van Tong, H., Hoang, T. H., Brisson, A. och Cutting, S. M. (2010). Mucosal leverans av antigener med hjälp av adsorption till bakteriesporer. Vaccine 28, 1021-1030. doi: 10.1016/j.vaccine.2009.10.127
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Pelosi, A., De Felice, M. och Ricca, E. (2010). CotE binder till CotC och CotU och förmedlar deras interaktion under bildandet av sporskaft i Bacillus subtilis. J. Bacteriol. 192, 949-954. doi: 10.1128/JB.01408-09
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Pelosi, A., Zilhão, R., Baccigalupi, L., Henriques, A. O., De Felice, M., et al. (2008). CotC-CotU heterodimerisering under sammansättning av Bacillus subtilis sporhus. J. Bacteriol. 190, 1267-1275. doi: 10.1128/JB.01425-07
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., and Ricca, E. (2014). Sporer som visas på ytan. Microbiol. Spectr. 2, 351-366. doi: 10.1128/microbiolspec.TBS-0011-2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Sirec, T., Treppiccione, L., Maurano, F., De Felice, M., Rossi, M., et al. (2013). Icke-rekombinant visning av B-underenheten av det värmelabila toxinet från Escherichia coli på vildtyp- och mutantsporer av Bacillus subtilis. Microb. Cell Fact. 12:98. doi: 10.1186/1475-2859-12-98
PubMed Abstract | CrossRef Full Text | Google Scholar
Knecht, L. D., Pasini, P. och Daunert, S. (2011). Bakteriesporer som plattformar för bioanalytiska och biomedicinska tillämpningar. Anal. Bioanal. Chem. 400, 977-989. doi: 10.1007/s00216-011-4835-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Koshikawa, T., Beaman, T. C., Pankratz, H. S., Nakashio, S., Corner, T. R. och Gerhardt, P. (1984). Korrelat för motståndskraft, groning och permeabilitet hos Bacillus megaterium-sporer som successivt avlägsnas från integumentskikt. J. Bacteriol. 159, 624-632.
PubMed Abstract | Google Scholar
Manetsberger, J., Hall, E. A. H., and Christie, G. (2015a). Plasmidkodade gener påverkar exosporiemontering och morfologi i Bacillus megaterium QM B1551-sporer. FEMS Microbiol. Lett. 362:fnv147. doi: 10.1093/femsle/fnv147
PubMed Abstract | CrossRef Full Text | Google Scholar
Manetsberger, J., Manton, J. D., Erdelyi, M. J., Lin, H., Rees, D., Christie, G., et al. (2015b). Ellipsoid lokaliseringsmikroskopi ger besked om storleken och ordningen på proteinslagren i Bacillus sporshöljen. Biophys. J. 109, 2058-2066. doi: 10.1016/j.bpj.2015.09.023
PubMed Abstract | CrossRef Full Text | Google Scholar
McCloy, R., Rogers, S., Caldon, E., Lorca, T., Castro, A. och Burgess, A. (2014). Partiell hämning av Cdk1 i G2-fasen åsidosätter SAC och frikopplar mitotiska händelser. Cell Cycle 13, 1400-1412. doi: 10.4161/cc.28401
PubMed Abstract | CrossRef Full Text | Google Scholar
McKenney, P. T., Driks, A. och Eichemberger, P. (2012). Bacillus subtilis endospore: sammansättning och funktioner hos det flerskiktade höljet. Nat. Rev. Microbiol. 11, 33-44. doi: 10.1038/nrmicro2921
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicholson, W. L., and Setlow, P. (1990). ”Sporulation, germination and out-growth,” in Molecular biological methods for Bacillus, eds C. Harwood and S. Cutting (Chichester: John Wiley and Sons), 391-450.
Google Scholar
Nishihara, T., Takubo, Y., Kawamata, E., Koshikawa, T., Ogaki, J. och Kondo, M. (1989). Den yttre höljet har en roll i Bacillus megateriums sporers resistens. J. Biochem. 106, 270-273.
PubMed Abstract | Google Scholar
Pesce, G., Rusciano, G., Sirec, T., Isticato, R., Sasso, A. och Ricca, E. (2014). Mätningar av ytladdning och hydrodynamisk koefficient av Bacillus subtilis sporer med optiska pincetter. Colloids Surf. B Biointerfaces 116C, 568-575. doi: 10.1016/j.colsurfb.2014.01.039
PubMed Abstract | CrossRef Full Text | Google Scholar
Ricca, E., Baccigalupi, L., Cangiano, G., De Felice, M. och Isticato, R. (2014). Mukosal vaccinleverans med icke-rekombinerande sporer av Bacillus subtilis. Microb. Cell Fact. 13, 115. doi: 10.1186/s12934-014-0115-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Rosso, M. L., and Vary, P. S. (2005). Distribution av Bacillus megaterium QM B1551 plasmider bland andra B. megaterium stammar och Bacillus arter. Plasmid 53, 205-217. doi: 10.1016/j.plasmid.2004.10.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Rusciano, G. Zito, G., Isticato, R., Sirec, T., Ricca, E., Bailo, E. och Sasso, A. (2014). Kemisk avbildning i nanoskala av Bacillus subtilis sporer genom att kombinera tip-enhanced Raman scattering och avancerade statistiska verktyg. ACS Nano 8, 12300-12309. doi: 10.1021/nn504595k
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirec, T., Strazzulli, A., Isticato, R., De Felice, M., Moracci, M. och Ricca, E. (2012). Adsorption av beta-galaktosidas från Alicyclobacillus acidocaldarius på sporer av vildtyp och mutanter av Bacillus subtilis. Microb. Cell Fact. 11:100. doi: 10.1186/1475-2859-11-100
PubMed Abstract | CrossRef Full Text | Google Scholar
Stewart, G. C. (2015). Exosporiumskiktet hos bakteriesporer: en koppling till miljön och den infekterade värden. Microbiol. Mol. Biol. Rev. 79, 437-457. doi: 10.1128/MMBR.00050-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Vary, P. S., Biedendieck, R., Fuerch, T., Meinhardt, F., Rohde, M., Deckwer, W. -D., et al. (2007). Bacillus megaterium – från enkel jordbakterie till värd för industriell proteinproduktion. Appl. Microbiol. Biotechnol. 76, 957-967 doi: 10.1007/s00253-007-1089-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Youngman, P., Perkins, J. B., and Losick, R. (1984). En ny metod för snabb kloning i Escherichia coli av kromosomalt DNA från Bacillus subtilis i anslutning till Tn917-insättning. Mol. Gen. Genet. 195, 424-433. doi: 10.1007/BF00341443
CrossRef Full Text | Google Scholar