Chronic Traumatic Encephalopathy (CTE) är en distinkt tau-proteinassocierad neurodegenerativ sjukdom. Det har skett en ökning av CTE-diagnoser hos idrottare, särskilt amerikanska fotbollsspelare, samt hos militärveteraner i stridsmiljöer (1, 2). Även om CTE har erkänts offentligt relativt nyligen, beskrevs den först som ”punch drunk”-syndromet i en klassisk artikel av Martland et al. (3). Rapporten var inriktad på ett antal boxare som hade drabbats av upprepade slag mot huvudet under sin karriär och som uppvisade både psykiatriska symtom och allvarliga minnes- och neurokognitiva brister, analogt med typiska demenspatienter (3). Sjukdomsbeskrivningen utvecklades till ”dementia pugilistica” (4) och slutligen CTE 1949 (5).
CTE har ett unikt neuropatologiskt kännetecken som består av ackumulering av fosforylerat tau (p-tau) i sulci och peri-vaskulära regioner, mikroglios och astrocytos. Dessa patologiska förändringar leder till en progressiv, försvagande neurodegeneration. Baserat på mönstret för den patologiska utvecklingen delas CTE in i fyra olika stadier (figur 1). I stadium I av CTE ser hjärnan grovt sett normal ut, men p-tau finns på ett begränsat antal ställen, ofta i laterala och frontala cortices, samt nära små blodkärl i djupet av sulci. Det kan finnas ett fåtal neurofibrillära trassel (NFT) och neuriter i locus coeruleus. I stadium II kan lokaliserade makroskopiska avvikelser noteras. På grova anatomiska snitt och neuroimaging observeras en utvidgning av de laterala ventriklarna, cavum septum pellucidum med eller utan fenestrering samt blekhet i locus coeruleus och substantia nigra. Det finns flera fyndplatser för p-tau i djupet av sulci, och det finns ett framväxande spridningsmönster. I stadium III uppvisar de flesta grovpatologiska sektioner makroskopiska avvikelser. Det finns en global viktförlust i hjärnan, mild atrofi i frontalloben och temporalloben samt utvidgning av ventriklarna. Hälften av CTE-patienterna uppvisar septumavvikelser, inklusive cavum septum pellucidum. P-tau-patologin sprider sig och omfattar de frontala, temporala, parietala och insulära hjärnbarken. I stadium IV är minskningen av hjärnvikten dramatisk, och hjärnvikter på 1 000 g (jämfört med 1 300-1 400 g i normala hjärnor) har rapporterats. Det finns en djupgående atrofi av de frontala och mediala temporalloberna samt främre thalami. Det finns också atrofi i den vita substansen. Majoriteten av patienterna i stadium fyra har septumavvikelser. Spridningen av p-tau påverkar de flesta regioner, inklusive den kalkariniska cortexen (7, 8). Avvikelser i fosforylerat 43 kDa TAR DNA-bindande protein (TDP-43) ses också hos de flesta CTE-patienter. Den parenkymala TDP-43-patologin är också progressiv till sin natur och liknar det anatomiska spridningsmönstret för p-tau. TDP-43 immunoreaktivitet finns i nästan alla fall av sjukdomsstadium IV (7).

Figur 1. Ovanstående bilder är en skildring av McKees fyra stadier av CTE .
Den kliniska fenotypen av CTE är ännu inte klart definierad. I följande stycken beskrivs försök till karakterisering av CTE-symtom i de olika stadierna av sjukdomsprocessen (tabell 1). Enligt McKees klassificering är en typisk CTE-patient i stadium I symtomfri eller kan klaga på milda korttidsminnesbrister och depressiva symtom. Mild aggressivitet kan observeras. I stadium II kan humör- och beteendesymptomen omfatta beteendeutbrott och allvarligare depressiva symtom. I stadium III uppvisar patienterna vanligtvis mer kognitiva brister, inklusive minnesförlust, brister i den verkställande funktionen, visuospatial dysfunktion och apati. I stadium IV uppvisar patienterna avancerade språkliga brister, psykotiska symtom inklusive paranoia, motoriska brister och parkinsonism.
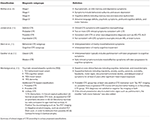
Tabell 1. CTE föreslagna kliniska klassificeringar.
Jordan et al. (10) var en av de första att kliniskt karakterisera sjukdomen. De delade in CTE:s kliniska presentationer i tre områden: beteendemässiga/psykiatriska, kognitiva och motoriska. Den beteendemässiga och psykiatriska domänen omfattade aggression, depression, apati, impulsivitet, vanföreställningar inklusive paranoia och suicidalitet. Den kognitiva domänen omfattade minskad uppmärksamhet och koncentration, minnesstörningar, brister i den verkställande funktionen, visuospatial dysfunktion, språkstörningar och demens. Slutligen bestod de motoriska egenskaperna av dysartri, avvikelser i gången, ataxi och inkoordination, spasticitet och parkinsonism som t.ex. skakningar. På grundval av dessa kliniska drag och befintlig neuropatologisk information definierades fyra diagnostiska subtyper, nämligen ”Definitiv”, ”Sannolik”, ”Möjlig” och ”Osannolik” CTE.
Stern et al. (11) och relaterade fallrapporter (14, 15) skiljde sig åt i sin beskrivning av en typisk CTE-patient, där de konceptualiserade den kliniska presentationen i två distinkta subtyper. Den första subtypen uppvisade huvudsakligen beteende- och humörförändringar och den andra presenterade huvudsakligen kognitiv försämring. Den stora majoriteten av subtypen med humör/beteende utvecklade kognitiva brister i takt med att sjukdomen fortskred. Det var dock relativt få patienter i den kognitiva gruppen som uppvisade humör- eller beteendeförändringar under sjukdomsförloppet. I studien av Stern et al. (11) hade patienterna i den kognitiva gruppen en betydligt högre sannolikhet att utveckla demens. De var också betydligt äldre vid tidpunkten för diagnosen jämfört med patienterna i humör-/beteendegruppen. Den beteendemässiga undergruppen av CTE-patienter kan likna patienter som lider av beteendevariant frontotemporal demens (bvFTD), vilket gör den kliniska diagnosen mer utmanande. Typiska bvFTD-karaktäristiska beteendemanifestationer som apati och avhämning ses dock ofta inte hos CTE-patienter (11, 16). Med tanke på bvFTD:s inneboende heterogenitet och de båda sjukdomarnas likartade tauopatiska karaktär är det en diagnostisk utmaning att särskilja bvFTD och CTE.
Utöver de beteendemässiga symtomen vid CTE är sambandet mellan självmord och CTE fortfarande ett ämne som undersöks i litteraturen. Tidigare studier, t.ex. serien av fem professionella idrottare med en bekräftad diagnos av CTE som rapporterades av Omalu et al. (17), hade antytt ett starkt samband mellan CTE och självmord. Författarna föreslog vidare att etiologin för suicidalt/parasuicidalt beteende i CTE-populationen delvis kan bero på tauopati i form av neurofibrillära tanger och neuritiska trådar i strategiska limbiska hjärnkärnor som locus ceruleus. Maroon et al. (18) granskade 153 patologiskt bekräftade fall av CTE som publicerats mellan 1954 och 2013. De rapporterade att självmordsprevalensen i CTE-populationen och olycksfallsrelaterade dödsfall var 11,7 % och 17,5 %, vilket är betydligt högre än de allmänna befolkningsnivåerna på 1,5 % respektive 4,8 % (18). Förespråkare av den motsatta uppfattningen menar att självmord främst har rapporterats i tidigare stadier av CTE, och att sambandet mellan sjukdomsutveckling och självmord förblir oklart för närvarande (19).
I en metaanalys av 158 fallstudier av Gardner m.fl. (12) delades de kliniska CTE-symtomen in i ”klassiska” respektive ”moderna” CTE-symtomen, för att göra en distinktion mellan en äldre beskrivning av CTE-fall som främst var centrerad på boxare, jämfört med en mer utvecklad klinisk beskrivning som även gäller för professionella amerikanska fotbollsspelare. Medan de ”klassiska” CTE-symtomen vanligtvis omfattade dysartri, rörelsesvårigheter och senare minnesstörningar, omfattade den ”moderna” CTE-bilden även neuropsykiatriska symtom som depressiva symtom, paranoia, social tillbakadragning och isolering, nedsatt omdöme och aggressivitet. Kognitiva brister som minnesförlust, exekutiv dysfunktion, språk- och informationsbehandlingsbrister uppkommer senare under sjukdomsförloppet (12).
Då definitionen av CTE i första hand beror på patologiska egenskaper finns det en föreslagen alternativ klinisk term traumatiskt encefalopati-syndrom (TES) av Montenigro et al. (13), som beskriver de kliniska följderna av upprepade TBE. Författarna baserade denna klassificering på en genomgång av 202 publicerade fall. TES är en mer omfattande diagnos och kan delas in i fyra underkategorier, däribland TES beteende-/stämningsvariant, TES kognitiv variant, TES blandad variant och TES demens. Den föreslagna TES-diagnosen baserades på förekomsten av fem allmänna kriterier, tre centrala kliniska kännetecken och nio stödjande kännetecken. Med hjälp av befintliga biomarkörer* (tabell 1) föreslogs ytterligare diagnostiska kvalificeringar som omfattade ”trolig”, ”möjlig” och ”osannolik” CTE (9, 13). Den föreslagna TES-diagnosen innehöll också tidsmässiga kvalifikationskategorier och omfattade ”progressivt förlopp”, ”stabilt förlopp” och ”okänt/inkonsistent förlopp”. Om den kliniska presentationen även innehöll motoriska tecken, såsom parkinsonism, lades modifieringen ”med motoriska drag” till.
I takt med att vår förståelse av CTE växer finns det ett antal utmaningar och kritiska synpunkter som måste tas upp. En hypotes som ett alternativ till fenomenet CTE, är en minskad ”kognitiv reserv”-teori. Enligt denna teori leder upprepade neurotrauma till en minskning av den kognitiva reserven och en snabbare utveckling av en underliggande neurodegenerativ sjukdom (20, 21). Om denna teori stämmer skulle den innebära att CTE och Alzheimers sjukdom befinner sig på samma neuropatologiska spektrum. Detta påstående förtjänar ytterligare analys. I likhet med AD består Tau-isoformerna i CTE också av en blandning av tre-repeat (3R)- och fyra-repeat (4R)-isoformer. Enligt en färsk rapport av Falcon et al. (22) innehåller de Tau-filament som extraherats från hjärnor från CTE-patienter också en unik ß-helixregion med en hydrofob kavitet, som inte finns i hjärnor från AD-patienter. Hålrummet innehåller ytterligare en kofaktor som tros spela en funktionell roll för tau-utbredningen. Falcon et al. (22) menar att placeringen av tau-inklusioner i närheten av blodkärl tyder på att kofaktorer som är nödvändiga för tau-sammansättning kan passera blod-hjärnbarriären efter huvudtrauma. Författarna hävdar vidare att det faktum att hjärntrauma leder till CTE endast i en undergrupp av den skadade befolkningen kan vara relaterat till högre nivåer av kofaktorer hos de mer mottagliga individerna. Dessa kofaktorer kan utgöra ett terapeutiskt mål för förebyggande av tau-sammansättning och utveckling av CTE efter skada (22).
En alternativ teori föreslår att de psykiatriska symtom som depression och ilska som rapporteras hos CTE-patienter är oberoende av CTE-sjukdomsprocessen och att de rapporteras på ett samlat sätt. Förespråkarna för denna hypotes har åberopat tidigare studier som den som rapporterades av Weir et al. (23), där 1 063 före detta NFL-spelare tillfrågades om de har upplevt anfall av ilska. Det rapporterades att 30,7 % av spelarna i åldern 30-49 år och 29,3 % av spelarna i åldern 50 år eller äldre rapporterade anfall av ilska. Författarna noterade dock också att de rapporterade måtten på ilska faktiskt var lägre än de som rapporterats för den allmänna amerikanska befolkningen, som var 54,8 % för män mellan 30 och 49 år och 47,2 % för män över 50 år (23). Även om argumenten om komorbiditet mellan psykiatriska symtom och neurodegenerativa sjukdomar som CTE är svåra att verifiera utifrån neuroimaging och neuropatologiska fynd, kan man tillämpa liknande argument på psykiatriska symtom i samband med alla neurodegenerativa tillstånd, t.ex. Alzheimers sjukdom, bvFTD, Parkinsons sjukdom (PD) eller amyotrofisk lateralskleros (ALS).
En annan viktig källa till diagnostisk förvirring är den kliniska avgränsningen mellan CTE och långvariga postkonkussiva syndrom (PCS), särskilt med tanke på tidigare rapporter som visar att ~10-20 % av personer som drabbas av hjärnskakningar upplever långvariga symtom. Med kroniskt postkonklusivt syndrom (CPCS) menas att PCS-symtomen kvarstår och leder till försämrade funktionella och ofta idrottsliga prestationer som varar längre än ett år. CPCS-symptomen omfattar huvudvärk, yrsel, nedsatt uppmärksamhet, minnes- och exekutiva funktionsnedsättningar, depression och irritationssymptom (10). King och Kirkwilliam myntade begreppet ”Permanent PCS” för att hänvisa till dem med PCS-symptom som kvarstår i genomsnitt 6,9 år efter den första hjärnskakningen. Vidare rapporterade de att ett betydande antal permanenta PCS-patienter (40-59 %) också hade premorbid eller postmorbid neuropsykiatriska tillstånd som depression, ångest, PTSD och/eller smärta (24). Enligt Jordan et al. (10) kan CPCS kliniskt särskiljas från CTE på grund av dess tidsmässiga förhållande till den akuta hjärnskakningshändelsen. En grundlig och korrekt tidshistoria är fortfarande avgörande för den neurologiska bedömningen. Huvudvärk är dessutom ett centralt kännetecken för CPCS men är inte vanligt förekommande vid CTE. Även om man kan argumentera för att McKee-stadium I och II-patienter kan ha huvudvärk, vilket ytterligare komplicerar den möjliga överlappningen mellan CTE & och CPCS (9). CPCS-diagnosen är fortfarande kontroversiell, eftersom det inte är klart om den är tauopatisk till sin natur. Därför är skiljelinjerna mellan CPCS och McKee’s stadium I och II kliniska egenskaper inte helt fastslagna.
Det har inte rapporterats några tydliga genetiska predispositioner för CTE. ApoE4-genen, den mest kända riskfaktorn för Alzheimers sjukdom (25), har dock förknippats med större kognitiva brister och en mer utdragen återhämtningsperiod efter traumatisk hjärnskada (TBI) (11). En studie på en grupp boxare har rapporterat allvarligare resultat hos personer som bär på minst en ApoE4-allel (26). Omvänt kan ApoE3 ge neuroprotektion, även i närvaro av en progressiv CTE-patologi (15). En annan föreslagen skyddsfaktor som är förknippad med en mer gynnsam återhämtning efter TBI är den kognitiva reserven, som mäts med premorbid IQ och total intrakraniell volym (27). Andra genetiska kandidater för ytterligare studier är bland annat genen för det mikrotubuliassocierade proteinet tau (MAPT), genen för progranulin (GRN) och genen för kromosom nio öppen läsram 72 (C9ORF72) (11).
Den patologiska synergieffekten av tauopati och neuroinflammation erkänns i allt högre grad. Extracellulär sekretion av hyperfosforylerat tau antas aktivera mikroglia och astrocyter, vilket leder till produktion av proinflammatoriska cytokiner som IL1ß och TNFa, vilket i sin tur leder till aktivering av tau-kinaser som p38 och cdk5 och ytterligare taufosforylering. Denna process skapar en ond cirkel av evig tauopati och neuroinflammation (28). Med tanke på det starka sambandet mellan upprepade traumatiska hjärnskador och risken för CTE (1) skulle en snabb behandling av TBI kunna minska utvecklingen av CTE. TBI:s proinflammatoriska karaktär har tidigare rapporterats (13), och antiinflammatoriska medel, t.ex. minocyklin med N-acetylcystein, en potent antioxidant, som administreras i akuta och subakuta tidsfönster efter TBI, erbjuder en lovande terapeutisk behandling (29, 30). Utvecklingen av ett tidskänsligt protokoll, som liknar behandlingsalgoritmen för ischemisk stroke, skulle potentiellt kunna mäta det långsiktiga resultatet av återhämtningen efter TBI och förebygga utvecklingen av efterföljande CTE-patologi (29).
Det finns för närvarande inga sjukdomsmodifierande läkemedel för CTE, vilket gör förebyggande åtgärder till det effektivaste sättet att bekämpa denna försvagande neurodegenerativa sjukdom (31). Med tanke på frekvensen av huvudkollisioner i kontaktsporter som amerikansk fotboll kommer förebyggande av huvudtrauma att kräva en kulturell förändring av hur sporten lärs ut och utövas. Träning i säkra träningstekniker, t.ex. säkra tacklingar och slag, samtidigt som hänsynslösa slag bestraffas kommer att ge mätbara fördelar. Ytterligare förändringar måste omfatta skapandet av en miljö som präglas av säkerhet, där spelarna uppmuntras att rapportera symtom till domare, tränare och lagläkare. Dessutom skulle en grundläggande neurokognitiv profil kunna användas som en klinisk referensmarkör för att spåra förändringar i spelarnas neuropsykiatriska presentation. Det åligger lagläkarna att ta bort spelare från planen som har drabbats av även en lindrig okomplicerad TBI för ytterligare bedömning (32).
Det finns ett antal existerande CTE-relaterade utmaningar att ta itu med. Även om förekomsten av idrottsrelaterade hjärnskakningar har rapporterats ligga mellan 1,6 miljoner och 3,8 miljoner, är förekomsten och prevalensen av CTE fortfarande till stor del okänd (33). En förklaring till denna bristande kunskap kan bero på att idrottare som utsätts för kumulativa subkonkussiva träffar, som har tillräcklig kraft för att ge neuronala skador men som till en början inte har några uppenbara kliniska symtom, ofta inte bedöms eller diagnostiseras i rätt tid (34). Storskaliga prospektiva studier, t.ex. genom att följa idrottare med flera TBI under en förutbestämd period, skulle bidra till vår förståelse av sjukdomens naturliga förlopp och fenomenologi. CTE hamnar alltmer i allmänhetens fokus via massmedia. Det behövs fortsatta insatser för att diagnostisera, bedöma och behandla denna förödande sjukdom. De exponentiella framstegen inom neuroavbildningsteknik och förståelsen av sjukdomens neuropatologiska mekanismer kommer att leda till tidigare diagnos och behandlingsinsatser i rätt tid.
Författarens bidrag
Författaren bekräftar att han eller hon är den enda bidragsgivaren till detta arbete och har godkänt det för publicering.
Intressekonfliktförklaring
Författaren förklarar att forskningen utfördes i avsaknad av kommersiella eller ekonomiska relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Acknowledgments
Författaren erkänner Dr. Stephen Strittmatter för hans stora stöd, vägledning och mentorskap.
1. McKee AC, Cantu RC, Nowinski CJ, Hedley-Whyte ET, Gavett BE, Budson AE, et al. Chronic traumatic encephalopathy in athletes: progressive tauopathy after repetitive head injury. J Neuropathol Exp Neurol. (2009) 68:709-35. doi: 10.1097/NEN.0b013e3181a9d503
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Goldstein LE, Fisher AM, Tagge CA, Zhang XL, Velisek L, Sullivan JA, et al. Chronic traumatic encephalopathy in blast-exposed military veterans and a blast neurotrauma mouse model. Sci Transl Med. (2012) 4:134ra60. doi: 10.1126/scitranslmed.3003716
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Martland H. Dementia pugilistica. JAMA. (1928) 91:364-65. doi: 10.1001/jama.1928.02700150029009
CrossRef Full Text | Google Scholar
4. Millspaugh J. Dementia pugilistica. US Naval Med Bull. (1937) 35:303.
Google Scholar
5. Critchley M. Hommage a Clovis Vincent. Paris: Maloine (1949).
Google Scholar
6. Mez J, Daneshvar DH, Kiernan PT, Abdolmohammadi B, Alvarez VE, Huber BR, et al. Klinisk-patologisk utvärdering av kronisk traumatisk encefalopati hos spelare i amerikansk fotboll. JAMA. (2017) 318:360-70. doi: 10.1001/jama.2017.8334
PubMed Abstract | CrossRef Full Text | Google Scholar
7. McKee AC, Stein TD, Kiernan PT, Alvarez VE. Neuropatologi vid kronisk traumatisk encefalopati. Brain Pathol. (2015) 25:350-64. doi: 10.1111/bpa.12248
PubMed Abstract | CrossRef Full Text | Google Scholar
8. McKee AC, Cairns NJ, Dickson DW, Folkerth RD, Keene CD, Litvan I, et al. The first NINDS/NIBIB konsensus meeting to define neuropathological criteria for the diagnosis of chronic traumatic encephalopathy. Acta Neuropathol. (2016) 131:75-86. doi: 10.1007/s00401-015-1515-z
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McKee AC, Stern RA, Nowinski CJ, Stein TD, Alvarez VE, Daneshvar DH, et al. Sjukdomsspektrumet vid kronisk traumatisk encefalopati. Brain. (2013) 136:43-64. doi: 10.1093/brain/aws307
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Jordan BD. Det kliniska spektrumet av idrottsrelaterad traumatisk hjärnskada. Nat Rev Neurol. (2013) 9:222-30. doi: 10.1038/nrneurol.2013.33
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Stern RA, Daneshvar DH, Baugh CM, Seichepine DR, Montenigro PH, Riley DO, et al. Klinisk presentation av kronisk traumatisk encefalopati. Neurologi. (2013) 81:1122-9. doi: 10.1212/WNL.0b013e3182a55f7f
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Gardner A, Iverson GL, McCrory P. Chronic traumatic encephalopathy in sport: a systematic review. Br J Sports Med. (2014) 48:84-90. doi: 10.1136/bjsports-2013-092646
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Montenigro PH, Baugh CM, Daneshvar DH, Mez J, Budson AE, Au R, et al. Kliniska subtyper av kronisk traumatisk encefalopati: litteraturgenomgång och föreslagna forskningsdiagnostiska kriterier för traumatiskt encefalopatisyndrom. Alzheim Res Ther. (2014) 6:68. doi: 10.1186/s13195-014-0068-z
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Mawdsley C, Ferguson F. Neurologiska sjukdomar hos boxare. Lancet. (1963) 282:795-801. doi: 10.1016/S0140-6736(63)90498-7
CrossRef Full Text | Google Scholar
15. Omalu BI, DeKosky ST, Minster RL, Kamboh MI, Hamilton RL, Wecht CH. Kronisk traumatisk encefalopati hos en spelare i National Football League. Neurosurgery. (2005) 57:128-34. doi: 10.1227/01.NEU.0000163407.92769.ED
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Rascovsky K, Hodges JR, Knopman D, Mendez MF, Kramer JH, Neuhaus J, et al. Sensitivitet för reviderade diagnostiska kriterier för beteendevarianten av frontotemporal demens. Brain. (2011) 134:2456-77. doi: 10.1093/brain/awr179
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Omalu BI, Bailes J, Hammers JL, Fitzsimmons RP. Kronisk traumatisk encefalopati, självmord och parasuicid hos professionella amerikanska idrottare: den rättsmedicinska patologens roll. Am J Forensic Med Pathol. (2010) 31:130-2. doi: 10.1097/PAF.0b013e3181ca7f35
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Maroon JC, Winkelman R, Bost J, Amos A, Mathyssek C, Miele V. Kronisk traumatisk encefalopati i kontaktsporter: en systematisk genomgång av alla rapporterade patologiska fall. PLoS ONE. (2015) 10:e0117338. doi: 10.1371/journal.pone.0117338
CrossRef Full Text | Google Scholar
19. Iverson GL. Kronisk traumatisk encefalopati och risk för självmord hos före detta idrottsmän. Br J Sports Med. (2014) 48:162-4. doi: 10.1136/bjsports-2013-092935
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Iverson GL, Gardner AJ, McCrory P, Zafonte R, Castellani RJ. Iverson En kritisk granskning av kronisk traumatisk encefalopati. Neurosci Biobehav Rev. (2015) 56:276-93. doi: 10.1016/j.neubiorev.2015.05.008
CrossRef Full Text | Google Scholar
21. Randolph C. Kronisk traumatisk encefalopati är inte en riktig sjukdom. Arch Clin Neuropsychol. (2018) 33:644-8. doi: 10.1093/arclin/acy063
CrossRef Full Text | Google Scholar
22. Falcon B, Zivanov J, Zhang W, Murzin AG, Garringer HJ, Vidal R, et al. Novel tau filament fold in chronic traumatic encephalopathy encloses hydrophobic molecules. Nature. (2019) 568:420-3. doi: 10.1038/s41586-019-1026-5
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Weir DR, Jackson JS, Sonnega A, et al. National Football League Player Care Foundation Study of Retired NFL Players. Ann Arbor: University of Michigan Institute for Social Research (2009).
Google Scholar
24. King NS, Kirwilliam S. Permanenta symptom efter hjärnskakning efter mild huvudskada. Brain Inj. (2011) 25:462-70. doi: 10.3109/02699052.2011.558042
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Ward A, Crean S, Mercaldi CJ, Collins JM, Boyd D, Cook MN, et al. Prevalens av apolipoprotein E4-genotyp och homozygoter (APOE e4/4) bland patienter som diagnostiserats med Alzheimers sjukdom: en systematisk genomgång och metaanalys. Neuroepidemiologi. (2012) 38:1-17. doi: 10.1159/000334607
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Jordan BD, Relkin NR, Ravdin LD, Jacobs AR, Bennett A, Gandy S. Apolipoprotein Eε4 associerat med kronisk traumatisk hjärnskada vid boxning. (1997) 278:136-40. doi: 10.1001/jama.278.2.136
CrossRef Full Text | Google Scholar
27. Stern Y. Kognitiv reserv vid åldrande och Alzheimers sjukdom. Lancet Neurol. (2012) 11:1006-12. doi: 10.1016/S1474-4422(12)70191-6
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Laurent CL, Buée L, Blum D. Tau och neuroinflammation: Vilka konsekvenser för Alzheimers sjukdom och Tauopatier? Biomed J. (2018) 41:21-33. doi: 10.1016/j.bj.2018.01.003
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Sangobowale MA, Grin’kina NM, Whitney K, Nikulina E, St, Laurent-Ariot K, Ho JS, et al. Minocyklin plus N-acetylcystein minskar beteendemässiga brister och förbättrar histologi med ett kliniskt användbart tidsfönster. J Neurotrauma. (2018) 35:907-17. doi: 10.1089/neu.2017.5348
CrossRef Full Text | Google Scholar
30. Haber M, James J, Kim J, Sangobowale M, Irizarry R, Ho J, et al. Minocyklin plus N-acteylcystein inducerar remyelinisering, skyddar oligodendrocyter synergistiskt och modifierar neuroinflammation i en råttmodell av mild traumatisk hjärnskada. J Cereb Blood Flow Metab. (2018) 38:1312-6. doi: 10.1177/0271678X17718106
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Livingston G, Sommerlad A, Orgeta V, Costafreda SG, Huntley J, Ames D, et al. Dementia prevention, intervention and care. Lancet. (2017) 390: 2673-734. doi: 10.1016/S0140-6736(17)31363-6
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Saulle M, Greenwald BD. Kronisk traumatisk encefalopati: en översikt. Rehabil Res Pract. (2012). 2012: 816069. doi: 10.1155/2012/816069
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Langlois JA, Rutland-Brown W, Wald MM. Epidemiologi och konsekvenser av traumatisk hjärnskada. J Head Trauma Rehabil. (2006) 21:375-8. doi: 10.1097/00001199-200609000-00001
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Martini D, Eckner J, Kutcher J, Broglio SP. Biomekanik vid subkoncusiv huvudpåverkan: jämförelse av olika offensiva system. Med Sci Sports Exerc. (2013) 45:755-61. doi: 10.1249/MSS.0b013e3182798758
PubMed Abstract | CrossRef Full Text | Google Scholar