Introduktion
Meningiom är den vanligaste primära tumören i det centrala nervsystemet (CNS) och står för över 37 % av alla primära hjärntumörer (1). Behandlingsalternativ för meningiom är observation, kirurgi och strålbehandling (2, 3). Även om en minoritet av meningiomen är aggressiva, inklusive Världshälsoorganisationens (WHO) grader II och III, är över 80 % av dem av WHO-grad I och kallas ofta ”godartade” (4). Även meningiom av WHO-grad I kan dock återkomma, och tidigare studier har visat på en återfallsfrekvens på upp till 47 % vid långtidsuppföljning (4, 5). Meningeomrecidiv kräver ofta behandling med ytterligare kirurgi eller räddande strålbehandling, vilket leder till potentiell morbiditet (6, 7). Följaktligen är förmågan att förutsäga recidiv en avgörande komponent i hanteringen av meningiom av WHO-grad I för att kunna ge rekommendationer om frekvensen av övervakningsbilder eller användningen av adjuvant strålbehandling.
Förutom den Simpson-grad som uppnåddes vid resektion har ett antal tumöregenskaper utvärderats som möjliga prediktorer för recidiv, med fokus på histopatologiska fynd (8). Dessa inkluderar MIB-1-index (en markör för cellproliferation), hjärninvasion och förekomst av atypiska histologiska egenskaper, inklusive ökad celluläritet, skiktning, foci av spontan nekros och kärnatypi (9-13). I WHO:s klassificeringar från 2016 används faktiskt uteslutande patologiska fynd för att bestämma tumörgrad med grad II definierad av hjärninvasion och ökad mitos över 4/10 high powered field (HPF) (4). Dessutom resulterar tre atypiska egenskaper tillsammans i en ökad tumörgrad (4). Framåtblickande har meningiomets molekylära egenskaper nyligen associerats med risken för återfall och kommer troligen att användas vid meningiomklassificering i framtiden (14-16).
Men medan WHO-klassificeringarna syntetiserar den tillgängliga litteraturen för att skapa tydliga avgränsningar mellan tumörgrader, är litteraturen kring WHO-gradig meningiomåterfall av grad I fortfarande blandad. Till exempel kan hjärninvasion ensam leda till en ökning av tumörgraden från WHO-grad I-II, men ett antal efterföljande studier har inte funnit något samband mellan hjärninvasion och recidiv, vilket understryker behovet av ytterligare forskning om prediktorer för recidiv (10, 17, 18). Nyttan av MIB-1-indexet för att förutsäga meningiomrecidiv är också kontroversiell; en studie på meningiom av WHO-grad I antydde endast en högre recidivrisk vid ett MIB-1-index på >3 %, men i annan litteratur som omfattar alla WHO-grader har man påvisat en högre incidens av recidiv vid >5 % eller >10 % (9-11). Tidigare studier har också föreslagit ett MIB-1 cutoff på >3 % endast hos patienter med Simpson II- eller III-resektion, vilket ytterligare visar på variationen i MIB-1 cutoffs och deras användning (13). I jämförelse har ett begränsat antal studier undersökt effekten av atypiska egenskaper vid recidiv av WHO-grad I meningiom; även om de har föreslagit en högre risk för recidiv i WHO-grad I-tumörer som uppvisar atypiska egenskaper vid patologisk analys (9).
Det var därför målet med den här studien att undersöka kliniska, radiografiska och patologiska prediktorer för recidiv i WHO-grad I meningiom. Med tanke på bristen på konsensus om användningen av MIB-1 vid meningiom av WHO-grad I använder vi också rekursiv partitionsanalys för att identifiera ett kliniskt relevant gränsvärde för MIB-1-indexet. Vi identifierar sedan prediktorer för tidig och postmediär recidiv i WHO grad I tumörer.
Metoder
Patientpopulation
Patienter som genomgick behandling för ett WHO grad I meningiom från 2007 till 2017 identifierades retrospektivt med hjälp av en institutionell databas. Den här studien godkändes formellt av University of California, San Francisco Institutional Review Board (IRB#13-12587). Patienter utan MIB-1-indexvärden som fanns tillgängliga i den elektroniska patientjournalen exkluderades. I början av studieperioden erhölls MIB-1 efter den behandlande neuropatologens gottfinnande, men med tiden erhölls MIB-1 på alla WHO-grad I meningiom-patienter.
Kliniska data
Patienternas demografiska, kliniska och behandlingsmässiga egenskaper, histopatologiska data och kliniska resultat granskades och samlades in retrospektivt. Kliniska data som samlades in inkluderade patientens ålder, kön, Karnofsky Performance Status (KPS) vid behandling, klinisk presentation och tidigare historia av meningiombehandling. Histopatologiska data omfattade MIB-1-index, skiktning/förlust av arkitektur, ökad celluläritet, nekros, nukleär atypi och förekomst av beninvasion. Progesteronreceptor (PR), Epithelial Membrane Antigen (EMA), CD34, S100, glial fibrillary, and acidic protein (GFAP) färgningsresultat samlades in när de fanns tillgängliga. Patologiska data hämtades från den patologirapport som genererades vid tidpunkten för det kirurgiska ingreppet. Tumörens läge, storlek och förekomsten av preoperativt peritumoralt ödem fastställdes med hjälp av preoperativ MRT-avbildning. Anterior-posterior (AP), superior-inferior (SI) och tvärgående (TV) diametrar samlades in. Den preoperativa tumörvolymen beräknades med hjälp av ekvationen för icke-sfärisk tumörvolym. Behandlingstyp samlades in på samma sätt. Simpsons grad fastställdes med hjälp av operationsrapporten. Bruttototal (GTR) och subtotal resektion (STR) bestämdes med hjälp av postoperativa magnetresonansbilder (MRI).
De primära resultaten av intresse var tumörrecidiv och tid till recidiv. Återfall fastställdes på postoperativ röntgenbild som ett lokalt återfall eller progression av kvarvarande tumör. Tid till återfall bestämdes från patientens behandlingsdatum. Längden på uppföljningen beräknades från behandlingsdatum till det sista besöket på neurokirurgiska kliniken. Sekundära utfall omfattade tidig och postmedialt återfall. Tidigt återfall definierades som inom 2 år efter den första behandlingen (19). Postmedialt återfall definierades som att det inträffade >2 år efter den första behandlingen.
Statistisk analys
Chi-square och Students t-test användes för jämförelse av kategoriska respektive kontinuerliga variabler. En multivariat backward likelihood Cox-regressionsmodell för återfall konstruerades med hjälp av variabler med p < 0,200 vid univariat analys. På samma sätt konstruerades multivariata binära logistiska modeller med bakåtriktad sannolikhet för att förutsäga tidig och postmediär recidiv med hjälp av variabler med p < 0,200 i den univariata analysen. Recursive partitioning analysis (RPA) användes för att ytterligare identifiera viktiga riskfaktorer för övergripande, tidig och postmediär meningiomrecidiv. Ett p < 0,050 användes som tröskel för statistisk signifikans. Alla statistiska analyser utfördes med SPSS 26.
Resultat
Allmänna patientdemografiska uppgifter och kliniska resultat
Allmänna patientdemografiska uppgifter, histopatologiska egenskaper och kliniska resultat kan ses i tabell 1. Totalt ingick 239 patienter med meningiom av WHO-grad I i studien. Medelåldern var 60,0 år och 69,5 % av patienterna var kvinnor. Det vanligaste förekommande symtomet var huvudvärk (30,5 %), följt av ett fokalt neurologiskt underskott (27,6 %). Majoriteten av patienterna genomgick enbart kirurgi (98,3 %), och två patienter fick vardera adjuvant strålbehandling (0,8 %) eller behandling med gammakniv (0,8 %). Peritumoralt ödem fanns på de preoperativa MRT-bilderna hos 38,1 % av patienterna. Den genomsnittliga beräknade tumörvolymen var 30,6 cm3 (intervall = 0,23-215,73 cm3) och den genomsnittliga största tumördimensionen var 3,8 cm (intervall = 0,6-11,3 cm). Totalt sett var 91 (38,1 %) tumörer lokaliserade på skallbasen, 57 (23,8 %) var konvexitetstumörer, 43 (18,0 %) hade ett falx/parasagittalt läge och 55 (23,0 %) hade ett annat läge. De flesta patienterna fick en bruttototal resektion (63,6 %). Förekomsten av Simpson I-, II-, III- och IV-resektion var 31,4, 29,7, 2,5 respektive 35,6 %. Atypiska egenskaper fanns hos ett antal patienter; de vanligaste atypiska egenskaperna var beninvasion (18,0 %) och skiktning/förlust av arkitektur (8,4 %). Den genomsnittliga uppföljningen var 41,1 månader (intervall: 0-147 månader).
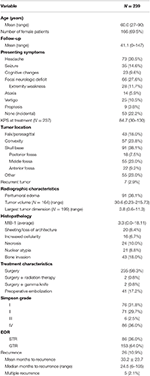
Tabell 1. Patientkarakteristika, histopatologiska egenskaper, radiografi och resultat.
Prediktorer för recidiv av WHO grad I meningeom
Totalt 26 patienter recidiverade med en mediantid till recidiv på 24,5 månader (tabell 1). En jämförelse mellan patienter med recidiv och patienter utan recidiv finns i tabell 2. Det fanns ingen skillnad i ålder (60,2 vs 58,8, p = 0,582) eller kvinnligt kön (61,5 vs 70,4 %, p = 0,353) mellan patienter med tumörer som recidiverade och patienter utan recidiv. Behandlingsegenskaperna var likartade mellan grupperna och de flesta patienterna i varje grupp fick enbart kirurgi (100,0 vs 98,1 %, p = 1,000). Patienter med återkommande tumörer hade dock en högre incidens av STR (61,5 vs. 32,7 %, p = 0,004) och en lägre incidens av Simpson grade I-resektion (11,5 vs. 34,1 %, p = 0,019). Förekomsten av peritumoralt ödem, tumörstorlek och tumörvolym var likartad mellan grupperna. Vid histopatologisk analys uppvisade patienter med recidiv en tendens till ökad nukleär atypi (19,2 vs. 7,5 %, p = 0,061). Patienter med recidiv hade också en längre genomsnittlig uppföljningstid (68,9 vs 37,7 månader, p = 0,001).
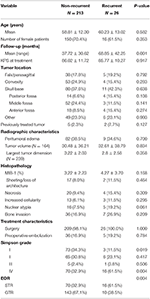
Tabell 2. Jämförelse av patienter med recidiverande meningiom jämfört med icke-recidiverande meningiom.
En efterföljande backward likelihood cox-regressionsanalys belyste ett oberoende samband mellan recidiv och tumörplacering i posterior fossa (HR = 5.25, CI 1,71-16,17, p = 0,004), MIB-1-index (HR = 1,18, CI 1,05-1,34, p = 0,008), nukleär atypi (HR = 5,24, CI 1,73-15,92, p = 0,003) och STR (HR = 5,66, CI 1,30-13,92, p < 0,001; tabell 3). Kaplan-Meier-kurvor som belyser recidivfri överlevnad för lokalisering i posterior fossa (p = 0,007), kärnatypi (p = 0,137), resektionens omfattning (p = 0,001) och MIB-1 >4,5 % (p = 0,001) visas i figurerna 1A-D.
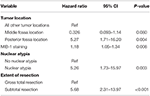
Tabell 3. Cox regressionsanalys för återfall.

Figur 1. Kaplan Meier-kurvor för riskfaktorer för recidiv av WHO grad I meningiom. (A) Kärnatypi (blå linje) jämfört med ingen kärnatypi (röd linje) (X2 = 2,21, p = 0,137). (B) Tumörplacering i posteriorfossa (blå linje) jämfört med andra platser (röd linje) (X2 = 10,36, p = 0,001). (C) MIB-1-index >4,5 % (blå linje) jämfört med ≤4,5 % (röd linje) (X2 = 6,17, p = 0,013). (D) STR (blå linje) jämfört med GTR (röd linje) (X2 = 10,46, p = 0,001).
Prediktorer för tidig vs. postmediantisk recidiv av WHO-grad I meningeom
En jämförelse mellan icke-recidiverande patienter och patienter med tumörer som recidiverade tidigt eller postmediantisk presenteras i tabell 4. Patienter med tidig recidiv hade en högre incidens av subtotal resektion (76,9 vs 32,7 %, p = 0,001). De tenderade också till en högre incidens av nukleär atypi (23,1 vs. 7,5 %, p = 0,084) på histopatologi (tabell 4). Patienter med ett recidiv efter medelvärdet tenderade mot en ökad incidens av tumörlokalisering i bakre fossa (23,1 vs. 6,6 %, p = 0,063) och en högre incidens av beninvasion (38,5 vs. 16,9 %, p = 0,064) samt ett högre MIB-1-index (5,55 vs. 3,22 %, p = 0,098). Det fanns ingen signifikant skillnad mellan Simpsons gradering eller GTR-frekvens hos patienter med postmedialt recidiv jämfört med icke-recidiverande patienter (tabell 4).
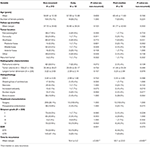
Tabell 4. Tidig kontra postmedianrecidiv.
Två multivariata binära logistiska modeller med bakåtriktad sannolikhet användes för att identifiera prediktorer för tidig kontra postmedianrecidiv (tabell 5). Oberoende prediktorer för tidig tumörrecidiv inkluderade nukleär atypi på histopatologi (OR = 6,45, CI 1,34-31,07, p = 0,020) och STR (OR = 8,92, CI 2,18-36,46, p = 0,002). Den enda oberoende prediktoren för återfall efter medelvärdet var MIB-1-index (OR = 1,24, CI 1,05-1,45, p = 0,010), även om lokalisering i posterior fossa närmade sig signifikans (OR = 4,42, CI 0,954-20,49, p = 0,058; tabell 5).

Tabell 5. Binär logistisk modell för återfall efter medelvärdet och tidigt tumöråterfall.
Recursive Partitioning Analysis of Recurrence
RPA utfördes för att identifiera viktiga riskfaktorer för återfall av meningiom (figur 2). I överensstämmelse med cox-regressionsanalysen var STR den första partitionen när det gällde att förutsäga övergripande återfall: 18,6 % av patienterna med en STR-resektion recidiverade jämfört med 6,5 % med en GTR. Nästa beslutsnod inom endast GTR-patienter involverade en MIB-1 cutoff på 4,5 %, eftersom 18,8 % av patienterna med en MIB-1 >4,5 % recidiverade jämfört med 3,3 % av patienterna med en MIB-1 ≤4,5 % (figur 2A). När det gäller specifikt recidiv efter medelvärdet identifierade RPA den första beslutsnoden som en MIB-1 cutoff på 5,83 %: 22,2 % av patienterna med MIB-1 >5,83 % recidiverade jämfört med 3,3 % av patienterna med MIB-1 ≤5,83 %. Den efterföljande beslutsnoden använde sig av en tumörlokalisering i posterior fossa: 13,3 % av patienterna med en tumör i bakre fossa återkom jämfört med 2,5 % av andra tumörplatser (figur 2B). RPA för tidigt återfall identifierade resektionens omfattning som den primära beslutsnoden: 11,6 % av patienterna med STR återkom jämfört med 2,0 % av GTR-patienterna. Följande beslutsnod använde falx eller parasagittal placering: 36,4 % av falx- eller parasagittala tumörer återkom jämfört med 8,1 % av andra tumörplatser (figur 2C).
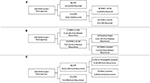
Figur 2. Rekursiv partitioneringsanalys som belyser de viktigaste riskfaktorerna för (A) totalt återfall, (B) återfall efter medelvärdet och (C) tidigt återfall.
Diskussion
Nyckelresultat
WHO grade I meningiomåterfall är oberoende förknippat med MIB-1-index, tumörplacering i posteriora fossa, förekomst av nukleär atypi och STR. Mer specifikt identifierades ett MIB-1-index på 4,5 % som ett kliniskt relevant gränsvärde för riskstratifiering av WHO grad I meningiom-patienter efter GTR. Patienter med ett >4,5 % MIB-1-index och GTR av deras meningiom av WHO-grad I hade en liknande risk för återfall som de patienter som hade STR. Ytterligare analyser lyfte fram MIB-1 som en kritisk faktor som var förknippad med recidiv efter medeltid, medan resektionens omfattning var den viktigaste drivkraften för tidig recidiv.
Prediktorer för recidiv av meningiom av WHO-grad I
I tidigare studier har man på liknande sätt bedömt sambandet mellan histopatologiska särdrag, kliniska egenskaper och recidiv i alla WHO-grader av meningiom. I en studie av 901 patienter (716 av WHO-grad I, 174 av grad II och 11 av grad III) har Gousias et al. visar en högre risk för återfall i meningiom med ett MIB-1-index på >10 %, högre WHO-grad, tumörstorlek >6 cm, petroklivalt läge eller läge i sinus cavernosus samt multiplicitet (11). Gousias et al. bedömde dock inte sambandet mellan förekomsten av atypiska drag på histologin och tumörrecidiv. När det gäller WHO-grad I meningiom specifikt använde Marciscano et al. en kohort av 148 WHO-grad I meningiom-patienter med fullständig patologisk analys för att identifiera variabler som är förknippade med återfall, med fokus på effekten av atypiska patologiska särdrag på återfallsrisken (9). Intressant nog identifierar de närvaron av atypiska särdrag som en oberoende riskfaktor utöver MIB-1-index >3 % och Simpson-resektion. Vår studie lyfter på liknande sätt fram kirurgisk GTR och nukleär atypi, ett atypiskt särdrag, som oberoende prediktorer för recidiv (tabell 3), även om vi bedömde varje atypiskt särdrag oberoende av varandra. Vi tar också hänsyn till tumörens läge i vår cox-regressionsmodell, vilket ytterligare identifierar tumörens läge i posterior fossa som en oberoende riskfaktor för recidiv. Marciscano et al. inkluderade inte tumörlokalisering i sin analys av prediktorer för progression, men Gousias et al. visar på liknande sätt att petroklival tumörlokalisering är en riskfaktor för recidiv, om än när man beaktar alla WHO:s meningiomklasser (9, 11). Den högre risken för återfall som är förknippad med lokalisering i den bakre fossa kan bero på den ökade prevalensen av NF2-mutationer i den bakre fossa (14, 15, 20), även om vi inte kan utforska detta fullt ut eftersom vi inte rutinmässigt utför genetisk testning av meningiom vid vår institution. Oavsett detta behövs ytterligare studier med större WHO grade I meningiom patientkohorter för att undersöka detta samband.
MIB-1-index och WHO grade I meningiomrecidiv
I likhet med tidigare studier (9, 11, 13, 21) utvärderade vi sedan också sambandet mellan tumörens MIB-1-index och dess risk för recidiv. Vi utvärderade först MIB-1-index i en cox-regressionsmodell för övergripande återfall, som tidigare diskuterats. I överensstämmelse med tidigare studier fann vi att högre MIB-1-index var oberoende förknippat med en övergripande ökad risk för återfall. Med tanke på diskrepanserna i cutoff-värden för MIB-1 mellan litteraturen och variationen mellan laboratorier utvärderade vi inledningsvis MIB-1 som en kontinuerlig variabel. Därefter försökte vi fastställa gränsvärdet för MIB-1-index i vår patientpopulation genom att använda RPA för att modellera det totala återfallet, vilket identifierade ett gränsvärde för MIB-1 på 4,5 % hos patienter med GTR (figur 2A). Intressant nog hade dessa patienter en liknande risk för återfall som patienter med STR, vilket visar på användbarheten av MIB-1 hos patienter efter GTR. Perry et al. identifierar på liknande sätt ett MIB-1-index på 4,2 % som förknippat med återfall efter GTR vid univariat analys, dock när man beaktar alla meningiomgrader (22).
Recidivfrekvensen på 18,8 % hos patienter med en GTR och MIB-1 >4,5 % belyser behovet av noggrann övervakning av dessa patienter eller till och med övervägandet av adjuvant strålbehandling, beroende på patientens preferens. Adjuvant strålbehandling efter resektion för meningiom av WHO-grad I har visat sig minska återfall, särskilt efter STR (23-25), även om observation efter STR fortfarande är standardpraxis (8). I en studie av 92 meningiom av WHO-grad I visade Soyuer et al. att den progressionsfria överlevnaden (PFS) var 91 % hos patienter som fick adjuvant strålbehandling efter STR, vilket var betydligt högre än PFS på 38 % hos de patienter som inte hade fått adjuvant strålbehandling (24). Eftersom patienter i vår studie med STR hade en liknande risk för återfall som de med GTR och MIB-1 >4,5 % kan adjuvant strålbehandling för båda grupperna vara rimlig. Det behövs dock större studier för att ytterligare validera vår MIB-1 cutoff och de tillhörande kliniska konsekvenserna. Det behövs också prospektiva studier som undersöker användningen av adjuvant strålbehandling vid meningiom av WHO-grad I.
Prediktorer för tidig och postmedicinsk recidiv av meningiom av WHO-grad I
Med tanke på trenden mot en senare recidiv hos patienter med en förhöjd MIB >4.5 % (figur 1C), försökte vi sedan undersöka skillnader i prediktorer mellan patienter som återkom tidigt (definierat som inom 2 år efter behandling) eller postmedialt (de som återkom >2 år efter behandling). Få studier i litteraturen har undersökt prediktorer för tidigt återfall i meningiom. I en studie av Budohoski et al. identifieras parafalcin lokalisering, STR och peritumoralt ödem på röntgenbilder som prediktorer för tidig recidiv i en kohort av 220 atypiska meningiom (26). I en liknande studie av Maillo et al. i meningiom av WHO-grad I används interfasfluorescens in situ-hybridisering (FISH) och patologiska egenskaper för att identifiera riskfaktorer för tidig recidiv (definierat som 2,5 år efter behandling) och fann att större tumörstorlek, karyotypavvikelser, patientens ålder och avvikelser på kromosom 10 var förknippade med en ökad risk för recidiv (19). Författarna tog dock inte hänsyn till förekomsten av atypier på patologi eller MIB-1-index. Med hjälp av en kohort av WHO-grad I meningiom-patienter med mer granulära patologiska och kliniska data identifierade vi resektionens omfattning och nukleär atypi på patologi som oberoende prediktorer för tidig recidiv vid binär logistisk regressionsmodellering (tabell 5). RPA avslöjade på samma sätt betydelsen av resektionens omfattning för riskstratifiering av patienter för tidig recidiv (figur 2C). Intressant nog framhävdes också den ökade risken i samband med falx/parasagittal tumörplacering, vilket stämmer överens med resultaten från Budohoski et al. (26). Den enda signifikanta prediktoren för tumörrecidiv efter medeltid vid binär logistisk regressionsmodellering var MIB-1-index, även om tumörens placering i posteriora fossa närmade sig signifikans. Detta visades ytterligare på RPA (figur 2B). Överraskande nog var inte resektionens omfattning en oberoende prediktor för återfall efter medianen, eftersom majoriteten av återfallen efter medianen hade genomgått en GTR. Recidiv efter medianen kan belysa en kategori av meningiom av WHO-grad I som är molekylärt mer aggressiv och som återkommer trots GTR, med tanke på deras förhöjda MIB-1-index och placering i den nedre delen av fossa . Tidiga återfall påverkas betydligt mer av resektionens omfattning och representerar därför troligen fortsatt tillväxt av kvarvarande tumör i motsats till återfall av tidigare helt resekterad tumör, som man ser i återfall efter medelvärdet. Våra resultat representerar således potentiellt två olika molekylära WHO-grad I meningiom-subtyper. Framtida studier med större patientkohorter och molekylära tumördata behövs dock för att ytterligare undersöka de underliggande skillnaderna i molekylära förändringar mellan tidiga och postmediala recidiv.
Begränsningar
Begränsningarna i vår studie inkluderar dess retrospektiva karaktär och låga incidens av recidiv. Vår studie omfattar också patienter som började 2007 och sträcker sig därför över både 2007 och 2016 års WHO CNS klassificeringssystem. Den enda betydande förändringen mellan de två klassificeringarna var dock tillägget av hjärninvasion som ett ensamt kriterium för WHO-grad II-status. Endast två av de patienter som ingick i vår kohort hade en hjärninvasion noterad vid patologisk analys, och ingen av patienterna återkom. Vi tror därför inte att inkluderandet av patienter som klassificerats enligt 2007 års klassificeringsschema hade någon betydande inverkan på våra resultat. Dessutom bygger vår studie på de patologiska rapporterna efter den första resektionen, utan en central omprövning av de patologiska bilderna. Detta kan leda till ökad variabilitet i de patologiska variablerna, t.ex. nukleär atypi och andra liknande patologiska fynd som kan uppvisa interobservatörsvariabilitet (27, 28). MIB-1 är dock ett relativt objektivt mått med lägre interobservatörsvariabilitet mellan patologer som använder samma metod inom ett patologilaboratorium (29). Praxismönstren när det gäller MIB-1-testning förändrades också under studiens tidsperiod från enskilda patologers preferenser, som varierade beroende på patologen, till testning hos alla patienter. Faktorer som patologerna tog hänsyn till när de beslutade om MIB-1-testning inkluderade de atypiska egenskaper som ingick i vår studie, vilket minimerade deras potentiella inverkan på våra resultat. Dessutom är alla meningiom som ingår i vår studie WHO-grad I. Som ett resultat av detta anser vi att eventuell bias som införts i studien på grund av dessa förändringar i praxismönster är minimal. Slutligen, även om vi inkluderar detaljerade kliniska och patologiska egenskaper saknar vår patientkohort information om tumörgenetiska och molekylära förändringar, som har visat sig ha en betydande inverkan på tumörutfallet (15, 30-32). Således kvarstår ett behov av ytterligare stora multi-institutionella studier med molekylära/genetiska data utöver traditionella patologiska och kliniska variabler när det gäller att förutsäga övergripande recidiv av WHO grad I meningiom. Detta inbegriper beaktande av molekylära/genetiska prognosmakare, t.ex. metyleringsmönster över hela arvsmassan (33, 34), mutationer i TERT-promotorn (35) och ytterligare molekylära tumördata. Med tanke på våra resultat är framtida undersökningar av unika genetiska/molekylära, kliniska och patologiska prediktorer för tidiga och senare recidiv också motiverade, med tanke på den potentiella inverkan på läkares terapeutiska beslutsfattande.
Nåväl ger vår studie en detaljerad inblick i kliniska och histopatologiska prediktorer för recidiv, särskilt i WHO grade I meningiom. Dessutom identifierar vi patienter med en MIB-1 >4,5 % som har hög risk för återfall efter GTR. Vi utnyttjar också våra data för att ge insikt i skillnader mellan tidiga och postmediala WHO grad I meningiomrecidiv, vilket potentiellt identifierar olika molekylära subgrupper av WHO grad I meningiom. Våra resultat tyder på att patienter med ett förhöjt MIB-1-index och nukleär atypi vid patologisk analys, posterior fossa-placering av sin tumör och STR har högre risk för recidiv och bör övervägas för närmare uppföljning eller till och med adjuvant strålbehandling. Dessutom har patienter med ett MIB-1-index över 4,5 % en liknande risk för recidiv som de som har genomgått STR av sina tumörer och bör också eventuellt övervägas för adjuvant strålbehandling.
Slutsats
Det finns fortfarande en brist på litteratur om specifika prediktorer för recidiv i WHO-gradig I meningiom. Resultaten av den här studien lyfter fram posterior fossa tumörlokalisering, MIB-1-index, nukleär atypi och resektionens omfattning som oberoende förknippade med recidiv av meningiom av grad I. Vi visar också att patienter med ett MIB-1 >4,5 % och GTR har en liknande risk för återfall som patienter med STR. Slutligen visade differentiell analys av tidiga och postmediala recidiv att det fanns ett samband mellan MIB-1-index och posteriora fossa-läge vid postmediala recidiv, medan tidiga recidiv påverkades mer signifikant av resektionens omfattning. Ytterligare studier som validerar våra resultat och inkluderar molekylära/genetiska data behövs för att identifiera ytterligare prediktorer för återfall i WHO grad I meningiom. Sådana studier skulle kunna ge en mer exakt ram för att riskstratifiera patienter och underlätta terapeutiskt beslutsfattande, inklusive potentialen för adjuvant strålbehandling.
Data Availability Statement
Rådata som stöder slutsatserna i den här artikeln kommer att göras tillgängliga av författarna, utan onödiga reservationer.
Ethics Statement
Studierna som involverade mänskliga deltagare granskades och godkändes av UCSF Institutional Review Board. Skriftligt informerat samtycke för deltagande krävdes inte för den här studien i enlighet med den nationella lagstiftningen och de institutionella kraven.
Författarnas bidrag
AH: konceptualisering, metodik, formell analys, utredning, skrivande-originalutkast, skrivande-granskning och redigering samt visualisering. JY: konceptualisering, metodik och skrivande-granskning och redigering. IK och SS: utredning. J-SC: visualisering och formell analys. DR och MM: skrivande, granskning och redigering. SM: skriftlig granskning och redigering, konceptualisering och metodik. MA: skriftlig granskning och redigering samt handledning. Alla författare bidrog till artikeln och godkände den inlämnade versionen.
Intressekonflikter
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller ekonomiska relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Recensenten BB deklarerade ett tidigare medförfattarskap med författarna DR, MM och SM till den behandlande redaktören.
1. Ostrom QT, Cioffi G, Gittleman H, Patil N, Waite K, Kruchko C, et al. CBTRUS statistisk rapport: primära tumörer i hjärnan och andra tumörer i centrala nervsystemet diagnostiserade i USA 2012-2016. Neuro Oncol. (2019) 21:v1-100. doi: 10.1093/neuonc/noz150
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Karsy M, Guan J, Cohen A, Colman H, Jensen RL. Medicinsk behandling av meningiom. Nuvarande status, misslyckade behandlingar och lovande horisonter. Neurosurg Clin N Am. (2016) 27:249-60. doi: 10.1016/j.nec.2015.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Brastianos PK, Galanis E, Butowski N, Chan JW, Dunn IF, Goldbrunner R, et al. Advances in multidisciplinary therapy for meningiomas. Neuro Oncol. (2019) 21:I18-31. doi: 10.1093/neuonc/noy136
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. Världshälsoorganisationens klassificering 2016 av tumörer i centrala nervsystemet: en sammanfattning. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Pettersson-Segerlind J, Orrego A, Lönn S, Mathiesen T. Långtidsuppföljning efter 25 år av kirurgiskt behandlade parasagittala meningiom. World Neurosurg. (2011) 76:564-71. doi: 10.1016/j.wneu.2011.05.015
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Van Alkemade H, De Leau M, Dieleman EMT, Kardaun JWPF, Van Os R, Vandertop WP, et al. Försämrad överlevnad och neurologiska problem på lång sikt vid benigna meningiom. Neuro Oncol. (2012) 14:658-66. doi: 10.1093/neuonc/nos013
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Buerki RA, Horbinski CM, Kruser T, Horowitz PM, James CD, Lukas RV. En översikt över meningiom. Futur Oncol. (2018) 14:2161-77. doi: 10.2217/fon-2018-0006
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Rogers L, Barani I, Chamberlain M, Kaley TJ, McDermott M, Raizer J, et al. Meningiom: kunskapsbas, behandlingsresultat och osäkerheter. A RANO review. J Neurosurg. (2015) 122:4-23. doi: 10.3171/2014.7.JNS131644
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Marciscano AE, Stemmer-Rachamimov AO, Niemierko A, Larvie M, Curry WT, Barker FG, et al. Benigna meningiom (WHO Grade I) med atypiska histologiska egenskaper: korrelation mellan histopatologiska egenskaper och kliniska resultat. J Neurosurg. (2016) 124:106-14. doi: 10.3171/2015.1.JNS142228
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Baumgarten P, Gessler F, Schittenhelm J, Skardelly M, Tews DS, Senft C, et al. Brain invasion in otherwise benign meningiomas does not predict tumör recurrence. Acta Neuropathol. (2016) 132:479-81. doi: 10.1007/s00401-016-1598-1
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gousias K, Schramm J, Simon M. The simpson grading revisited: aggressive surgery and its place in modern meningioma management. J Neurosurg. (2016) 125:551-60. doi: 10.3171/2015.9.JNS15754
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Matsuno A, Fujimaki T, Sasaki T, Nagashima T, Ide T, Asai A, et al. Klinisk och histopatologisk analys av proliferativa potentialer hos återkommande och icke-återkommande meningiom. Acta Neuropathol. (1996) 91:504-10. doi: 10.1007/s004010050458
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Oya S, Kawai K, Nakatomi H, Saito N. Significance of Simpson grading system in modern meningioma surgery: integration of the grade with MIB-1 labeling index as a key to predict the recurrence of WHO Grade I meningiomas – clinical article. J Neurosurg. (2012) 117:121-8. doi: 10.3171/2012.3.JNS111945
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Yuzawa S, Nishihara H, Tanaka S. Genetiskt landskap för meningiom. Brain Tumor Pathol. (2016) 33:237-47. doi: 10.1007/s10014-016-0271-7
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Karsy M, Azab MA, Abou-Al-Shaar H, Guan J, Eli I, Jensen RL, et al. Clinical potential of meningioma genomic insights: a practical review for neurosurgeons. Neurosurg Focus. (2018) 44:E10. doi: 10.3171/2018.2.FOCUS1849
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Patel AJ, Wan YW, Al-Ouran R, Revelli JP, Cardenas MF, Oneissi M, et al. Molekylär profilering förutsäger meningiomåterfall och avslöjar förlust av DREAM-komplexets repression i aggressiva tumörer. Proc Natl Acad Sci USA. (2019) 116:21715-26. doi: 10.1073/pnas.1912858116
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Spille DC, Heß K, Sauerland C, Sanai N, Stummer W, Paulus W, et al. Brain invasion in meningiomas: incidens och korrelationer med kliniska variabler och prognos. World Neurosurg. (2016) 93:346-54. doi: 10.1016/j.wneu.2016.06.055
PubMed Abstract | CrossRef Full Text | Google Scholar
18. PiŽem J, Velnar T, Prestor B, Mlakar J, Popović M. Bedömbarheten av hjärninvasion i meningiom är relaterad till meningiomstorlek och grad och kan förbättras genom omfattande provtagning av det kirurgiskt avlägsnade meningiomprovet. Clin Neuropathol. (2014) 33:354-63. doi: 10.5414/NP300750
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Maillo A, Orfao A, Espinosa AB, Sayagués JM, Merino M, Sousa P, et al. Tidiga återfall i histologiskt godartade/grad I meningiom är förknippade med stora tumörer och samexistens av monosomi 14 och del(1p36) i den ursprungliga tumörcellklonen. Neuro Oncol. (2007) 9:438-46. doi: 10.1215/15228517-2007-026
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Youngblood MW, Duran D, Montejo JD, Li C, Omay SB, Özduman K, Sheth AH, et al. Korrelationer mellan genomisk subgrupp och kliniska egenskaper i en kohort av mer än 3 000 meningiom. J Neurosurg. (2019). doi: 10.3171/2019.8.jns191266. .
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Chen WC, Magill ST, Wu A, Vasudevan HN, Morin O, Aghi MK, et al. Histopatologiska egenskaper som förutsäger lokal kontroll av atypiska meningiom efter kirurgi och adjuvant strålbehandling. J Neurosurg. (2019) 130:443-50. doi: 10.3171/2017.9.JNS171609
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Perry A, Stafford SL, Scheithauer BW, Suman VJ, Lohse CM. Den prognostiska betydelsen av MIB-1, p53 och DNA-flödescytometri i fullständigt resecerade primära meningiom. Cancer. (1998) 82:2262-9. doi: 10.1002/(SICI)1097-0142(19980601)82:11<2262::AID-CNCR23>3.0.CO;2-R
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Ohba S, Kobayashi M, Horiguchi T, Onozuka S, Yoshida K, Ohira T, et al. Long-term surgical outcome and biological prognostic factors in patients with skull base meningiomas: clinical article. J Neurosurg. (2011) 114:1278-87. doi: 10.3171/2010.11.JNS10701
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Soyuer S, Chang EL, Selek U, Shi W, Maor MH, DeMonte F. Strålbehandling efter kirurgi för godartat hjärnhinneatom. Radiother Oncol. (2004) 71:85-90. doi: 10.1016/j.radonc.2004.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Park S, Cha YJ, Suh SH, Lee IJ, Lee KS, Hong CK, et al. Riskgruppsanpassad adjuvant strålbehandling för meningiom i skallbasen av WHO-grad I och II. J Cancer Res Clin Oncol. (2019) 145:1351-60. doi: 10.1007/s00432-019-02891-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Budohoski KP, Clerkin J, Millward CP, O’Halloran PJ, Waqar M, Looby S, et al. Prediktorer för tidig progression av kirurgiskt behandlade atypiska meningiom. Acta Neurochir. (2018) 160:1813-22. doi: 10.1007/s00701-018-3593-x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. De La Monte SM, Flickinger J, Linggood RM. Histopatologiska egenskaper som förutsäger återfall av meningiom efter subtotal resektion. Am J Surg Pathol. (1986) 10:836-43. doi: 10.1097/00000478-198612000-00002
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Backer-Grøndahl T, Moen BH, Torp SH. Det histopatologiska spektrumet av mänskliga meningiom. Int J Clin Exp Pathol. (2012) 5:231-42.
PubMed Abstract | Google Scholar
29. Rezanko T, Akkalp AK, Tunakan M, Sari AA. Metoder för att räkna MIB-1 i meningiom och överenskommelse mellan patologer. Anal Quant Cytol Histol. (2008) 30:47-52.
PubMed Abstract | Google Scholar
30. Pérez-Magán E, Campos-Martín Y, Mur P, Fiaño C, Ribalta T, García JF, et al. Genetiska förändringar i samband med progression och återfall i meningiom. J Neuropathol Exp Neurol. (2012) 71:882-93. doi: 10.1097/NEN.0b013e31826bf704
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Linsler S, Kraemer D, Driess C, Oertel J, Kammers K, Rahnenführer J, et al. Molekylärbiologiska bestämningar av meningiomutveckling och återfall. PLoS ONE. (2014) 9:e94987. doi: 10.1371/journal.pone.0094987
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Barbera S, Miguel TS, Gil-Benso R, Muñoz-Hidalgo L, Roldan P, Gonzalez-Darder J, et al. Genetiska förändringar med prognostiskt värde i histologiskt godartade meningiom. Clin Neuropathol. (2013) 32:311-7. doi: 10.5414/NP300580
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Gao F, Shi L, Russin J, Zeng L, Chang X, He S, et al. DNA-metylering vid malign omvandling av meningiom. PLoS ONE. (2013) 8:e54114. doi: 10.1371/journal.pone.0054114
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Vengoechea J, Sloan AE, Chen Y, Guan X, Ostrom QT, Kerstetter A, et al. Metyleringsmarkörer för malign potential i meningiom. J Neurosurg. (2013) 119:899-906. doi: 10.3171/2013.7.JNS13311
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Lu VM, Goyal A, Lee A, Jentoft M, Quinones-Hinojosa A, Chaichana KL. Den prognostiska betydelsen av mutationer i TERT-promotorn vid meningiom: en systematisk genomgång och metaanalys. J Neurooncol. (2019) 142:1-10. doi: 10.1007/s11060-018-03067-x
PubMed Abstract | CrossRef Full Text | Google Scholar
.