Introduktion
Ris har en komplex rotstruktur med en blandning av embryonala och postembryonala rötter. Radikeln dyker upp först under groningen och följs strax därefter av embryonala koronärrötter (Rebouillat et al., 2009; Coudert et al., 2010). De första adventiva postembryonala rötterna som är ett resultat av skottets apikala meristemaktivitet uppträder några dagar efter groddningen av fröplantan. Adventivrötter kallas också för koronarrötter eller kronrötter och produceras under hela plantans liv.
Risets inre rotanatomi är väl beskriven, särskilt i fröplansstadiet (Rebouillat et al., 2009). Flera koncentriska vävnader (från periferin till stelen) är belägna mellan epidermis och kärlvävnaderna (figur 1). Dessa vävnader, som tillsammans kallas ”grundvävnad”, kallas ibland även för ”cortex” (Lux et al., 2004). Här behåller vi den generiska termen, dvs. jordvävnad, för att beskriva de exodermala, sklerenchymala, kortikala och endodermala vävnaderna. Vi hänvisar till ”cortex” som den vävnad som ligger mellan endodermis och sclerenchyma.
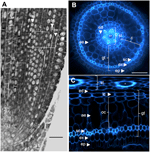
Figur 1. Anatomi av en 6 dagar gammal Nipponbare-radikel. (A) Längsgående sektion av en radikula fixerad och paraplast inbäddad. Streck = 100 μm. (B) Tvärsnitt av en färsk radikula observerad under UV-ljus. Streck = 50 μm. (C) Polartransformerad vy av B. Vävnadsskikten är märkta enligt följande: stele (st), grundvävnad (gt) som består av flera cellskikt: ett lager endodermis (ed), flera lager cortex (c), ett lager sclerenchyma (sc) och ett lager exodermis (ex). De endodermala (ed) och exodermala (ex) lagren är lätta att identifiera genom avsaknad/reducering av fluorescens i cellväggscentrumen i dessa celler. Radikeln skyddas av ett lager epidermis (ep). Två typer av kortikala lager kan identifieras: inre cortex (ic), som ligger bredvid endodermis (ed), och yttre cortex (oc), som så småningom kommer att bilda aerenchyma (ae). I stelen kan man notera förekomsten av ett stort centralt metaxylem (cx) som omges av 6 metaxylemkärl (x).
Grundvävnad består av flera lager av vävnader som har samma parenkymatära ursprung men olika specifika egenskaper som spelar olika och viktiga strukturella och funktionella roller i rötterna. Exempelvis är exodermis och endodermis apoplastiska barriärer som kontrollerar den radiella transporten av vatten och näringsämnen från jorden till de fotosyntetiska organen, en funktion som främst tillhandahålls av suberinlamellernas avsättning och sekundär cellväggsdifferentiering (Gregory, 2006). Sclerenchyma är lignifierade celler som utgör en kritisk barriär mot vissa metaller och eventuellt spelar en mekanisk stödfunktion (Huang et al., 2012). Till skillnad från dessa tre monolagsvävnader består kortikalvävnaden i risradikeln av fyra eller fem lager. Denna vävnad, som också benämns mittkortikal eller mesodermis, kännetecknas av den schizogena bildningen av utrymmen, vilket leder till bildandet av aerenchyma i ris (Justin och Armstrong, 1991; Kawai et al., 1998). Aerenchyma spelar en viktig roll för toleransen mot översvämningsförhållanden och säkerställer ett kontinuerligt syreflöde från skottet till roten, vilket möjliggör rottillväxt under anoxiska förhållanden. Cortex har en viktig men varierande funktion i rotfysiologin hos många arter och är involverad i lagring, översvämningstolerans eller symbiotiska interaktioner (Lux et al., 2004).
Radikeln och kronrötterna producerar tre typer av sidorötter: små sidorötter (SLR) och två typer av stora sidorötter (Kawata och Shibayama, 1965; Kono et al., 1972; Rebouillat et al., 2009). Denna indelning baseras på (i) rotdiameter: SLR är de minsta (50-60 μm) och L-LLR är de största (120-150 μm), ii) förgreningar, som endast observeras på LLR, iii) närvaron av ett centralt metaxylemkärl endast i LLR och iv) närvaron av ett sklerenchymskikt endast i L-LLR (Kono et al., 1972; Kawata et al., 1977; Rebouillat et al., 2009). Trots denna klassificering förblir identiteten hos inre rotvävnader i laterala rötter, särskilt SLR, osäker. Rebouillat et al. (2009) och Kawata et al. (1977) hävdade båda att SLR-grundvävnad bestod av endodermis, sclerenchyma och exodermis (från insidan mot utsidan), medan Kono et al. (1972) beskrevs det inre cortex sclerenchymatösa cellskiktet som frånvarande i SLR och T-LLR.
För att lösa detta dilemma, och för att studera utveckling och funktion av särskilda vävnader i allmänhet, krävs användning av identitetsmarkörer. De flesta av de vävnadsmarkörer som hittills använts är morfologiska markörer eller histokemiska färgningar, som har gett ett användbart sätt att karakterisera cellidentitet. Berberin avslöjar förekomsten av suberin i cellväggar, som nästan uteslutande finns i de Caspariska remsor som omger varje enskild endodermiscell och är därmed en bra indirekt markör för endodermal identitet (Brundett et al., 1988). I A. thaliana utvecklades också vävnadsspecifika markörer med hjälp av vävnadsspecifika promotorer fusionerade med reportergener (GUS och/eller GFP) i genetiskt modifierade växter. Till exempel används SCARECROW-promotorn som en endodermal identitetsmarkör (Sugimoto et al., 2010). QC25 och QC46 enhancer trap GUS-linjer (Sabatini et al., 2003) och QHB i ris (Kamiya et al., 2003) identifierades också som QC-markörer (quiescent center) baserat på deras QC-specifika uttryck. Trots intresset för dessa markörer finns endast ett fåtal tillgängliga och nästan uteslutande i A. thaliana. De har också nackdelar. Till exempel är lämpligheten av att använda SCARECROW-promotorn (SCR) som en ”endodermis”-markör diskutabel när specifika frågor om SCR:s och SHORT ROOT:s (SHR) roller i differentiering av jordvävnad tas upp. I själva verket är SCR- och SHR-generna i sig involverade i bildandet av endodermis/cortex (Wu och Gallagher, 2014). I A. thaliana är de enda tillgängliga markörerna för rotkortex de Co2- och Co3-promotorer som finns tillgängliga (Heidstra et al., 2004; Ten Hove et al., 2010). I ris används dessa cortexmarkörer ännu inte eftersom det inte finns några tydliga ortologer för Co2- och Co3-generna. Endast indirekta morfologiska markörer har hittills använts i ris, t.ex. aerenchyma-bildning för kortikal identitet (Rebouillat et al., 2009).
En annan klass av markörer är kommersiellt tillgängliga antikroppar riktade mot växternas cellväggar (http://www.plantprobes.net/index.php). Dessa markörer har använts knappt tidigare, men deras effektivitet har visats. Till exempel användes cellväggsantikropparna CCRC-M2 och JIM13 i A. thaliana för att visa att det enda skiktet av inre vävnad som finns i shr-mutanten hade kortikal identitet medan jordvävnadsskiktet i scr-mutanten uppvisade flera identiteter (Di Laurenzio et al., 1996; Helariutta et al., 2000). Dessa markörer har många fördelar: deras enkelhet och möjligheten att kombinera sekundära antikroppar kopplade till olika fluorokromer för att begränsa överlappning med autofluorescens, de kräver ingen genetisk transformation och de kan användas för att komplettera andra klasser av markörer.
I den här artikeln beskriver vi först ett enkelt protokoll med medelhög genomströmning för immunmärkning av färska vibratomvävnadssnitt. Med hjälp av detta protokoll screenade vi radiella sektioner av risradikaler med ett stort bibliotek av 174 cellväggsantikroppar. Bland dessa identifierade vi åtta cortex-specifika markörer och visade att ris har två typer av corticala vävnader med distinkt identitet. Vi kallade dessa lager för inre och yttre cortex baserat på deras respektive anatomiska position i rotsektionerna. För att visa på användbarheten av dessa cortexspecifika markörer klargjorde vi markvävnadsidentiteten hos sidorötter med hjälp av tre av dessa antikroppar. Särskilt i SLR visar vi att det inre vävnadsskiktet har en yttre kortikal identitet. Vårt protokoll är tillräckligt generiskt för att kunna användas för utveckling av vävnadsmarkörer i alla arter utan att behöva generera transgena växter. Detta protokoll kan lätt anpassas med färska skott, blad, rötter eller andra vävnader i andra växter och utgör ett enkelt och lätt sätt att identifiera vävnadsspecifika markörer. Dessutom kan dessa markörer användas tillsammans med andra molekylära markörer.
Resultat
Immunoprofilering av cellväggsantikroppar i radikala sektioner av risrötter avslöjar specifika antikroppar för kortikalskikten
Med målet att identifiera antikroppsbaserade markörer för kortikala celler etablerade vi först ett protokoll för immunmärkning med medelhög genomströmning av radiala sektioner av färska risrötter (se Material och metoder och Supplementär figur 1 för detaljer). Därefter utförde vi en screening med monoklonala antikroppar som tagits fram mot cellväggskomponenter (från Complex Carbohydrate Research Center (CarboSource Services, Athens Georgia, USA) och Paul Knox Cell Wall lab (University of Leeds, UK), se material och metoder för detaljer)) för att identifiera cortexmarkörer. Av de 174 antikroppar som testades var det endast 12 som kunde anses vara cortexspecifika. Vi testade deras repeterbarhet genom att utföra ytterligare två experiment och kom fram till att åtta antikroppar uppvisade liknande och robusta profiler bland de tre replikaten (figur 2). Fem antikroppar (JIM7, M14, M38, M130 och M131) gav samma immunmärkningsmönster i cortex. Endast icke angränsande cellväggar märktes, vilket resulterade i en unik ”diamantformad” märkning av alla kortikala celler. För de tre andra antikropparna (LM5, M133 och M107) upptäcktes märkningen i cortex och ibland i sclerenchymacellerna, särskilt med LM5- och M107-antikropparna. Signalen var homogen på cortexcellväggen, men var mycket svagare i de inre cortexlagren (det lager av cortex som gränsar till det endodermala lagret) än i de yttre cortexlagren. Alla dessa antikroppar med profiler som kompletterar kortikala vävnader är således specifika markörer som kan användas för att analysera kortikala cellers identitet. Dessutom tyder de två olika kortikala märkena, som definierar två subkortikala områden, på att de yttre och inre lagren har en distinkt molekylär identitet som avslöjades av dessa antikroppar.
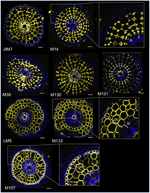
Figur 2. Identifiering av åtta specifika cortexantikroppar (JIM7, M14, M38, M130, M131, LM5, M133 och M107) bland de 174 som undersöktes från biblioteket med monoklonala cellväggsantikroppar. För varje antikropp erhölls sammanslagna bilder av tvärsnitt i ett konfokalmikroskop efter immunohistologisk märkning: i gult, antikroppsmönster vid 561 nm, och i blått, cellväggens autofluorescens under UV-ljus. Fem antikroppar (JIM7, M14, M38, M130 och M131) uppvisar en liknande profil i alla färgade kortikala cellskikt (diamantformer). Tre antikroppar (LM5, M133 och M107) märkte homogent kortikala cellväggar. Observera att för dessa antikroppar är de inre kortikala lagren (ic) inte färgade jämfört med de yttre kortikala lagren (oc). Inslagen är närbilder av motsvarande bilder. Staplar = 20 μm.
Några specifika egenskaper hos dessa två subkortikala lager framhävdes när insticksmodulen ”polar transformator” i programvaran ImageJ (http://imagej.nih.gov/ij/) användes för att visa bilderna av rotsektionerna (figurerna 1B,C; Schneider et al., 2012; Lartaud et al., 2014). De inre cellerna kännetecknades av en tjock cellvägg jämfört med de yttre cellerna, som uppvisade olika luftinnehållande håligheter till följd av cellväggssammansmältning. De inre kortikala cellerna uppvisade också en tillplattad form som liknade endodermala celler, i motsats till de yttre cellerna som var rundare. I denna transformerade bild syns inte den radiella cellväggen, dvs. väggen som löper från cellens insida till utsidan, autofluorescensen hos de endodermala och exodermala cellerna, förmodligen på grund av närvaron av Casparianska remsor. På samma sätt, men i mindre utsträckning, var små hål utan autofluorescens synliga på de radiella cellväggarna i de inre kortikala cellerna.
Alla laterala rotstyper har endast yttre kortikal vävnad
För att visa på kortikalmarkörernas användbarhet och för att karakterisera cellidentiteter märkte vi de tre ris laterala rotstyperna (L-LLR, T-LLR och SLR) med tre av dessa antikroppar (M107, M133 och M14). För detta experiment, eftersom L-LLR inte ofta utvecklas på petriskålar, samlades laterala rötter in från risfröplantor som odlats under hydroponiska förhållanden i två veckor. Vi analyserade först grundvävnadsorganisationen för varje typ av sidorot genom att observera cellväggarnas autofluorescens i rotsektionernas tvär- och polära vyer (figur 3). Denna första analys avslöjade en något distinkt inre radiell anatomi för de tre typerna av sidorötter. I likhet med de radikelsnitt som betraktas i UV-ljus kan de endodermala och exodermala vävnaderna identifieras genom fluorescensutdunstningen i mitten av de radiella cellväggarna. Dessa två vävnader fanns i alla sidorötter. Mellan endodermis och exodermis fanns flera vävnadslager i L-LLR och T-LLR medan SLR endast hade ett enda (oidentifierat) cellskikt. L-LLRs anatomi såg ut som seminala rötter och utanför endodermis identifierades lätt flera lager kortikal vävnad när aerenchymavävnad bildades. Dessutom observerades också ett sklerenchymskikt som bildades av tätt packade celler med breda cellväggar. Beroende på experimentet var detta cellskikt inte alltid helt utvecklat. I T-LLR-snitten liknade det yttre lagret kortikal vävnad och det inre lagret liknade det enda (oidentifierade) SLR-skiktet.
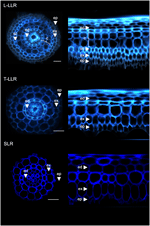
Figur 3. Vävnadssammansättning för typerna av stora laterala rötter (Large-LLR och Thin-LLR) och små laterala rötter (SLR). Fröplantor odlades under hydroponiska förhållanden i två veckor. Cellväggens autofluorescens i tvärsnitt och polartransformerad vy under UV-ljus. Vävnaderna är märkta enligt följande: epidermis (ep), exodermis (ex), cortex (c), endodermis (ed). Observera att epidermis (ep) ofta var fragmenterad under experimentets gång. Staplar = 20 μm.
För att identifiera de cellskikt som finns i SLR- och T-LLR-grundvävnader och för att bekräfta den kortikala identiteten i L-LLR:erna immunmärkte vi laterala rotsektioner med tre kortikalspecifika antikroppar (M107, M133 och M14; figur 4). Antikropparna M107 och M133 märkte alla cellskikt som ligger mellan endodermis och exodermis i alla sidorötter. Baserat på radikelfärgning för dessa antikroppar tyder denna observation på att dessa cellskikt kan ha sclerenchyma- eller kortikal identitet. Det faktum att M14 också immunmärkte dessa lager, särskilt i SLR-sektionerna, visar dock tydligt att dessa lager var identiska med den yttre kortikalen.

Figur 4. Sammanslagna bilder av sektionerna av Large Lateral Root-typerna (Large-LLR och Thin-LLR) och Small Lateral Root (SLR) immunmärkta med M107, M133 och M14. Plantorna odlades under hydroponiska förhållanden i två veckor. I gult, antikroppsmärkning vid 561 nm, och i blått, autofluorescens under UV-ljus. Vävnaderna är märkta enligt följande: epidermis (ep), exodermis (ex), cortex (c), endodermis (ed). Observera att epidermis (ep) ofta fragmenterades under experimentets gång. Staplar = 20 μm.
Variationer i antalet yttre kortikala cellskikt (ett i SLRs, två i T-LLRs, tre i L-LLRs och fyra till fem i radikeln) spelar en viktig roll för risrotdiametern (figur 5).
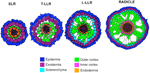
Figur 5. Schematisk framställning av vävnader för sidorötter och radikler.
Slutsatser
Differenta termer har redan använts för att kvalificera subkortikala områden i växter. Till exempel har förekomsten av ett ”inre” lignifierat cortexskikt, jämförbart med det som studerats här, redan beskrivits i vildris (Yang et al., 2014). I majs definieras de två kortikala områdena på olika sätt (Baluška et al., 1993). Den ”inre” domänen bildar aerenchyma, vilket motsvarar den yttre kortexen här, och den ”mellersta-yttre” kortexen är en lignifierad stödvävnad, som skulle kunna vara sclerenchyma. I Arabidopsis har man också beskrivit ett cellskikt för den ”mellersta cortexen”, som ligger mellan det kortikala monolagret och endodermis (Baum et al., 2002; Paquette och Benfey, 2005). Nya resultat tyder på att detta cortexskikt, vars bildning regleras av bland annat GA, oxidativ stress samt SHR och SCR, spelar en roll för abiotisk tolerans (Paquette och Benfey, 2005; Cui och Benfey, 2009; Pauluzzi et al., 2012; Wu och Gallagher, 2014). Intressant nog beskrivs detta lager också som ett spiralliknande lager med en typisk form (Baum et al., 2002). Kan detta lager av Arabidopsis ”middle cortex” vara funktionellt och strukturellt likt det inre cortexskiktet i risradikeln? I längsgående och tvärgående snitt av ris bildar det inre kortikalskiktet också vanligtvis en helix, vilket tyder på att dessa två vävnadslager skulle kunna vara jämförbara. I Arabidopsis härstammar det ”mellersta cortexskiktet” från en endodermis periklinal delning, som framträder bort från QC mellan 7 och 14 dagar efter groningen (Paquette och Benfey, 2005). Nya verktyg kommer att vara nödvändiga för att verifiera dessa viktiga parametrar i ris. Hittills har till exempel ingen mutant som påverkar tidpunkten för bildandet av detta skikt beskrivits. Dessutom krävs också tekniska framsteg när det gäller att avbilda risets QC. Icke desto mindre erbjuder våra cortex-specifika markörer ett nytt verktyg för att jämföra funktionen och det molekylära nätverket som är involverat i bildandet av inre cortex (ris) jämfört med ”mellancortex” (Arabidopsis). Arbete pågår i vårt laboratorium för att identifiera de molekylära bestämningsfaktorerna för bildandet av inre och yttre cortex, med SCR- och SHR-ortologer från ris som första kandidater för regleringen av cortexbildningen i risrötter (Pauluzzi et al, 2012).
Material och metoder
Växtmaterial
Sex dagar gamla fröplantor
Frön av Oryza sativa L. ssp. japonica Nipponbare odlades vertikalt i sterila petriskålar (Corning, 431301; 20 × 20 cm) under kontrollerade förhållanden (dag/nattrytm: 12/12 h, 28/25 °C, ljusintensitet: 500 μE m-2 s-1). Först ytsteriliserades fröna genom att sköljas i 70 % etanol i ~1 minut. Därefter ersattes etanolen med en lösning bestående av 40 % blekmedel i destillerat vatten med tre droppar tween 80 (Sigma-Aldrich P4780-500 mL). Fröna blötlades i denna lösning i 30 minuter under lätt omrörning och sköljdes sedan minst fyra gånger med sterilt destillerat vatten. Varmt (~50°C) autoklavsteriliserat halvstarkt Murashige och Skoog (MS/2)-medium (250 mL) hälls i petriskålar och låter stelna i ~45 min. Det fasta MS/2-mediet består av 2,15 g.L-1 MS-mediets bassaltblandning (Duchefa Biochemie, M0221), 75 mg.L-1 MS-vitaminblandning (Duchefa Biochemie, M0409) och 8 g.L-1 agaros typ II (Sigma-Aldrich, A6877). Sterila frön trycks sedan in i det stelnade MS/2-mediet med radbanan orienterad nedåt. Rötterna skördades efter 6 dagars tillväxt.
Fyra veckor gamla plantor
Efter 3 dagars groddning i vatten överfördes plantorna till ett hydroponiskt system under kontrollerade förhållanden (dag/nattrytm: 12/12 h, 28/25°C, ljusintensitet: 500 μE m-2 s-1, relativ luftfuktighet: 55 %). Det hydroponiska systemet består av en 50 l plastlåda som innehåller 30 l hydroponisk lösning på vilken en 1 cm tjock skumgummimadrass läggs. Skummadrassen är genomborrad med luckor för att upprätthålla fröplantornas stammar. Det hydroponiska mediet består av (NH4)2SO4 (0,5 mM), MgSO4.7H2O (1,6 mM), Ca(NO3)2.4H2O (1,2 mM), KNO3 (0,7 mM), FeSO4 (0,1 mM), Na2EDTA (0,1 mM), MnSO4. H2O (1,7 μM), (NH4)6Mo7O24.4H2O (0,2 μM), ZnSO4.7H2O (0,2 μM), CuSO4.5H2O (0,2 μM), H3BO3 (1,4 μM) och KH2PO4 (0,6 μM). Lösningen luftas med hjälp av en pump som placeras i botten av plastlådan och byts ut var tionde dag. pH justerades och hölls på 5,4 ± 0,2.
Färsk rotsektionering
Topparna av växande radikler eller sidorötter (2 cm) skars av med hjälp av en vass kniv och placerades parallellt med varandra för att rikta in rotspetsarna (kompletterande figurer 1A, B). De bäddades in i en droppe 3 % smält agaros (50 °C; kompletterande figur 1C). Plattor med rotspetsar sattes in i en 3 × 1 × 1 cm stor brunn fylld med 3 % smält agaros (kompletterande figur 1D). Efter stelning ändrades blockens storlek och klistrades på en vibratomplatta för att skivas. Vibratomens (Hm650v (Thermo Scientific Microm)) parametrar var hastighet 30, frekvens 70, amplitud 0,8 och tjocklek 60 μm (kompletterande figur 1E). Sektionerna överfördes antingen på kammarglas (Lab-teak 177402) för immunfärgning (kompletterande figur 1F) eller på glas som fuktades med 1X alkalisk fosfatbuffert (PBS, Sigma-Aldrich P3813) för observation.
Immunolokalisering
Sektionerna som placerades på kammarglasen (tre per kammare) sköljdes först i 0,1 M glycin kompletterat med 1X PBS och sedan två gånger i 1X PBS, vardera i 10 minuter. Vävnaderna sänktes sedan ner i en PBS-lösning som innehöll 5 % serum från bovint foster (blockeringslösning, Thermo Fisher 37520) vid 4 °C över natten under omrörning. Primära antikroppar, utspädda 1/10 i denna blockeringslösning, applicerades över natten vid 4 °C under omrörning. Sektionerna sköljdes sedan 3 gånger i PBS 1X i 10 minuter. Rotsektionerna inkuberades i 2 timmar med den sekundära antikroppen utspädd 500 gånger i blockeringslösningen under omrörning. Dessa antikroppar var kopplade till en fluorofor, Alexa 546 antikropp mot råtta (Invitrogen A11081) eller Alexa 546 antikropp mot mus (Invitrogen A11060). Därefter sköljdes sektionerna återigen tre gånger i 1X PBS under omrörning i 10 minuter vardera. Kamrarna avlägsnades och några droppar mowiolmonteringsmedia (Sigma-Aldrich 81381) tillsattes. Ett täckglas placerades på rotsektionerna, som fick torka i 36 timmar vid 4°C i mörker.
Paraplastfixering
Radiklar som odlats på Petriskålar i 6 dagar fixerades i 4 % paraformaldehyd (i PBS 1X) över natten vid 4°C och sköljdes två gånger med PBS 1X (Jackson, 1991). De fixerade vävnaderna dehydratiserades i etanol, rensades i Histochoice Clearing Agent (HistoClear, Sigma Aldrich) och bäddades in i Paraplast (Fisher). Vävnaderna sektionerades (6 μm tjocka) på en Leica RM2255 mikrotom och monterades på SuperfrostPlus-objektsglas (Fisher).
Mikroskopi
Högfälts- och autofluorescensobservationer utfördes med hjälp av ett Leica DM4500-mikroskop. För autofluorescens togs bilder med A-filterkuben (excitationsområde: UV; excitationsfilter: BP 340-380; undertryckningsfilter: LP 425). Immunfärgade sektioner observerades med konfokala mikroskop: Zeiss LSM 510 eller Leica SP8. Cellväggarna visualiserades först med hjälp av autofluorescens . Den sekundära antikroppen visualiserades med hjälp av en Helium/Neon-laser vid 543 respektive 561 nm. Bilderna togs med en färgkamera Retiga 2000R (QIMAGING, Kanada) som körde Volocity bildförvärvsprogramvara (Improvision, Storbritannien).
Författarbidrag
SH, FD, MB, CB: insamling av data; SH, CP, AD analys av data; SH, EG, CP, AD: utarbetande av manuskriptet.
Intressekonfliktförklaring
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller finansiella relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Acknowledgments
Vi tackar MRI (Montpellier RIO Imaging-plattformen), PHIV och La Gaillarde-plattformen för deras tekniska stöd för immunolokalisering och/eller konfokal- och multi-fotonbildtagning. SH stöds av ett CIRAD PhD-stipendium.
Supplementary Material
Supplementary Material for this article can be found online at: https://www.frontiersin.org/article/10.3389/fpls.2015.01139
Abkortningar
ae, aerenchyma; c, cortex; ed, endodermis; ep, epidermis; ex, exodermis; gt, ground tissue; ic, inner cortex; L-LLR, Large-type Large Lateral Root; oc, outer cortex; sc, sclerenchyma; SLR, Small Lateral Root; st, stele; T-LLR, Thin-type Large Lateral Root; x, xylem.
Baluška, F., Brailsford, R. W., Hauskrecht, M., Jackson, M. B. och Barlow, P. W. (1993). Cellulär dimorfism i majsens rotkortex: inblandning av mikrotubuli, etylen och gibberellin i differentieringen av cellulärt beteende i postmitotiska tillväxtzoner. Bot. Acta 106, 394-403. doi: 10.1111/j.1438-8677.1993.tb00766.x
CrossRef Full Text | Google Scholar
Baum, S. F., Dubrovsky, J. G., and Rost, T. L. (2002). Apikal organisation och mognad av cortex och kärlcylinder i Arabidopsis thaliana (Brassicaceae) rötter. Am. J. Bot. 89, 908-920. doi: 10.3732/ajb.89.6.908
PubMed Abstract | CrossRef Full Text | Google Scholar
Brundett, M. C., Enstone, D. E. och Peterson, C. A. (1988). En fluorescerande färgningsmetod med berberin-anilinblått för suberin, lignin och kallos i växtvävnad. Protoplasma 146, 133-142. doi: 10.1007/BF01405922
CrossRef Full Text | Google Scholar
Coudert, Y., Périn, C., Courtois, B., Khong, N. G. och Gantet, P. (2010). Genetisk kontroll av rotutvecklingen i ris, modellspannmålet. Trends Plant Sci. 15, 219-226. doi: 10.1016/j.tplants.2010.01.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., and Benfey, P. N. (2009). Samspel mellan SCARECROW, GA och LIKE HETEROCHROMATIN PROTEIN 1 i grundvävnadsmönstring i Arabidopsis rot. Plant J. 58, 1016-1027. doi: 10.1111/j.1365-313X.2009.03839.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Laurenzio, L., Wysocka-Diller, J., Malamy, J. E., Pysh, L., Helariutta, Y., Freshour, G., et al. (1996). SCARECROW-genen reglerar en asymmetrisk celldelning som är väsentlig för att generera Arabidopsis-rötans radiella organisation. Cell 86, 423-433. doi: 10.1016/S0092-8674(00)80115-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Gregory, P. J. (2006). Plant Roots: Growth, Activity, and Interaction with Soils. Oxford; Ames, IA: Blackwell Pub.
Google Scholar
Heidstra, R., Welch, D. och Scheres, B. (2004). Mosaikanalyser med hjälp av markerade aktiverings- och deletionskloner dissekerar Arabidopsis SCARECROW verkan vid asymmetrisk celldelning. Genes Dev. 18, 1964-1969. doi: 10.1101/gad.305504
PubMed Abstract | CrossRef Full Text | Google Scholar
Helariutta, Y., Fukaki, H., Wysocka-Diller, J., Nakajima, K., Jung, J., Sena, G., et al. (2000). Genen SHORT-ROOT kontrollerar den radiella mönstringen av Arabidopsis rot genom radiell signalering. Cell 101, 555-567. doi: 10.1016/S0092-8674(00)80865-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, C. F., Yamaji, N., Ono, K. och Ma, J. F. (2012). En leucinrik upprepad receptorliknande kinasgen är involverad i specifikationen av yttre cellskikt i risrötter. Plant J. 69, 565-576. doi: 10.1111/j.1365-313X.2011.04824.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Jackson, D. (1991). ”In-situ hybridization in plants” i Molecular Plant Pathology: A Practical Approach, eds D. J. Bowles, M. McPherson, and S. J. Gurr (Totowa, NJ: Humana Press), 163-174.
Google Scholar
Justin, S. H. F. W., and Armstrong, W. (1991). Bevis för att etylen är inblandat i aerenchymbildningen i adventivrötter av ris (Oryza sativa L.). New Phytol. 118, 49-62. doi: 10.1111/j.1469-8137.1991.tb00564.x
CrossRef Full Text | Google Scholar
Kamiya, N., Nagasaki, H., Morikami, A., Sato, Y. och Matsuoka, M. (2003). Isolering och karakterisering av en homeobox-gen av ris av WUSCHEL-typ som uttrycks specifikt i de centrala cellerna i ett quiescent center i den apikala rotmeristemet. Plant J. 35, 429-441. doi: 10.1046/j.1365-313X.2003.01816.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kawai, M., Samarajeewa, P. K., Barrero, R. A., Nishiguchi, M. och Uchimiya, H. (1998). Cellulär dissektion av nedbrytningsmönstret för kortikal celldöd under aerenchyma-bildningen av risrötter. Planta 204, 277-287. doi: 10.1007/s004250050257
CrossRef Full Text | Google Scholar
Kawata, S., Sasaki, O. och Yamazaki, K. (1977). Om strukturen hos kronroten och sidoroten, och kärlförbindelsen mellan dem, hos risplantor. Jpn. J. Crop. Sci. 46, 569-579. doi: 10.1626/jcs.46.569
CrossRef Full Text | Google Scholar
Kawata, S., and Shibayama, B. (1965). Om bildandet av primordier av sidorötter i risplantans kronrötter. Proc. Crop Sci. Soc. Jpn. 33, 423-431. doi: 10.1626/jcs.33.423
CrossRef Full Text | Google Scholar
Kono, Y., Igeta, M. och Yamada, N. (1972). Studier av utvecklingsfysiologin hos sidorötterna i risets seminala rötter. Jpn. J. Crop. Sci. 41, 192-204. doi: 10.1626/jcs.41.192
CrossRef Full Text
Lartaud, M., Perin, C., Courtois, B., Thomas, E., Henry, S., Bettembourg, M., et al. (2014). PHIV-RootCell: ett övervakat bildanalysverktyg för kvantifiering av anatomiska parametrar för risrötter. Front. Plant Sci. 5:790. doi: 10.3389/fpls.2014.00790
PubMed Abstract | CrossRef Full Text | Google Scholar
Lux, A., Luxova, M., Abe, J. och Morita, S. (2004). Root cortex: strukturell och funktionell variabilitet och reaktioner på miljöstress. Root Res. 13, 117-131. doi: 10.3117/rootres.13.117
CrossRef Full Text | Google Scholar
Paquette, A. J., and Benfey, P. N. (2005). Mognad av rotens grundvävnad regleras av gibberellin och SCARECROW och kräver SHORT-ROOT. Plant Physiol. 138, 636-640. doi: 10.1104/pp.104.058362
PubMed Abstract | CrossRef Full Text | Google Scholar
Pauluzzi, G., Divol, F., Puig, J., Guiderdoni, E., Dievart, A. och Périn, C. (2012). Surfing along the root ground tissue gene network. Dev. Biol. 365, 14-22. doi: 10.1016/j.ydbio.2012.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Rebouillat, J., Dievart, A., Verdeil, J., Escoute, J., Giese, G., Breitler, J., et al. (2009). Molekylär genetik av risets rotutveckling. Rice 2, 15-34. doi: 10.1007/s12284-008-9016-5
CrossRef Full Text | Google Scholar
Sabatini, S., Heidstra, R., Wildwater, M., and Scheres, B. (2003). SCARECROW är involverad i positioneringen av stamcellsnischen i Arabidopsis rotmeristem. Genes Dev. 17, 354-358. doi: 10.1101/gad.252503
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, C. A., Rasband, W. S. och Eliceiri, K. W. (2012). NIH Image to ImageJ: 25 år av bildanalys. Nat. Methods 9, 671-675. doi: 10.1038/nmeth.2089
PubMed Abstract | CrossRef Full Text | Google Scholar
Sugimoto, K., Jiao, Y. och Meyerowitz, E. M. (2010). Arabidopsis regenerering från flera vävnader sker via en rotutvecklingsväg. Dev. Cell 18, 463-471. doi: 10.1016/j.devcel.2010.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Ten Hove, C. A., Willemsen, V., de Vries, W. J., Van Dijken, A., Scheres, B. och Heidstra, R. (2010). SCHIZORIZA kodar för en kärnfaktor som reglerar asymmetrin i stamcellsdelningarna i Arabidopsis rot. Curr. Biol. 20, 452-457. doi: 10.1016/j.cub.2010.01.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., and Gallagher, K. L. (2014). Rörelsen av den icke-cellautonoma transkriptionsfaktorn SHORT-ROOT är beroende av endomembransystemet. Plant J. 80, 396-409. doi: 10.1111/tpj.12640
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, C., Zhang, X., Li, J., Bao, M., Ni, D. och Seago, J. L. (2014). Anatomi och histokemi hos rötter och skott hos vildris (Zizania latifolia Griseb.). J. Bot. 2014, 9. doi: 10.1155/2014/181727
CrossRef Full Text | Google Scholar