Introduktion
Hepatit B-virus (HBV)-infektion är den vanligaste orsaken till levercirros och hepatocellulärt karcinom i större delen av Asien.1,2 Patogenesen för kronisk hepatit medieras av interaktionen mellan värdens immunreaktion och hepatocyterna som presenterar HBV-antigen.3,4 Tidigare studier har visat att hepatocyternas uttryck av HBV-antigen har ett viktigt samband med den kroniska leversjukdomens stadium och aktivitet. I immuntoleransfasen finns hepatit B-kärnantigen (HBcAg) främst i kärnan och korrelerar med HBV-replikation, medan det i den efterföljande immuntoleransfasen sker en intrahepatisk förskjutning av HBcAg från kärnan till cytoplasman, vilket är förknippat med den histologiska aktiviteten vid kronisk hepatit5,6 . Vid intrahepatiskt uttryck av HBsAg (hepatit B ytantigen) har tre mönster rapporterats – homogen typ, typ I ground glass hepatocyte (GGH) och typ II GGH. Homogena mönster i grupperade, diskreta eller svaga presentationer har observerats hos patienter med hög viremi eller aktiv hepatit. Typ I GGH är typiskt utspridda enstaka i leverlober med inklusionsliknande tätt homogent uttryck, medan typ II GGH uttrycker ytantigen i periferin av hepatocyter, som grupperar sig i grupper, och är i allmänhet närvarande under den låga replikationsfasen och blir prevalenta från aktiv hepatit till levercirros och hepatocellulärt karcinom.7-10 Därför är både intrahepatiska HBcAg- och HBsAg-uttryck nära kopplade till det naturliga infektionsförloppet och HBV-replikationen.
Av de olika faserna av kronisk hepatit B förekommer immunkontrollfasen eller benämnd HBeAg-positiv kronisk hepatit B ofta i yngre populationer, uppvisar mindre allvarlig histologisk verksamhet och hyser färre frekvenser av precore A1896-mutationer och T1762/A1764-mutationer i basal core-promotor (BCP) än HBeAg-negativ kronisk hepatit B.11-14 Förloppet av kronisk hepatit B är dynamiskt och är ett resultat av interaktionen mellan viral replikation och värdens immunsystem. Följaktligen observeras ofta olika kliniska drag eller histologiska aktiviteter hos HBeAg-positiva patienter. Till exempel uppvisar 34-55 % av patienterna överbryggande fibros eller cirros i leverhistologin, medan de återstående patienterna uppvisar mild fibros.15,16 HBsAg-ackumulering i hepatocyter har visat sig vara associerad med specifika virusmutationer och relaterad till sjukdomsaktivitet.8,9 Det är intressant att undersöka egenskaperna hos det intrahepatiska HBsAg-uttrycket hos patienter med olika allvarlighetsgrad i leverhistologin.
Virala mutanter utvecklas vanligen under trycket från värdets immunförsvar. Bland naturligt förekommande HBV-mutanter blev BCP T1762/A1764-mutationerna vanliga i samband med sjukdomsprogression och har ofta visat sig vara förknippade med avancerad leversjukdom och hepatocellulärt karcinom.17,18 Mönstren för det intrahepatiska HBsAg-uttrycket förändrades också under det naturliga förloppet av kronisk hepatit B. Sambandet mellan BCP T1762/A1764-mutationer och det intrahepatiska HBsAg-uttrycket är fortfarande okänt och måste undersökas.
Syftet med denna studie var därför att utvärdera egenskaperna hos det intrahepatiska HBsAg-uttrycket och analysera sambandet med leverhistologi, virala replikationsmarkörer och HBV-mutanter vid HBeAg-positiv kronisk hepatit B.
Material och metoderPatienter
Totalt 181 behandlingsnaiva hepatit B e antigen (HBeAg)-positiva patienter som uppfyllde inklusionskriterierna rekryterades retrospektivt i denna studie. Inklusionskriterierna var en ålder över 18 år och mindre än 70 år, positivt serum HBsAg i mer än 6 månader och serum HBV DNA-nivå ≥ 100 000 kopior/mL, onormal serum alaninaminotransferasnivå, ingen annan förklarlig etiologi av kronisk hepatit, inklusive alkohol, autoimmun hepatit eller markörer för hepatit C-virus, hepatit D-virus eller infektion med humant immunbristvirus, samt avsaknad av en historia av anti-HBV-behandling och ett prov från leverbiopsi tillgängligt för histologisk utvärdering. Serum och leverbiopsi från alla patienter togs före antivirala behandlingar, och proverna förvarades vid -70 oC fram till testning. Denna studie godkändes av Institutional Review Board of National Cheng Kung University Hospital (nr: ER-99-398). Informerat samtycke inhämtades i enlighet med Helsingforsdeklarationen.
HBV-virologiska tester
HBV-genotypning utfördes med multiplex-polymeraskedjereaktion, som beskrivits på annat håll.19 HBV-DNA-nivån i serum mättes med hjälp av COBAS Amplicor HBV Monitor-testet (COBAS-AM-assay, Roche Diagnostics, Branchburg, NJ). HBsAg-nivån i serum kvantifierades med Abbott Architect HB-sAg QT (Abbott Diagnostics, Rungis, Frankrike) med ett dynamiskt intervall på 0,05-250,0 IU/mL. Prover med HBsAg-nivåer > 250 IU/mL testades på nytt i spädningar på 1:20 och 1:1000.
Polymeraskedjereaktion och sekvensering av precore- och BCP-regioner
HBV-DNA extraherades från 50 μL serum med hjälp av Blood and Tissue Genomic Mini Kit (VIOGENE, Taipei, Taiwan). PCR i första omgången utfördes under följande förhållanden: 96 oC i 2 minuter, 94 oC i 1 minut, 54 oC i 1 minut och 72 oC i 2 minuter med primers 5′-ACCTCTCTGCACGTAGCATGG (framåt) och 3′-GGATTAAAGACACAGGTACAGTACAGTAGAAG (bakåt). Andra omgången PCR utfördes under samma förhållanden med primers 5′-ATGTCTCAACGACACCGACCTTGA (framåt) och 3′-TTCCCACCTTATGAGAGTCCAAG (bakåt). De renade PCR-produkterna sekvenserades sedan direkt med hjälp av en automatiserad DNA-sekvensator ABI 310 och ABI PRISM Big Dye Terminator Cycle Sequencing Ready Reaction Kit (Applied Biosystems) med den framåtriktade primer som användes under den andra PCR-omgången.
Histologi i levern
Histologin i levern utvärderades av en enda patolog som var omedveten om bakgrunden hos patienterna. Nekroinflammation och fibros utvärderades utifrån Knodells nekroinflammationsgrad (från 0 till 18)20 respektive Ishaks fibrosstadium (från 0 till 6)21.
Immunohistokemisk färgning utfördes enligt beskrivningen på annat håll22. Kortfattat: deparaffiniserade 5 μm tjocka sektioner inkuberades med monoklonala mus-anti-HBsAg (klon 3E7, Dako Corp., Carpinteria, USA) och anti-HBcAg (Novocastra Laboratories, Newcastle, Storbritannien) över natten vid 4 °C. Den optimala utspädningen av anti-HBsAg eller anti-HBcAg bestämdes med levervävnad från HBV-bärare som positiv kontroll. StrAviGen Super Sensitive MultiLink Kit (BioGenex) användes för att detektera det resulterande immunkomplexet. Peroxidasaktiviteten visualiserades med hjälp av ett aminoetylkarbazol-substratkit (Zymed Laboratory, Inc, San Francisco, CA). Slutligen kontrafärgades sektionerna med hematoxylin. Som en negativ kontroll ersattes den primära antikroppen med icke-immunt musimmunoglobulin i inkuberingen. Mönster av HBcAg-uttryck i kärnan, cytoplasman eller båda registrerades. Mönster för HBsAg-uttryck klassificerades som homogena, typ I GGH, typ II GGH.22 Homogent färgade hepatocyter identifierades som hepatocyter med måttlig till stark homogen cytoplasmafärgning; typ I GGH identifierades som hepatocyter med tät globulär eller ”inklusionsliknande” färgning, och typ II GGH identifierades som hepatocyter med färgning av ytantigenet vid cellmarginaler eller periferi.6,22 Typ I GGH:er sprider sig enstaka eller grupperar sig i leverloberna medan typ II GGH:er konsekvent grupperar sig i noduli. Uttrycksnivåerna av HBcAg och HBsAg poängsattes semikvantitativt enligt andelen immunmärkta celler, på en skala från 0 till 4+, vilket motsvarar positivitet i 0, 1-10, 11-25, 25-50 % och mer än 50 % av de undersökta hepatocyterna.
Statistiska analyser
Data uttrycktes som medelvärde ± standardavvikelse. Kontinuerliga variabler jämfördes med Mann-Whitney U-test eller Kruskal-Wallis ANOVA för univariat analys. Kategoriska variabler analyserades med hjälp av χ2-test eller Fishers exakta test. Oberoende faktorer som var förknippade med nivåer av intrahepatisk HBsAg-uttryck utfördes med hjälp av multivariat logistisk regressionsanalys. Datahantering och statistiska analyser utfördes med hjälp av SPSS-programvaran för Windows, version 17.0 (SPSS Inc., Chicago, IL).
ResultatKarakteristik av de inskrivna patienterna
Tabell 1 listar de demografiska egenskaperna hos de 181 inskrivna patienterna. De flesta av patienterna var män (69,1 %) och 63,0 % av dem uppvisade HBV-genotyp C. Precore A1896-mutationen upptäcktes hos 20 patienter (11,0 %) och BCP T1762/A1764-mutationerna upptäcktes hos 38 patienter (21,0 %). Av de 181 patienterna upptäcktes positiv HB-sAg-färgning hos 105 patienter (58,0 %). Patienter med HBsAg-färgning uppvisade signifikant högre serum HBsAg (P
Kliniska, virologiska och histologiska egenskaper hos de 181 patienterna.
| Karakteristika | Värde | |||
|---|---|---|---|---|
| HBsAg-uttryck | P-värde | |||
| Alla patienter (n = 181) | Negativa (n = 76) | Positiva (n = 105) | ||
| Ålder (år) ± SD | 36.4 ± 10.5 | 34.2 ± 9.2 | 38.0 ± 11.2 | 0.009 |
| Genus (man/kvinna) | 125/56 | 50/26 | 75/30 | 0.418 |
| Medel AST-nivå (U/L) ± SD | 59,7 ± 51,2 | 58,7 ± 42,5 | 60,5 ± 56.8 | 0.634 |
| Medelvärdet av ALT-nivån (U/L) ± SD | 116.3 ± 124.2 | 120.2 ± 100.8 | 113.5 ± 139.1 | 0,282 |
| HBV-genotyp (B/C) | 114/67 | 66/10 | 48/57 | |
| Precore: G1896/A1896 | 20/161 | 13/63 | 7/98 | 0.027 |
| BCP:* mutant/vilda | 38/143 | 12/64 | 26/79 | 0.144 |
| HBV-DNA (log kopior/mL) | 8.4 ± 1.1 | 4,0 ± 0,7 | 4,3 ± 0,7 | |
| HBsAg-nivå ((log IU/mL) | 4,2 ± 0.7 | 8,1 ± 1,0 | 8,6 ± 1,1 | 0,003 |
| Medelvärde för Knodell nekroinflammation ± SD | 5.0 ± 3,0 | 5,3 ± 2,8 | 4,7 ± 3,0 | 0,128 |
| Medelvärde Ishak fibrosstadium ± SD | 1,8 ± 1,6 | 1,7 ± 1,2 | 1,9 ± 1,7 | 0.703 |
Mutant, T1762 och A1764; vild, A1762 och T1764. χ2-test användes för variablerna kön, HBV-genotyp, precore- och basal core-promotormutationer, medan Mann-Whitney U-test användes för övriga variabler. AST: aspartataminotransferas. ALT: alaninaminotransferas. BCP: basal core promoter. HBV: hepatit B-virus.
Distributionsmönster för HBsAg-uttryck
Med avseende på de 105 patienter som uppvisade HBsAg-uttryck påvisades ett homogent mönster (figur 1A) hos 34 (32.4 %) patienter, typ I GGH (figur 1B) upptäcktes hos 50 (47,6 %), typ II GGH (figur 1C) hos sju (6,7 %) och ett blandat mönster hos 14 (13,3 %). Som framgår av tabell 2 observerades en högre prevalens av BCP T1762/A1764-mutationer i typ II GGH (P = 0,001) jämfört med andra mönster. Det fanns ett ömsesidigt förhållande mellan HBsAg-uttryck och virala replikationsmarkörer i serum. I figur 1D visas att patienter med typ II GGH-uttryck hade lägre HBV-DNA-nivåer och HBsAg-titrar, men högre intrahepatiska HBsAg-uttrycksnivåer (figur 1D). Dessutom uppvisade leverhistologi som visade typ II GGH betydligt allvarligare levernekroinflammation och fibrosverksamhet, och en högre nivå av intrahepatisk HBsAg-uttryck (figur 1E).
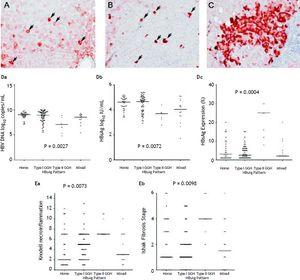
Hållningsmönster för HBsAg. A. Några måttligt till starkt homogent cytoplasmafärgade HBsAg-färgade hepatocyter (pilar) i en bakgrund av svagt färgade hepatocyter. Kärnan i varje homogent färgad hepatocyt var belägen i mitten av cellen. B. Typ I ground glass hepatocyter (GGH) med tät globulär eller ”inklusionsliknande” HBsAg-färgning (pilar) var utspridda i leverparenkymet. C. Ett kluster av typ II GGH:er visade HBsAg-färgning vid cellkanten eller periferin. Korrelationer mellan HBsAg-uttrycksmönster och serum HBV DNA-nivå (Da), serum HBsAg-nivå (Db) och intrahepatisk HBsAg-uttrycksnivå (Dc). Sambandet mellan HBsAg-uttrycksmönster och Knodell nekroinflammationsgrad (Ea) och Ishake fibrosstadium (Eb). Jämförelser mellan grupper analyserades med Kruskal-Wallis ANOVA.
Demografiska egenskaper efter fördelningsmönster f HBsAg-uttryck.
| HBsAg-mönster (n = 105) | ||||||
|---|---|---|---|---|---|---|
| Blandat (n = 14) | Homogen | Typ I GGH | Typ II GGH | P-värde | ||
| (n = 34) | (n = 50) | (n = 7) | ||||
| Ålder (år) ± SD | 36.3 ± 9.2 | 36.3 ± 10.0 | 39.2 ± 12.7 | 40.0 ± 7.9 | 0.104 | |
| Genus (man/kvinna) | 11/3 | 26/11 | 35/15 | 6/1 | 0.720 | |
| Medel AST-nivå (U/L) ± SD | 64,9 ± 56,5 | 61,1 ± 38,6 | 49,9 ± 28,3 | 122.4 ± 168,7 | 0,474 | |
| Medelvärdet av ALT-nivån (U/L) ± SD | 116,7 ± 112,4 | 114,6 ± 91,1 | 91,5 ± 63,8 | 259,1 ± 447.6 | 0,651 | |
| HBV-genotyp (B/C) | 10/4 | 15/19 | 22/28 | 1/6 | 0,085 | |
| Precore: G1896/A1896 | 0/14 | 3/31 | 4/46 | 0/7 | 0.594 | |
| BCP:* mutant/wild | 4/10 | 4/30 | 12/38 | 6/1 | 0.001 | |
| HBV DNA (log kopior/mL) | 3,9 ± 1,0 | 4.5 ± 0,5 | 4,4 ± 0,7 | 3,6 ± 0,5 | 0,001 | |
| HBsAg-nivå ((log IU/mL) | 8,2 ± 1.1 | 8,9 ± 0,7 | 8,7 ± 1,1 | 6,9 ± 1,5 | ||
| Knodell nekroinflammation grad ± SD | 4.2 ± 2.9 | 4.2 ± 3.3 | 4.7 ± 2.7 | 8.6 ± 2.0 | 0.003 | |
| Ishak fibrosstadium ± SD | 1,9 ± 1,9 | 1,9 ± 1,9 | 1,5 ± 1,3 | 4,1 ± 1,5 | 0.007 |
Mutant, T1762 och A1764; vild, A1762 och T1764. χ2-test användes för variablerna kön, HBV-genotyp, precore- och basal core-promotormutationer, medan Mann-Whitney U-test användes för övriga variabler. AST: aspartataminotransferas. ALT: alaninaminotransferas. BCP: basal core promoter. HBV: hepatit B-virus.
HBsAg-uttrycksnivå
Figur 2A till 2D visar illustrationen av semikvantitativ mätning av HBsAg-uttryck. Det fanns ingen patient som hade skala 4+ av HBsAg-uttryck i denna studie. Ett ömsesidigt förhållande mellan viral replikation och leverhistologi observerades. Patienter med HBsAg-uttryck i skala 2+/3+ hade lägre HBsAg-titer och HBV-DNA-nivåer, men betydligt allvarligare nekroinflammationsgrad och fibrosstadium än patienter med HBsAg-uttryck i skala 1+ och negativ HBsAg-färgning (figur 2E). De patienter som uppvisade Knodell nekroinflammationsgrad ≥ 5 poäng eller Ishake fibrosstadium ≥ 1 hade signifikant högre andel HBsAg-uttryck (figur 3).
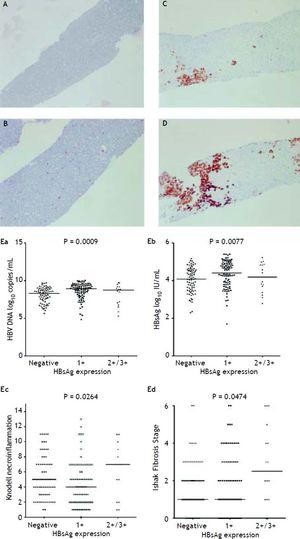
HBsAg-uttryck mätt semikvantitativt enligt andelen immunmärkta celler, på en skala från 0 till 3+, motsvarande positivitet i (A) 0 % (0), (B) 1-10 % (C) 11-25 % (2+) och (D) 25-50 % (3+) av undersökta hepatocyter. Korrelationer mellan HBsAg-uttrycksnivån och serum HBV-DNA (Ea) och HBsAg-nivåer (Eb) samt Knodell nekroinflammationsgrad (Ec) och Ishak fibrosstadium (Ed). Jämförelser mellan grupper analyserades med Kruskal-Wallis ANOVA.

Korrelation mellan uttrycket av intrahepatisk HBsAg och Knodell nekroinflammationsgrad (A) och Ishak fibrosstadium (B). Jämförelser mellan grupper analyserades med Mann-Whitney U-test.
Kliniska egenskaper hos HBsAg-uttrycket
För det första undersökte vi sambandet mellan virusfaktorer och HBcAg/HBsAg-uttryck. HBsAg-uttrycket, inte HBcAg-uttrycket, uppvisade en signifikant lägre nivå i närvaro av precore-mutation (P = 0,001). Patienter med genotyp C uppvisade ett högre leverfibrosstadium (P = 0,004). Hos patienter med BCP T1762/A1764-mutationer fanns det en signifikant högre nekroinflammationsgrad och fibrosstadium samt lägre HBcAg-uttryck antingen i cytoplasma eller i kärnan. Alla dessa observationer tyder på en aktiv leverskada. Dessutom uppvisade patienter med BCP T1762/A1764-mutationer högre intrahepatiskt HBsAg-uttryck (9,3 ± 8,0 % jämfört med 4,3 ± 5,0 %, P = 0,008) (tabell 3). Vidare undersökte vi faktorer som kan associeras med nivåerna av HB-sAg-uttryck. I tabell 4 fanns det 16 patienter som uppvisade 2+/3+ skalor av HBsAg-uttryck och 1+ skala i det av 89 patienter. En univariat analys visade att 2+/3+ skalor av HBsAg-uttryck var associerade med BCP T1762/A1764-mutationer och allvarligare levernekroinflammation och fibros. En multivariat regressionsanalys visade att BCP T1762/A1764-mutationer var den oberoende faktor som var associerad med 2+/3+ skalor av intrahepatisk HBsAg-uttryck.
Kliniska, virologiska och histologiska egenskaper hos patienter med eller utan virala mutanter.
| Precore-mutation | P-värde | BCP-mutationer | P-värde | |||
|---|---|---|---|---|---|---|
| Nej (n = 98) | Ja (n = 7) | Nej (n = 79) | Ja (n = 26) | |||
| Ålder (år) ± SD | 37.8 ±11.0 | 40.0 ± 13.7 | 0.541 | 36.0 ± 10.6 | 43.8 ±11.1 | 0.005 |
| Genus (man/kvinna) | 70/28 | 5/2 | 1.000 | 54/25 | 21/5 | 0.318 |
| Medel AST-nivå (U/L) ± SD | 60,0 ± 58,3 | 71,3 ± 30,5 | 0,072 | 51,5 ± 32,1 | 87,3 ± 95.6 | 0,007 |
| Medelvärdet av ALT-nivån (U/L) ±SD | 112,2 ± 143,6 | 131,6 ± 39,1 | 0,031 | 98,2 ± 77,9 | 160,0 ± 242.0 | 0,080 |
| HBV-genotyp (B/C) | 45/53 | 3/4 | 1,000 | 44/35 | 4/22 | |
| Precore: G1896/A1896 | 6/73 | 1/25 | 0,678 | |||
| BCP:* mutant/vilda | 25/73 | 1/6 | 0.678 | |||
| HBV DNA (log kopior/mL) | 3,9 ± 1,0 | 4,5 ± 0.5 | 0,959 | 4,5 ± 0,6 | 3,7 ± 0,6 | |
| HBsAg-nivå ((log IU/mL) | 8.2 ± 1,1 | 8,9 ± 0,7 | 0,892 | 8,8 ± 0,9 | 7,7 ± 1,4 | |
| Knodellnekroinflammation grad ± SD | 4,6 ± 3,0 | 6.1 ± 3,1 | 0,142 | 3,9 ± 2,7 | 7,2 ± 2,7 | |
| Ishak-fibrosstadium ± SD | 1,8 ± 1,8 | 2,1 ± 0,9 | 0.286 | 1,3 ± 1,4 | 3,4 ± 1,6 | |
| HBcAg cytoplasmauttryck (%) | 53,6 ± 25,8 | 44,3 ± 30,5 | 0,402 | 56,3 ± 25.4 | 42.7 ± 25.8 | 0.018 |
| HBcAg kärnuttryck (%) | 13.5 ± 17.3 | 17.6 ± 31.6 | 0.800 | 17.6 ± 20.0 | 2.3 ±4.1 | |
| HBsAg-uttryck (%) | 5,8 ± 6,5 | 2,4 ± 1,5 | 0,274 | 4,3 ± 5,0 | 9,3 ± 8,0 | 0.003 |
Mutant, T1762 och A1764; vild, A1762 och T1764. χ2-test användes för variablerna kön, HBV-genotyp, precore- och basal core-promotormutationer, medan Mann-Whitney U-test användes för övriga variabler. AST: aspartataminotransferas. ALT: alaninaminotransferas. BCP: basal core promoter. HBV: hepatit B-virus.
Samband mellan demografiska egenskaper och grader av HBsAg-uttryck.
| Univariat | Multivariat | |||||
|---|---|---|---|---|---|---|
| HBsAg uttryck, skala | 1+ (n = 89) | 2+/3+ (n = 16) | P-värde | Oddskvot (95 % CI) | P-värde | |
| Ålder | 38.2 ±11.2 | 36.6 ±11.1 | 0.608 | 0.963 (0.903-1.026) | 0.242 | |
| Kön (man/kvinna) | 63/26 | 12/4 | 1.000 | |||
| AST-nivå (U/L) | 55,0 ± 37,7 | 90,4 ± 113,2 | 0,234 | 1,026 (0,991∼1.063) | 0.142 | |
| ALT-nivå (U/L) | 103.3 ± 84.4 | 170.1 ± 297.2 | 0.386 | 0.991 (0.978∼1.005) | 0.216 | |
| HBV-genotyp (B/C) | 42/47 | 6/10 | 0.589 | 0.994 (0.234∼4.231) | 0.994 | |
| Precore A1896-mutation (+/-) | 7/82 | 0/16 | 0.592 | 0.000 (0.000∼) | 0.999 | |
| BCP:*mutant/Wild | 17/72 | 9/7 | 0.003 | 6.356 (1.204∼33.356) | 0.029 | |
| HBsAg-nivå (log10IU/mL) | 4,3 ± 0,7 | 4,2 ± 0,8 | 0,180 | 2,096 (0,598∼7,349) | 0.247 | |
| Serum HBV DNA (log10 kopior/mL) | 8,6 ± 1,1 | 8,1 ± 1,4 | 0,135 | 0,731 (0,386∼1,383) | 0.335 | |
| Knodell nekroinflammationsgradering | 4,4 ± 2,9 | 6,3 ± 3,3 | 0,027 | |||
| Ishak fibrosstadium | 1.7 ± 1,6 | 2,9 ± 2,1 | 0,041 | |||
| HBcAg cytoplasmauttryck (%) | 53.1 ± 25,8 | 52,3 ± 28,5 | 0,915 | |||
| HBcAg kärnuttryck (%) | 14,4 ± 18,3 | 10.1 ± 19,3 | 0,389 | |||
Mutant, T1762 och A1764; vild, A1762 och T1764. Univariatanalys: χ2-test användes för variablerna kön, HBV-genotyp, precore- och basal core-promotormutationer, medan Mann-Whitney U-test användes för övriga variabler. Multivariat analys: Logistisk regressionsanalys uttryckt som Odds ratio med 95 % konfidensintervall och P-värden. AST: aspartataminotransferas. ALT: Alaninaminotransferas. BCP: basal core promoter. HBV: hepatit B-virus.
Diskussioner
Intrahepatiskt HBsAg-uttryck är förknippat med olika replikationsstadier och sjukdomsutveckling under det naturliga förloppet av kronisk hepatit B.7,10,23. Typ I GGH förekommer främst i aktivt hepatitstadium medan typ II GGH främst förekommer i inaktivt eller cirrosstadium.8 I den här studien visade vi att typ II GGH uppvisade ett samband med allvarligare leverhistologi, tillsammans med betydligt lägre serum HBV DNA-nivåer och HBsAg-titrar, och relativt högre nivåer av intrahepatiskt HBsAg-uttryck. Detta ömsesidiga förhållande mellan leverhistologi och HBV-replikation tyder på att förekomsten av typ II GGH kan vara en markör för avancerad leversjukdom under sjukdomsutvecklingen vid HBeAg-positiv kronisk hepatit B. Mönster för HB-sAg-uttryck har rapporterats vara relaterade till olika virusmutationer som påverkar regleringen av HBV-replikation och defekt i utsöndringen av ytantigen från hepatocyter9,24 . Typ II GGH innehöll konsekvent Pre-S2-deletionsmutationer som minskade syntesen av medelytproteiner och sedan resulterade i ackumulering av stora ytproteiner i hepatocyter och defekt i HBsAg-sekretionen.25 I den här studien utförde vi korrelation av serum-HBsAg och HBV-DNA mellan patienter med eller utan typ II GGH. Måttlig korrelation mellan de två HBV-replikeringsindikatorerna uppvisades hos patienter utan typ II GGH (r = 0,686, P 26,27 Pre-S-deletion skulle kunna leda till ER-stress och aktivera stressrelaterad signaltransduktion. Oxidativ skada på hepatocyt-DNA och sedan stimulerade DNA-reparationsmekanismer kan resultera i genomisk instabilitet som förvärrar leverskadan och är predisponerad för karcinogenes.28
Förutom mönstren för HBsAg-uttryck fann vi att högre uttrycksnivåer åtföljdes av allvarligare leverhistologiska aktiviteter och högre frekvens av BCP T1762/A1764-mutationer. BCP T1762/A1764-mutationer är starkt förknippade med allvarliga leverhistologiska aktiviteter och levercancer.29,30 Såvitt vi vet finns det en stark koppling mellan genotyp C och förekomsten av BCP T1762/ A1764-mutationer.30 I den här studien verkade genotyp C inte spela någon roll för HBsAg-uttrycksnivån. Däremot visade BCP T1762/A1764-mutationer ett starkt samband med HBsAg-uttrycket. När det gäller virusmutationer kan BCP T1762/A1764-mutationer utgöra grunden för andra HBV-mutationer, inklusive pre-S-deletion och komplexa mutanter som ofta påträffas i närvaro av BCP T1762/A1764-mutationer. Komplexa HBV-mutanter uppvisade partiella eller fullständiga defekter i uttryck och sekretion av e, core och ytproteiner.31 Den minskade sekretionen av hepatit B-ytanantigen korrelerade med avvikande lokalisering av ytproteiner i ER och resulterade i ett högt uttryck av HBsAg. Dessutom anses BCP T1762/A1764-mutationen vara en konsekvens av viral fitness på grund av selektionstrycket från värdens immunövervakning. På samma sätt sammanfaller pre-S2-mutationer, som finns i typ II GGH, med de humana leukocytantigenbegränsade T- och B-cellsepitopen.32 Det finns vanligtvis ingen cellnekros eller T-lymfocytinfiltration runt typ II GGH, vilket tyder på att HBV med uppkomsten av pre-S2-deletionsmutationen också är en möjligen ny escape-mutant.33 Ackumulationen av ytantigen i hepatocyter skulle dock kunna ske utan att man bär på någon av de kända virusmutationerna i pre-S- eller S-genomerna eller i ytpromotorer.31,34 Därför skulle HBsAg-uttrycket kunna vara en sekvens i samband med eller utan virusmutationer.
Denna studie hade flera potentiella begränsningar. Observationerna i denna studie baserades på en retrospektiv tvärsnittsdesign, men ingen longitudinell uppföljning genomfördes. Uttrycksnivån av HBsAg i hepatocyter och den histologiska svårighetsgraden kan variera mellan olika delar av levern hos en enskild patient; en leverbiopsi i sig kan inte exakt representera någon levervävnad utom biopsikärnan.
Sammanfattningsvis uppvisade patienter som uppvisade GGH-mönster av typ II eller högre nivåer av intrahepatisk HBsAg-uttryck ett ömsesidigt förhållande mellan svårare leverhistologi och lägre HBV-replikationskapacitet. Det starka sambandet mellan intrahepatiskt HBsAg-uttryck och BCP T1762/A1764-mutationer indikerade att HBsAg-uttrycket möjligen kan betraktas som den histologiska manifestationen under HBV:s genomiska evolution under värdens immuntryck.
Abkortningar
- –
BCP: basal core promoter.
- –
GGH: ground glass hepatocyte.
- –
HBcAg: hepatit B core antigen.
- –
HBeAg: hepatit B e antigen.
- –
HBsAg: Hepatit B ytantigen.
- –
HBV: Hepatit B-virus.
Intressekonflikter
T.-T. C. har fått forskningsmedel från Gilead Sciences, Bristol-Myers Squibb Company, Glaxo-SmithKline, Merck Sharp & Dohme (I.A.) Corporation och Pfizer Inc. Det finns inga intressekonflikter för de övriga författarna.