På Exelead arbetar vi med kontraktstillverkning med fokuserad expertis på liposomala och PEGylerade formuleringar för att behandla sällsynta sjukdomar och små eller underförsörjda populationer. Vi specialiserar oss på utveckling och tillverkning av lipidbaserade, parenterala läkemedelsprodukter och vårt team har mer än 20 års erfarenhet av att arbeta med ett brett utbud av prekliniska, kliniska och kommersiella kontraktstillverkningskunder.
Vad är liposomer och hur används de vid läkemedelsleverans?
Liposomer är specialiserade leveranser som tjänar flera roller för att förbättra kapaciteten hos aktiva farmaceutiska ingredienser (API). För det första kan de skydda ett läkemedel från att upptäckas av kroppens immunsystem, genom att efterlikna biologiska membran och ge läkemedlet mer tid att nå sin avsedda destination. För det andra kan de hjälpa till att lösa upp mycket lipofila läkemedelsmolekyler eller modulera den aktiva substansens farmakokinetik och biodistribution – och på så sätt bidra till att minimera biverkningar och förbättra produktens säkerhetsprofil.
Liposomer har en unik vesikulär struktur. Dessa vesiklar består av ett lipiddubbelskikt som bildas i form av en ihålig sfär som omsluter en vattenfas. Alla typer av gods av intresse kan inkapslas i liposomer, antingen i den vattenhaltiga delen (om det är vattenlösligt/hydrofilt) eller i lipiddubbelskiktet (om det är fettlösligt/lipofilt).
Några av de primära lipiderna som används för att tillverka liposomer är fosfolipider och sfingolipider. Dessa två kategorier av lipider är unika när det gäller en huvudgrupp som är vattenälskande/hydrofil och en svansgrupp som är vattenhatande/lipofil. På grund av sin amfifila karaktär samlar sig dessa molekyler spontant för att bilda liposomer och andra unika 3D-strukturer när de tillsätts till vattenlösningar. 3D-strukturernas form eller morfologi beror på en rad olika faktorer, t.ex. lipidsammansättning, temperatur, pH-värde eller närvaron av andra buffertar, salter och sockerarter i vattnet.

Bildkälla: Chem Libre Texts
Hur interagerar ett läkemedel med kroppen och blir tillgängligt för användning när det är formulerat som en liposomal läkemedelsprodukt?
Under de senaste åren har liposomer fått stor uppmärksamhet som en pålitlig klass av läkemedelsleverantörer. Deras självstängda strukturer kan inkapsla flera läkemedel samtidigt och skydda den inneslutna lasten från hydrolys och nedbrytning. Dessutom kan riktade proteiner och ytfunktionella ligander på det yttre skalet av lipiddubbelskiktet tillföra ny funktionalitet som gör det möjligt för liposomer att komma in i cellerna, antingen via antikroppar eller receptorinriktade ligander. Dessa ligander fäster vid cellreceptorer som är överuttryckta i vissa sjuka celler, vilket gör det möjligt för läkemedlet att tränga in genom cellmembranet.
”Liposomer skyddar laddade läkemedelsmolekyler från extern nedbrytning, och deras likhet med biologiska membran ger unika möjligheter att leverera läkemedelsmolekyler till celler eller subcellulära avdelningar …. Dessutom kan olika fysikalisk-kemiska egenskaper hos liposomer – inklusive deras storlek, laddning och ytfunktionella ligander – ändras, vilket resulterar i funktionaliteter som gynnar specifika uppgifter för läkemedelsleverans. Dessa fördelar har gjort liposomer till en ledande plattform för läkemedelsleverans med ett brett spektrum av användningsområden i kliniken.”
– Liposomliknande nanostrukturer för läkemedelsleverans | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Typiskt sett tillverkas liposomer som sterila injicerbara produkter för leverans till blodomloppet och läkemedlet släpps ut när lipidhöljet bryts ner – vilket kan ske i extracellulära eller intracellulära miljöer.
Flera olika strategier har använts för att utforma konventionella liposomer med utlösta frisättningsmöjligheter, vilket förbättrar den terapeutiska effekten genom att få liposomerna att frisätta den inkapslade aktiva substansen eller ”lasten” baserat på ett stimulusrespons. Denna frisättning drivs antingen av konventionell nedbrytning av liposomerna eller av aktiva stimuli och miljömässiga signaler, inklusive värmeenergi, pH-gradient och skjuvspänning.1
Formuleringar som är inriktade på frisättning i intracellulära miljöer kan inkludera pH-känsliga lipider som ändrar den liposomala strukturen eller bryts ned i sura utrymmen, vilket gör det möjligt att frisätta det inkapslade läkemedlet. Alternativt inkluderas ibland värmekänsliga eller ljuskänsliga komponenter för att möjliggöra nedbrytning och strukturmodulering på grund av temperaturförändringar eller reaktion på ljus med vissa våglängder.
Liposomliknande läkemedelsbärare kan finnas i många olika varianter som uppvisar ett brett spektrum av biokemiska och biofysiska egenskaper. Även om detta är fördelaktigt och gör det möjligt för dessa lipidbaserade partiklar att anta användbara tillämpningar i hundratals olika miljöer, gör antalet potentiella variationer en rigorös tillverkningskontroll nödvändig.2
Exelead har tillverkat lipidbaserade läkemedel sedan början av 1990-talet, med början med Abelcet. Amfotericin B, den aktiva ingrediensen i Abelcet, hålls inom ett lipidkomplex och smälter selektivt samman med svampmembran för att rikta sig mot sjukdomsceller.
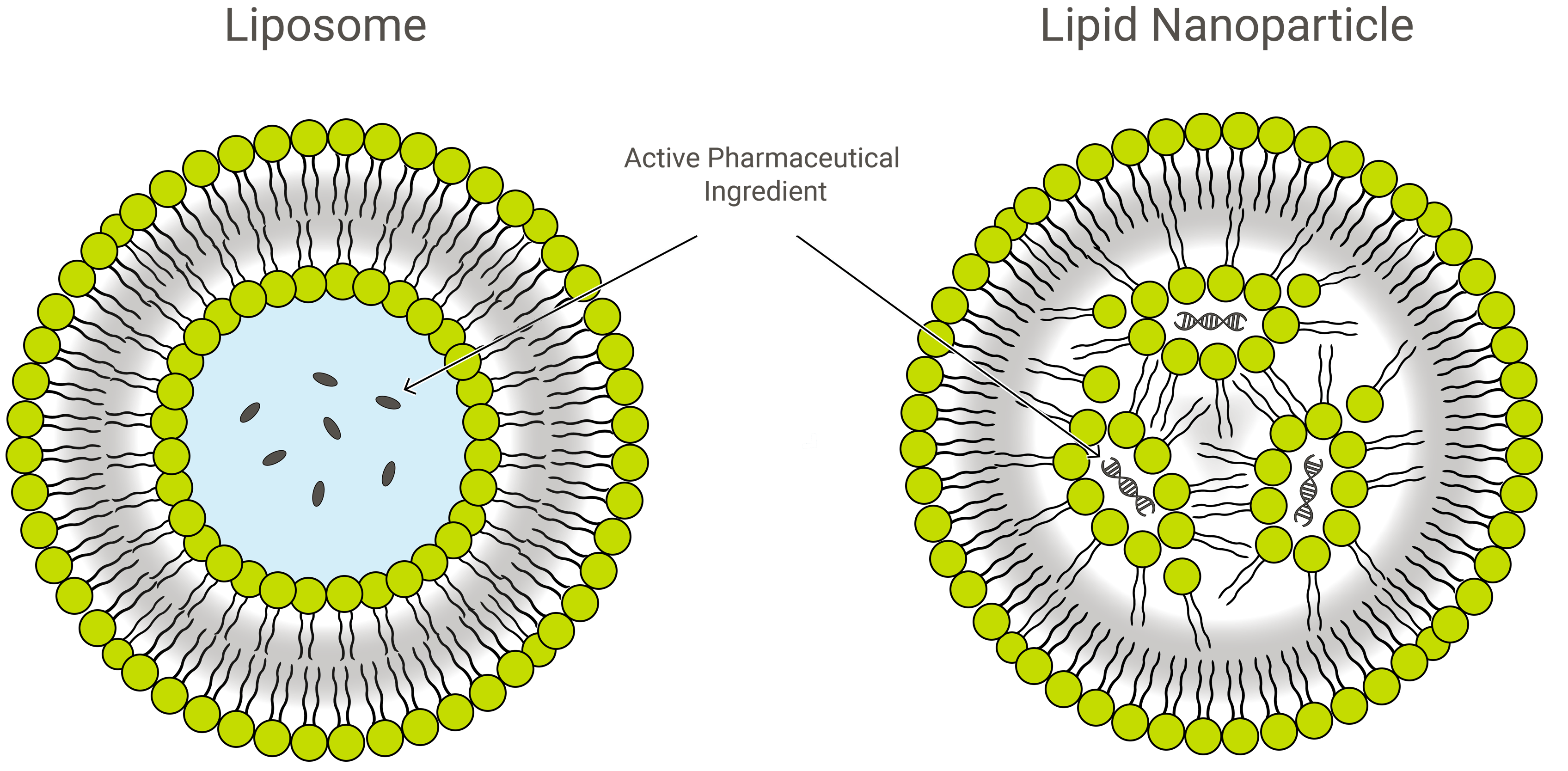
Liposomer vs. lipidnanopartiklar
Liposomer och lipidnanopartiklar (LNP) är likartade till sin utformning, men skiljer sig något åt i sammansättning och funktion. Båda är lipidnanoformuleringar och utmärkta läkemedelstransportörer, som transporterar intressanta varor inom ett skyddande, yttre lager av lipider. När det gäller tillämpningen kan LNP:er dock ta olika former.
LNP är liposomliknande strukturer som är särskilt inriktade på att inkapsla en mängd olika nukleinsyror (RNA och DNA), och som sådana är de det mest populära icke-virala genleveranssystemet. Exelead utvecklar och tillverkar LNPs för inkapsling av olika typer av genetiska nyttolaster, inklusive siRNA, mRNA och saRNA.
Traditionella liposomer omfattar en eller flera ringar av lipidbilager som omger en vattenficka, men inte alla LNPs har ett sammanhängande bilager som skulle kvalificera dem som lipidvesiklar eller liposomer. Vissa LNP antar en micellliknande struktur och kapslar in läkemedelsmolekyler i en icke vattenhaltig kärna.
PEGylering av LNP och liposomliknande strukturer för läkemedelstillförsel
LNP består i första hand av katjoniska lipider (se genterapi nedan) tillsammans med andra lipidingredienser. Dessa inkluderar vanligtvis neutrala fosfolipidmolekyler som tillhör klassen fosfatidylkolin (PC) och steroler, t.ex. kolesterol. En annan vanlig lipidingrediens är en så kallad PEGylerad fosfolipid – en polyetylenglykol (PEG)-polymer som är kovalent knuten till huvudgruppen av en fosfolipid.

PEGylerade fosfolipider används i många lipidbaserade läkemedelsbärare, i första hand för att de ger en så kallad stealth-effekt åt läkemedelsprodukten när den cirkulerar i kroppen. Det mänskliga immunsystemet drivs av att skydda kroppen från alla främmande föremål, och medicinska nanopartiklar är inget undantag. För att underlätta leveransens effektivitet och ge lastmolekylerna mer cirkulationstid för att nå de avsedda sjukdomsställena, tillsätts PEG för att skydda dessa nanopartiklar genom att förhindra att blodplasmaproteiner absorberas i liposomytan, vilket ökar cirkulationstiden i blodomloppet.1
Den andra fördelen med PEGylering är en ökning av stabiliteten för liposomliknande nanostrukturer. Konventionella liposomer, särskilt de som är mindre än 200 nm stora, kan vara instabila i sig själva och tenderar att smälta samman med varandra för att minska ytspänningen. Detta kan leda till förlust av det inkapslade läkemedlet eller ogynnsam blandning av olika vesiklars last. Ett sätt för läkemedelstillverkare att övervinna detta problem är att täcka liposomernas utsida med polymerer som PEG.
Dessa smygutrustade nanopartiklar har resulterat i en ny generation av liposomala formuleringar och flera kliniskt godkända produkter. PEG-licensierade liposomer och LNP:er är för närvarande det nya paradigmet för de flesta cancerterapier.
LNP:er i genterapi
Det effektivaste sättet att leverera genbaserade terapier till mänskliga celler var länge att använda ett virus som hade modifierats för att bära medicinskt gods i stället för skadliga, självreproducerande gener. Denna metod används fortfarande ibland i dag och kallas viral genleverans. Icke-viral genleverans har dock blivit populär under de senaste 20 åren på grund av förbättrade säkerhetsprofiler, lägre frekvens av negativa immunogena reaktioner och enkel tillverkning. En av de främsta drivkrafterna bakom denna rörelse har varit utvecklingen av lipid- och polymerbaserade bärare, av vilka LNPs är de mest populära.
LNPs som används för att leverera gener syntetiseras huvudsakligen med hjälp av katjoniska, eller positivt laddade, lipider som associeras med anjoniska, eller negativt laddade, nukleinsyror. Andra lipidbaserade komponenter kan också tillsättas för att modulera leveranseffektiviteten och den plats där den genetiska lasten frigörs. LNPs ger också mekanisk stabilitet, kontrollerad morfologi och smal storleksfördelning.1
Organiska material, organiska material och hydrogeler har utforskats som kärnor för liposomala nanopartiklar, inkapslade i ett varierande antal lipidskikt som utgör skalet. En av de mest framgångsrika varianterna av dessa hybridnanopartiklar innehåller PLA- eller PGLA-polymerer i ett lipidmonolager. Dessa två kärnbiopolymerer är särskilt användbara vid läkemedelstillförsel eftersom de underlättar kontrollerad läkemedelsfrisättning.1

Nanopartikelformuleringen som visas ovan är en lipid-polymerhybrid med en hydrofob PGLA-kärna och ett hydrofilt lipid-PEG-skal.
Ett expanderande område
”Liposomer har kommit långt för att bli en klass av validerade läkemedelsbärare … Ett ökande antal liposomliknande nanostrukturer är under utveckling, var och en med unika styrkor som lämpar sig för specifika läkemedelsleveransuppgifter. Samtidigt görs snabba framsteg när det gäller att förstå interaktionerna mellan dessa nanostrukturer och biologiska system. En betydande mängd information om deras cirkulationstid, vävnadsackumulering och potentiella toxicitet har erhållits. Det är säkert att liposomliknande nanotransporter kommer att spela en större roll för läkemedelsleverans inom en överskådlig framtid.”
– Liposomliknande nanostrukturer för läkemedelsleverans | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Samtidigt som det pågår ett betydande arbete med att utveckla medicinska medel med kontrollerad frisättning, med nanokompartmentsindelning, är liposomer och LNPs särskilt lovande alternativ. Dessa strukturer ger en unik, naturligt stabil, cellliknande morfologi för nanomediciner och är redo att utvecklas mot mer avancerade terapeutiska strategier. Exelead tar sig an sådana utmaningar, inklusive utvecklingen av nanogeler som innehåller en rad biologiska läkemedel och små molekyler.
Sedan liposomer först föreslogs som ett system för läkemedelstillförsel i slutet av 1960-talet har variationer i struktur och funktionalitet uppstått, vilket har gett värdefulla framsteg när det gäller inriktning på sjukdomar. LNP-läkemedel har dykt upp i hela läkemedelsindustrin som terapier utformade för att leverera cancerbekämpningsmedel, antibiotika, genmedicin, bedövningsmedel och antiinflammatoriska läkemedel.3
”I kliniska tillämpningar har liposomala läkemedel visat sig vara mest användbara för sin förmåga att ”passivt” ackumuleras på platser med ökad kärlpermeabilitet, när deras genomsnittliga diameter är i det ultrafiltrerbara området (<200 nm i diameter), och för sin förmåga att minska biverkningarna av de inkapslade läkemedlen i förhållande till fria läkemedel. Detta har resulterat i en övergripande ökning av det terapeutiska indexet, som mäter effektivitet framför toxicitet.”
– Liposomala system för läkemedelstillförsel: från koncept till kliniska tillämpningar | Allen TM, Cullis PR 3
Användningar inom personlig medicin – en ny era inom terapeutiska strategier
I motsats till de traditionella tillvägagångssätten för sjukdomsbehandling, som bygger på stora läkemedel, tar den personliga medicinen hänsyn till individuella skillnader i livsstil, miljö och biologi – inklusive patientens genetik.
Det här är ytterst tillämpbart för sjukdomar som cancer. Till och med inom en enskild typ av cancer skiljer sig tumörtyperna från en patient till en annan, och genom att förstå vilken genetisk mutation en patient har utvecklat kan läkarna använda mer specifika och exakta behandlingar.4
Med framväxten av personliga genetiska terapier kan läkare och forskare effektivt skräddarsy en aktiv läkemedelsingrediens – ofta RNA eller DNA – för att matcha den specifika sjukdomsprofilen hos en viss patient eller en liten grupp av patienter. Detta tillvägagångssätt för hyperspecifik sjukdomsinriktning ökar effektiviteten och minskar oönskade biverkningar för grupper av liknande patienter.
LNP:er som leveransfordon för oligonukleotider
Då en så stor del av det växande fältet för individanpassad medicin är inriktat på genetiska terapier, har LNP:er blivit särskilt användbara som plattform för läkemedelsleveranser. Vilken oligonukleotid som helst skulle teoretiskt sett kunna inkapslas i en liposom eller LNP, men siRNA är för närvarande den vanligaste lasten i dessa typer av läkemedelsprodukter.
I teorin kan segment av siRNA utformas för att tysta vilken gen som helst, vilket är ett spännande koncept för både läkare och forskare. Tyvärr är det svårt att leverera fritt, oförkapslat RNA till mänskliga celler, eftersom de är stora, instabila i serum och känsliga för nukleasnedbrytning.5
Och även om forskare har gjort försök att stabilisera siRNA i serum genom att lägga till fosforothioatlänkar, krävs det höga doser för att effektivt tysta gener hos människor. LNPs har gett en lösning på detta problem genom att tillhandahålla flexibla och enkla sätt att inkapsla, skydda siRNA-segmenten tills de når sin avsedda destination och underlätta deras leverans till målcellerna.5
”LNPs som innehåller joniserbara katjoniska lipider har ett antal egenskaper som är nödvändiga för systemisk leverans av polynukleinsyror, bland annat små storlekar, serumstabilitet, låga zeta-potentialer på ytan vid fysiologiska pH-värden och katjonisk laddning vid sura pH-värden (t.ex. i endosomer). Genom att dra nytta av ”endogena” målinriktningsprocesser på grund av förening med ApoE efter administrering kan man dessutom uppnå ett mycket effektivt upptag i hepatocyter efter i.v.-administrering, vilket leder till utmärkta möjligheter att stänga av gener.”
– Leveranssystem av lipidnanopartiklar för siRNA-baserade terapier | Wan C, Allen TM, Cullis PR 5
Mindre satsstorlekar
Personaliserade läkemedelsprodukter tillverkas ofta i små satsstorlekar för enstaka patienter eller små populationer och kan ofta resultera i mindre än en liter av produkten. Däremot producerar traditionella tillverkningssatser för vanliga läkemedel ofta tusentals liter läkemedelsprodukt i stor skala. Personlig medicin kräver ett unikt tillvägagångssätt, och varje sats måste tillverkas under stränga cGMP-förhållanden.
I takt med att personlig medicin har blivit ett framträdande fokus inom läkemedelsutvecklingen har många företag inom läkemedelstillverkningsindustrin anpassat sina pipelines för att rymma mindre satser som är avsedda för små patientgrupper utöver traditionell, storskalig läkemedelstillverkning.
På Exelead har man gjort omfattande ansträngningar för att tillgodose dessa terapeutiska produkter i små serier, som ofta kräver dyra API och snabb omloppstid. Patient- eller antigenspecifika läkemedel lämnar inte mycket tid från det ögonblick då oligonukleotiden sekvenseras till det ögonblick då produkten måste formuleras på vår anläggning. Dessa kortsiktiga prognoser, ibland bara sex veckor, innebär utmaningar som vi har kunnat övervinna genom att förfina våra befintliga system och införliva innovativa formuleringstekniker.
Allmänt utbredda tillämpningar
Samtidigt som den personaliserade medicinen har potential att behandla nästan vilken sjukdom som helst, har den nuvarande forskningen främst fokuserat på 1) immunterapier, 2) konventionella terapier förstärkta via farmakogenomik och 3) biomarkörrelaterade cancerbehandlingar. Liposomer och LNPs kan användas som leveransfordon för var och en av dessa kategorier av läkemedelsprodukter, vilket gör dem till en oumbärlig tillgång inom detta nya område för läkemedelsutveckling.

Referensartiklar
- Gao W, Hu C-MJ, Fang RH, Zhang L. Liposome-like Nanostructures for Drug Delivery. Journal of materials chemistry B, Materials for biology and medicine. 2013;1(48):10.1039/C3TB21238F. doi:10.1039/C3TB21238F.
- Kraft JC, Freeling JP, Wang Z, Ho RJY. Nya tendenser inom forskning och klinisk utveckling av system för läkemedelstillförsel genom liposomer och lipidnanopartiklar. Journal of pharmaceutical sciences. 2014;103(1):29-52. doi:10.1002/jps.23773.
- Theresa M. Allen, Pieter R. Cullis. Liposomala system för läkemedelstillförsel: Från koncept till kliniska tillämpningar. Advanced Drug Delivery Reviews. 2013 Jan;65(1):36-48
- Esposito L. What Does Personalized Medicine Really Mean? US News: Health Care. 2018 Jan;
- Wan C, Allen TM, Cullis PR. Leveranssystem av lipidnanopartiklar för siRNA-baserade terapier. Drug Deliv Transl Res. 2014 Feb;4(1):74-83. doi: 10.1007/s13346-013-0161-z.
- Vogenberg FR, Isaacson Barash C, Pursel M. Personalized Medicine: Del 1: Utveckling och utveckling till teranostik. Pharmacy and Therapeutics. 2010;35(10):560-576.