US Pharm. 2012;37(5):HS-2-HS-7.
Smärta är den vanligaste orsaken till att människor söker läkarvård.1En färsk studie uppskattar att smärta drabbar tiotals miljoner amerikaner och kostar USA 635 miljarder dollar årligen på grund av ökad konsumtion av sjukvård och indirekta kostnader för uteblivna arbetsdagar och förlorad produktivitet.2 Behandling av kronisk smärta med läkemedel som opioider är en vanlig strategi, men kronisk smärta kan kvarstå eller förvärras trots aggressiv opioidbehandling. Denna artikel syftar till att belysa fenomenet med opioider som förskrivs för att behandla smärta men som orsakar ny eller paradoxalt nog förvärrad smärta. detta tillstånd kallas opioidinducerad hyperalgesi (OIH). OIH kan mer formellt definieras som ökad nociceptiv sensibilisering orsakad av exponering för opioider.3 OIH skiljer sig tydligt från tolerans, beroende, beroende och sjukdomsutveckling. Den kliniska prevalensen av OIH är okänd.4
Diagnos och presentation
Ett av de största problemen med att korrekt diagnostisera OIH är tillståndets stora likhet med opioidtolerans. Tolerans och OIH delar egenskapen av minskat analgetiskt svar på opioiddosen, och de delar sannolikt många av samma cellulära mekanismer.5Tolerans kan övervinnas genom att öka opioiddosen, medan samma ökning hos en patient med OIH resulterar i förvärrad smärta.4 Dessutom tenderar tolerans att utvecklas långsamt över tid, medan denökade smärta som uppstår till följd av opioidbehandlingen hos OIH-patienten inträffar relativt snabbt. Ofta skiljer sig OIH från tolerans genom att smärtintensiteten är starkare än vad som ursprungligen rapporterades.6
Underbehandlad smärta är en annan möjlighet som bör uteslutas. Omopioidbehandlingen är suboptimal bör en ökning av dosen leda till smärtlindring; om OIH föreligger bör motsatsen gälla. För en korrekt diagnos av OIH måste smärtan försvinna när behandlingen med den felande opioiden avbryts.6 För att komplicera saken ytterligare är hyperalgesi till följd av opioidavvänjning ett väldokumenterat fenomen.7 Därför kommer smärtlindring efter opioidavvänjning vid OIH inte att vara omedelbar och kommer att kräva tålamod. Detta innebär sina egna utmaningar för både kliniker och patient.
OIH tenderar att uppvisa andra distinkta egenskaper (TABELL 1).Smärta i samband med OIH tenderar att vara mer diffus och av lägre kvalitet, och skadliga stimuli tenderar att vara mer smärtsamma än vad som normalt kan förväntas. Vid OIH uppträder smärtan ofta i områden som sträcker sig bortom det område där skadan eller vävnadsskadan uppstått. Smärtan kan kvarstå vid OIH trots att den ursprungliga smärtkällan avlägsnats eller den skadade vävnaden läkt.När opioidbehandlingen fortskrider kan smärtan vid OIH ge en illusion av att bli värre än vad som ursprungligen rapporterades, trots tid, vila och andra åtgärder som normalt skulle möjliggöra en kliniskt relevant mängd läkning.5 Dessutom har allodyni påvisats i ett antal studier av OIH på människor och djur.8

Etiologi
Det finns ett antal teorier om orsaken till OIH. Den teori som har undersökts mest och som för närvarande får mest uppmärksamhet är den neuroexcitatoriska modellen. Man tror att vissa opioider och deras metaboliter agoniserar N-metyl-D-aspartatreceptorn (NMDA). Aktivering av NMDA-receptorn orsakar ett inflöde av kalcium som kraftigt ökar neuronens excitabilitet. NärNMDA -receptorn och motsvarande neuroner är mer aktiva kan de lättare överföra smärtsamma impulser som initieras av cirkulerande substans Por andra skadliga stimuli. Glutamat är den primära endogena agonisten för NDMA-receptorn.9
Stöd för denna teori om pronociception som moduleras av NMDA-receptoraktivering finns studier som visar lindring av OIH efter administrering avNMDA-receptorantagonister. Dessa antagonister binder på ett icke-kompetitivt sätt till fencyklidinplatsen på NMDA-kanalen och blockerar det inflöde av kalcium som skulle inträffa när receptorn binder glutamat eller en annanagonist.10 Djur- och människostudier har visat att försökspersoner med OIH som fick ketamin, en NMDA-receptorantagonist, fick bättre resultat vid kontrollerade smärtstimulanstest. I en studie gavs råttor intratekala morfinininjektioner i flera dagar tills de uppvisade OIH som var känslig för värme. Administrering av dizocilpin, en NMDA-hämmare, var effektivt för att åtminstone delvis upphäva termisk hyperalgesi.5 Andra NMDA-receptorantagonister, t.ex. dextrometorfan, har visat vissa tecken på att lindra hyperalgetiska tillstånd genom hämning av NMDA-receptorn.
Opioider, t.ex. kodein, hydromorfon och morfin, genomgår ett antal biotransformationer som en del av den normala ämnesomsättningsprocessen.Kodein metaboliseras till morfin av enzymet CYP2D6. Morfin metaboliseras till ett antal molekyler, men det metaboliseras främst genom glukuronidering till morfin-3-glukuronid (M3G) och, i mindre utsträckning, morfin-6-glukuronid (M6G) (FIGUR 1) (FIGUR 1).11
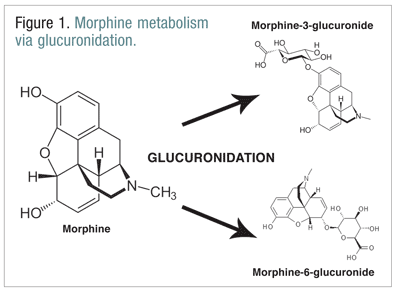
M6G är en terapeutiskt viktig metabolit. Den har mu-receptorbindande affinitet som liknar morfinets och kan ge analgesi, andningsdepression och andra effekter som liknar morfinets. M3G är dock inte en agonist vid mu-receptorn och har liten affinitet för mu-receptorn jämfört med morfin. I motsats till morfin, M6G och andra opioider är M3G en NMDA-agonist. Genom glukuronidering omvandlas M3G ungefär sex gånger snabbare än M6G.12 Andra opioider har involverats i NMDA-agonistverksamhet och paradoxala neuroexcitatoriska effekter.6
Som stöd för teorin att OIH orsakas av aktivitet hos receptorer vid sidan av mu-opioidreceptorn finns det bevis för att OIH inte lindras av administrering av en opioidantagonist (t.ex. naloxon). Hos patienter som upplevde OIH under högdos opioidbehandling orsakade administrering av naloxon en försämring av smärtan.13 Genom att förskjuta opioiden från mu-receptorn hindrade naloxon opioiden från att ge den analgesi som var möjlig genom aktivering av mu-receptorn, samtidigt som hyperalgesin nu förblev oemotsagd.14
Dynorfin kan också vara inblandat i utvecklingen av OIH.15Dynorfin är en endogen opioidpeptid som främst binder till opioidreceptornkappa och, i mindre utsträckning, till mu-opioid- och NMDA-receptorn. Man tror att dynorfins agonism av kappa opioidreceptorn och NMDA-receptorn spelar en roll för pronociceptionen av OIH trots förekomsten av rena mu-receptoragonister. Studier har visat att omvändning av dynorfin kan återställa de analgetiska effekterna av morfin när försökspersoner ges ett dynorfinantiserum. Dessutom är det känt att dynorfinen ökar vid långvarig opioidadministrering. Dynorfin orsakar också frisättning av excitatoriska neuropeptider på olika platser i det centrala nervsystemet.
Behandlingsalternativ
När diagnosen OIH har ställts finns det ett antal behandlingsalternativ från vilka man noggrant kan välja. Förutsatt att den ursprungliga smärtsamma skadan eller vävnadsskadan har försvunnit och att smärtan kvarstår trots och på grund av opioidbehandlingen, är det mest raka tillvägagångssättet att avbryta den felande opioiden. Detta bör ske gradvis för att minimera negativa abstinenser. Det bör noteras att hyperalgesi sannolikt kan förvärras tidigt i utsättningsprocessen.16 Detta innebär en utmanande etisk situation där klinikern kan ha svårt att övertyga patienten om att den medicin som ordinerats för att behandla smärta kan ha orsakat eller förvärrat smärtan och att smärtan kan bli värre innan den till slut försvinner.17
Om legitim smärta kvarstår och det krävs en viss mängd analgesi med opioider, bör man utforska andra strategier än totalt utsättande av opioider. Patienter som upplever OIH kan få lindring genom att minska opioiddosen.4 Det finns rapporter om patienter som finner en acceptabel balans mellan analgesi och lindring av hyperalgesi vid minskning av opioiddosen.
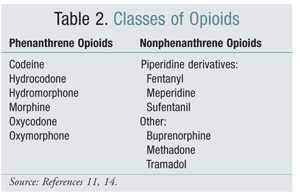
Skifte från en strukturell klass av opioider till en annan har varit ett effektivt alternativ för att mildra OIH i vissa studier. Studier som hittills har visat att OIH är starkare förknippad med opioider från fenantrenklassen (TABELL 2).4 Titrering av fenantrenopioiden och konvertering till en annan opioid kan ge en lösning på OIH. Kodein, hydromorfon, morfin och strukturellt liknande opioider genomgår glukuronidering som en del av sin metabolism. Det är möjligt att undvika en NMDA-receptoraktiverande glukuronidmetabolit genom att byta till en opioid som är strukturellt unik, t.ex. fentanyl. I skrivande stund har OIH inte påvisats i försök med oxymorfon.4
Supplementering av opioidbehandling med en cyklooxygenas 2 (COX-2)-hämmare är en annan strategi som har visst stöd. Genom att minska prostaglandinsyntesen kan COX-2-hämmare minska sensibiliseringen av pronociceptiva neuroner. Icke-steroida antiinflammatoriska läkemedel (NSAID) och COX-2-hämmare tycks ha analgetiska effekter som är oberoende av deras förmåga att undertrycka prostaglandinsyntesen perifert.9 COX-2-hämmare har också visat sig ha förmåga att motverka NMDA-receptorn. Centralt kan NSAID:er antagonisera NMDA-receptorn genom att blockera glutamat, substans P och andra excitatoriska aminosyror. Oberoende av detta kan aktivering av NMDA-receptorn uppreglera COX-2-uttrycket.18
Med tanke på den uppmärksamhet som NMDA-receptorn har fått på grund av sin roll i OIH, verkar antagonisering av denna receptor vara en rimlig behandlingsstrategi. Ketamin har varit föremål för mycket forskning, men dess biverkningar kan vara allvarliga. Ketamin antagoniserar NMDA och ger en anestetisk effekt som skulle främja analgesi, men biverkningarna är vanliga, varierande och allvarliga.19 Dessa effekter omfattar takyarytmi, högt blodtryck, kognitiva försämringar och psykomimetiska reaktioner, inklusive humörförändringar, livliga drömmar, delirium, hallucinationer och sedering. Ketamin är effektivt för att reversera hyperalgesi och förstärka effekterna av opioider hos patienter som får stora doser, men dessbiverkningar hindrar det från att vara ett genomförbart behandlingsalternativ.
Dextrometorfan är en annan NMDA-receptorantagonist som har undersökts för behandling av OIH. En kombinationsprodukt som innehåller en 1:1-blandning av morfin och dextrometorfan har studerats.20Studier har inte kunnat visa att kombinationsbehandling skulle kunna ge bättre analgesi jämfört med enbart morfin. Liknande behandlingsmisslyckanden inträffade i en studie där man använde en 2:1-blandning av samma medel.Studierna har kritiserats för att de hade en otillräcklig mängd dextrometorfan för att på ett adekvat sätt motverka NMDA-receptorn.21Vad som förblir okänt är den dos dextrometorfan som är nödvändig för att antingen förstärka en opioids analgesi eller förhindra OIH som orsakas av NMDAreceptoraktivering.
Metadon är en opioid med unika egenskaper som gör den till ett övertygande alternativ för behandling av smärta hos patienten med OIH. Förutom sina analgetiska effekter genom att binda till mu-opioidreceptorn är metadon en svag NMDA-receptorantagonist.4 Det har rapporterats att tillägget av även en låg dos metadon har varit effektivt för att minska hyperalgesi. I ett fall har tillägget av metadon i lågdos (10 mg två gånger dagligen) förbättrat rapporterna om smärta märkbart, med en minskning av den totala opioiddosen med 40-50 %.22 Byte av den felande opioiden till metadon har varit en populär behandlingsstrategi. Tramadol och meperidin har också en viss NMDA-receptorantagonistisk aktivitet.
En annan behandlingsmetod som har viss potential för behandling av OIH är buprenorfin.23,24 Buprenorfin är en partiell opioidagonist vid mu-receptorn och har också kappa-receptorantagonistisk aktivitet.4Dynorfin, en kappa-receptoragonist, är känt för att öka under behandling med opioider. Aktivering av kappa-receptorn motverkar till stor del de mu-receptormedierade effekterna av opioider.25 Den kliniska nyttan av buprenorfin vid behandling av OIH har ännu inte helt förklarats.
Slutsats: Det återstår mycket arbete innan man kan säga att man har förstått OIH. Den exakta cellulära mekanismen och de signalvägar som är ansvariga för detta fenomen är inte definierade. För att komplicera detta finns det motstridiga rapporter om huruvida specifika komponenter spelar en nyckelroll eller någon roll överhuvudtaget. Huvuddelen av forskningen för att klarlägga OIH:s patofysiologi har skett med hjälp av djurmodellen. Detta har ett visst värde, men informationen från den mänskliga modellen är knapphändig.
En svag förståelse av orsaken till ett tillstånd ger upphov till ett osäkert armamentarium av behandlingsalternativ. Den bästa tillgängliga strategin är att helt upphöra med den problematiska opioiden, men detta är föga användbart för den patient som behöver smärtlindring av opioidtyp.Flera andra behandlingsmetoder har undersökts, men alla skulle gynnas av ytterligare studier. Majoriteten av de studier som gjorts på människor omfattar periskirurgiska patienter, återställda narkotikamissbrukare och experimentella smärtmodeller. Dessa studier är inte utan värde, men dessa populationer speglar inte den kroniska smärtpopulationen. Andra begränsningar av tillgängliga behandlingsalternativ är bland annat bristfälliga resultat, överdriven toxicitet trots måttlig framgång och små studier som ger svaga slutsatser.
I skrivande stund pågår eller planeras ett antal kliniska studier där NMDA-receptorantagonisten memantin används för att behandla OIH.26 Fortfarande finns det motstridiga rapporter om den exakta roll som NMDA-receptorer spelar vid OIH. Ytterligare forskning måste göras för att fastställa vilka nyckelansvariga receptorer och mekanismer som finns i OIH. Om man utökar urvalsstorleken på studierna kommer det att bidra till att stödja de slutsatser som redan har dragits om vilka behandlingsmedel som är ansvariga för OIH och effektiva för att behandla den. Studier som fokuserar på kronisk smärta, snarare än på modeller av akut smärta, kan ge kliniskt relevant information till praktikern.
Chapman och kollegor har tagit upp specifika frågor som måste besvaras innan diagnosen OIH kan ställas och effektiv behandling kan erbjudas.27 Hur förhåller sig opioiddos och opioidduration till OIH? Vid vilken typ av smärta, eller hos vilken typ av patient, är det mer sannolikt att OIH utvecklas? Detta är de frågor som måste styra framtida klinisk forskning.
1. Parselis Kelly J, Cook SF, Kaufman DW, et al. Prevalens och egenskaper hos opioidanvändning i USA:s vuxna befolkning. Pain. 2008;138:507-513.
2. Institute of Medicine. Att lindra smärta i Amerika: A Blueprint for Transforming Prevention, Care, Education, and Research. Washington, DC: The National Academies Press; 2011.
3. Chu LF, Angst MS, Clark D. Opioidinducerad hyperalgesi hos människor: molekylära mekanismer och kliniska överväganden. Clin J Pain. 2008;24:479-496.
4. Lee M, Silverman SM, Hansen H, et al. A comprehensive review of opioid-induced hyperalgesia. Pain Physician. 2011;14:145-161.
5. Mao J. Opioidinducerad onormal smärtkänslighet: konsekvenser för klinisk opioidbehandling. Smärta. 2002;100:213-217.
6. Raffa RB, Pergolizzi JV Jr. Opioidinducerad hyperalgesi: är den kliniskt relevant för behandling av smärtpatienter? Pain Manage Nurs. 2011;1-17.
7. Li X, Clark JD. Hyperalgesia during opioid abstinence: Mediation by glutamate and substance P. Anesth Analg. 2002;95:979-984.
8. Pud D, Cohen D, Lawental E, Eisenberg E. Opioids and abnormal painperception: new evidence from a study of chronic opioid addicts andhealthy subjects. Drug Alcohol Depend. 2006;82:218-223.
9. Malmberg AB, Yaksh TL. Hyperalgesi medierad av spinal glutamat- eller substans P-receptor blockerad av spinal cyklooxygenashämning. Science. 1992;257:1276 -1279.
10. Fisher K, Coderre TJ, Hagen NA. Målinriktning på N-metyl-D-aspartatreceptorn för behandling av kronisk smärta. Prekliniska djurstudier, senaste kliniska erfarenheter och framtida forskningsinriktningar. J Pain Symptom Manage. 2000;20:358-373.
11. Lötsch J. Opioidmetaboliter. J Pain Symptom Manage. 2005;29:S10-S24.
12. Skarke C, Lötsch J. Morphine metabolites: clinical implications. Semin Anesth, Perioperative Med Pain. 2002;21:258-264.
13. Juni A, Klein G, Kest B. Morfinhyperalgesi hos möss har inget samband med opioidaktivitet, analgesi eller tolerans: bevis för flera olika hyperalgesiska system. Brain Res. 2006;1070:35-44.
14. Angst M, Clark JD. Opioidinducerad hyperalgesi: en kvalitativ systematisk översikt. Anesthesiology. 2006;104:570-587.
15. Vanderah TW, Gardell LR, Burgess SE, et al. Dynorphin främjar onormal smärta och spinal opioid antinociceptiv tolerans. J Neurosci. 2000;20:7074-7079.
16. Hooten WM, Mantilla CB, Sandroni P, Townsend CO. Associationsbetween heat pain perception and opioid dose among patients with chronic pain under opioid tapering. Pain Med. 2010;11:1587-1598.
17. Silverman S. Opioidinducerad hyperalgesi: kliniska konsekvenser för smärtläkaren. Pain Physician. 2009;12:679-684.
18. Li SQ, Xing YL, Chen WN, et al. Aktivering av NMDA-receptorn är förknippad med uppreglering av COX-2-uttrycket i det spinala dorsalhornet under nociceptiva insatser hos råttor. Neurochem Res. 2009;34:1451-1463.
19. Okon T. Ketamin: en introduktion för läkaren inom smärt- och palliativmedicin. Pain Physician. 2007;10:493-500.
20. Galer BS, Lee D, Ma T, et al. MorphiDex (morfinsulfat/dextrometorfanhydrobromidkombination) vid behandling av kronisk smärta: tre randomiserade, dubbelblinda, kontrollerade kliniska multicenterstudier visar inte på ökad opioidanalgesi eller minskad tolerans. Pain. 2005;115:284-295.
21. Wiesenfeld-Hallin Z. Kombinerade behandlingar med opioid-NMDA-antagonister: Vilka fördelar erbjuder de för kontroll av smärtsyndrom? Droger. 1998;55;1-4.
22. Vorobeychik Y, Chen L, Bush MC, Mao J. Förbättrad opioidanalgetisk effekt efter minskning av opioiddosen. Pain Med. 2008;9:724-727.
23. Baron MJ, McDonald PW. Signifikant smärtreduktion hos kroniska smärtpatienter efter avgiftning från högdosopioider. J Opioid Manag. 2006;2:277-282.
24. Koppert W, Ihmsen H, Körber N, et al. Different profiles ofbuprenorphine-induced analgesia and antihyperalgesia in a human painmodel. Pain. 2005;118:15-22.
25. Pan ZZ. Mu-opposerande åtgärder av kappa-opioidreceptorn. Trends Pharmacol Sci. 1998;19:94-98.
26. Ballantyne JC, Mao J. Opioidbehandling av kronisk smärta. N Engl J Med. 2003;349:1943-1953.
27. Chapman CR, Lipschitz DL, Angst MS, et al. Opioidfarmakoterapi för kronisk smärta utan cancer i USA: en forskningsriktlinje för att utveckla en evidensbas. J Pain. 2010;11:807-829.