Vätebindningsdefinition
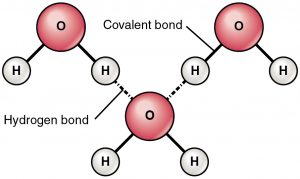
Vätebindning är en attraherande kraft mellan en delvis positivt laddad väteatom och en delvis negativt laddad atom (syre och kväve). Detta är en mycket svag bindning och styrkan hos vätebindningen (5-10 Kcal per bindning) är mycket mindre än styrkan hos en kovalent bindning. Vätebindningar visas vanligen som streckade linjer mellan två atomer. Till exempel visas vätebindningen mellan två vattenmolekyler nedan:
Rsak till vätebindning
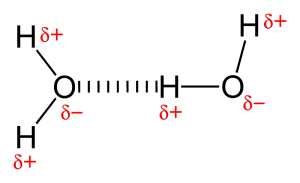
På grund av närvaron av en mycket elektronegativ atom som syre eller kväve dras det delade elektronparet mellan syre och väte mot den mer elektronegativa atomen. Denna ojämna fördelning av elektronpar leder till att det bildas två partiella dipoler. Den delvis positivt laddade vätgasen dras då till den andra delvis negativt laddade syret eller kvävet kallas för vätebindning.
Typer av vätebindning
Vätgasbindning kan uppstå mellan två atomer i samma molekyl eller mellan två atomer i olika molekyler. Beroende på detta finns det två typer av vätebindning:
- Intermolekylär vätebindning
- Intramolekylär vätebindning
Intermolekylär vätebindning
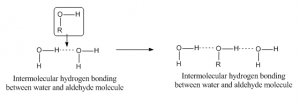
När vätebindning sker mellan två atomer i olika molekyler kallas det intermolekylär vätebindning. För en sådan bindning bör en molekyl ha en delvis positiv väteatom som acceptansatom och en annan molekyl bör ha en delvis negativ eller donatoratom. Som exempel på vätebindning mellan aldehyd- och vattenmolekylen anges nedan:
2. Intramolekylär vätebindning
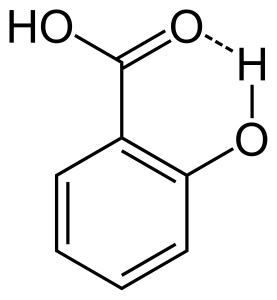
När vätebindning sker mellan två delvis laddade atomer i samma molekyl kallas det för intramolekylär vätebindning. Detta sker när två funktionella grupper finns i samma molekyl och de är på ett sådant sätt att de kan attrahera varandra för att bilda vätebindning. Salicylsyra har till exempel två funktionella grupper, alkohol och karboxylsyra. Här uppstår intramolekylär vätebindning mellan väteatomen i alkoholgruppen och syreatomen i karboxylsyregruppen.
Effekter av vätebindning
På kokpunkten
Det förväntas att kokpunkten för ämnen med samma eller liknande molekylvikt ska ha samma eller liknande kokpunkt. Kokpunkten för eter och alkan med liknande molekylvikt ligger inte långt ifrån varandra. Men kokpunkten för alkoholer är mycket högre än eter med liknande molekylvikt. Detta kan förklaras med vätebindningar. På grund av vätebindningarna i alkoholen stiger kokpunkten. Det krävs extra energi för att bryta vätebindningen innan alkoholen kokar. Eftersom det inte finns några vätebindningar har alkaner och etrar låg kokpunkt.

Om löslighet
Alkoholer är lösliga i vatten, men det är inte alkaner. Detta beror på att intermolekylära vätebundna föreningar kan lösas upp i intermolekylära vätebundna lösningsmedel. En polär molekyl som alkohol kan gå in i två vattenmolekyler för att bilda vätebindningar, medan en opolär substans som alkaner inte kan göra det. När kolkedjan i alkoholer ökar minskar dock lösligheten eftersom den långa kedjan står i vägen för vätebindningen.
Sammanfattning
- Vätevätebindning är en attraherande kraft mellan en delvis positivt laddad väteatom och en delvis negativt laddad atom.
- När vätebindning sker mellan till atomer i olika molekyler kallas det intermolekylär vätebindning.
- När vätebindning sker mellan två delvis laddade atomer i samma molekyl kallas det för intramolekylär vätebindning.
- På grund av intermolekylär vätebindning är kokpunkten hos polära föreningar högre än hos icke-polära föreningar med samma a.
- På grund av vätebindning mellan organisk förening och vatten är lösligheten möjlig till viss del.