V počátcích organické chemie byly alkeny označovány jako „nenasycené“, protože na rozdíl od „nasycených“ alkanů snadno reagovaly s látkami, jako jsou halogeny, halogenidy vodíku, oxidační činidla atd. Proto byla „chemická afinita“ alkenů považována za nenasycenou neboli „nenasycenou“. (Viz také oddíl 1-1I.)
Jedním z důvodů, proč alkeny a alkyny reagují snadněji než alkany, je skutečnost, že vazby uhlík-uhlík v násobné vazbě jsou individuálně slabší než běžné vazby uhlík-uhlík jednoduché. Uvažujte o příslušných vazebných energiích. Podle tabulky 4-3 jsou síly jednoduché, dvojné a trojné vazby uhlík-uhlík následující: \(83\), \(146\) a \(200 \: \text{kcal}\). Z těchto hodnot lze vypočítat, že štěpení poloviny dvojné vazby uhlík-uhlík by mělo vyžadovat \(63 \: \text{kcal}\) a štěpení třetiny trojné vazby uhlík-uhlík by mělo vyžadovat \(54 \: \text{kcal}\):

V důsledku toho se očekává, že adiční reakce na vícenásobné vazby budou probíhat přibližně v rozmezí \(20\)-\(30 \: \text{kcal}\) exotermičtější než odpovídající reakce štěpení jednoduchých vazeb uhlík-uhlík, jak je zde odhadnuto pro reakci s bromem:
Zásadní rozdíl v reakčních teplech ethanu, ethenu a ethynu s bromem se odráží ve velmi důležitém praktickém hledisku při zacházení s ethynem (acetylenem), totiž v jeho termodynamické stabilitě vzhledem k pevnému uhlíku a plynnému vodíku. Na rozdíl od ethanu lze na základě vazebných energií ukázat, že ethen i ethin jsou nestabilní vzhledem k tvorbě pevného uhlíku a plynného vodíku:
Ačkoli se nezdá, že by to u ethenu způsobovalo zvláštní problémy, může dojít k výbušnému rozkladu ethinu na uhlík a vodík, pokud je plyn stlačen na \(10\)-\(20 \: \text{kg cm}^{-2}\). I s kapalným ethynem (bp \sim 83^\text{o}\)) je třeba zacházet opatrně. Ethyne se nepoužívá komerčně pod tlakem, pokud není smíchán s inertním plynem a není s ním manipulováno v robustním zařízení. Ethyne hoří s čistým kyslíkem a vytváří velmi horký plamen, který se hojně používá ke svařování. K tomuto účelu se plyn rozpouští pod asi \(15 \: \text{kg cm}^{-2}\) ve 2-propanonu (aceton, 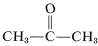 , bp \(56,5^\text{o}\)) a uchovává se v lahvích naplněných diatomitickou zeminou.
, bp \(56,5^\text{o}\)) a uchovává se v lahvích naplněných diatomitickou zeminou.
Proč je ethen mnohem méně stabilní než ethen nebo ethan? Za prvé, vazby \(\ce{C-C}\) nejsou tak silné jako vazby \(\ce{C-H}\). Proto lze obvykle očekávat zvýšení stability, pokud jsou vazby \(\ce{C-H}\) vytvořeny na úkor vazeb \(\ce{C-C}\); ethen a ethan mají každý více vazeb \(\ce{C-H}\) než ethen. Za druhé, ethyny mají šest elektronů držených mezi dvěma uhlíky a tyto elektrony se vzájemně značně interelektronicky odpuzují. To vysvětluje skutečnost, že průměrná pevnost vazby \(\ce{C-C}\) pro trojnou vazbu alkynu je \(200/3 = 67 \: \text{kcal}\) ve srovnání s \(146/2 = 73 \: \text{kcal}\) pro dvojnou vazbu alkenu a \(83 \: \text{kcal}\) pro normální jednoduchou vazbu alkanu.
- John D. Robert a Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, druhé vydání. W. A. Benjamin, Inc. , Menlo Park, Kalifornie. ISBN 0-8053-8329-8. Tento obsah je chráněn autorskými právy za následujících podmínek: „Je vám uděleno povolení k individuálnímu, vzdělávacímu, výzkumnému a nekomerčnímu rozmnožování, šíření, zobrazování a předvádění tohoto díla v jakémkoli formátu.“