Reálné a ideální plyny
Ideální plyn je takový plyn, který se řídí plynovými zákony za všech podmínek teploty a tlaku. Aby tomu tak bylo, musel by plyn zcela dodržovat kineticko-molekulární teorii. Částice plynu by musely zaujímat nulový objem a nemusely by vůči sobě vykazovat žádné přitažlivé síly. Protože ani jedna z těchto podmínek nemůže být splněna, ideální plyn neexistuje. Skutečný plyn je plyn, který se nechová podle předpokladů kineticko-molekulární teorie. Naštěstí za podmínek teploty a tlaku, se kterými se běžně setkáváme v laboratoři, mají reálné plyny tendenci chovat se velmi podobně jako ideální plyny.
Za jakých podmínek se tedy plyny chovají nejméně ideálně? Když je plyn vystaven vysokému tlaku, jeho molekuly jsou nuceny přiblížit se k sobě, protože se zmenšuje prázdný prostor mezi částicemi. Zmenšení prázdného prostoru znamená, že předpoklad, že objem samotných částic je zanedbatelný, je méně platný. Když se plyn ochladí, pokles kinetické energie částic způsobí jejich zpomalení. Pokud se částice pohybují nižší rychlostí, jsou přitažlivé síly mezi nimi výraznější. Jiný pohled na věc je, že pokračující ochlazování plynu jej nakonec změní v kapalinu a kapalina již rozhodně není ideálním plynem (viz kapalný dusík na obrázku níže). Lze shrnout, že reálný plyn se nejvíce odchyluje od ideálního plynu při nízkých teplotách a vysokých tlacích. Plyny jsou nejvíce ideální při vysoké teplotě a nízkém tlaku.

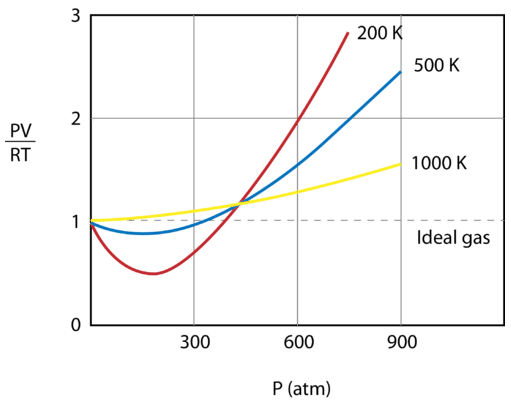
Následující obrázek ukazuje graf závislosti \(\frac{PV}{RT}\) na tlaku pro \(1 \: \text{mol}\) plynu při třech různých teplotách – \(200 \: \text{K}\), \(500 \: \text{K}\) a 1000 \: \text{K}\). Ideální plyn by měl hodnotu 1 pro tento poměr při všech teplotách a tlacích a graf by byl jednoduše vodorovnou přímkou. Jak je vidět, dochází k odchylkám od ideálního plynu. Jakmile začne tlak stoupat, přitažlivé síly způsobí, že objem plynu je menší, než se očekávalo, a hodnota \(\frac{PV}{RT}\) klesne pod 1. Pokračující růst tlaku vede k tomu, že objem částic začne být významný a hodnota \(\frac{PV}{RT}\) vzroste na hodnotu větší než 1. Všimněte si, že velikost odchylek od ideality je největší pro plyn při \(200 \: \text{K}\) a nejmenší pro plyn při \(1000 \: \text{K}\).
Ideálnost plynu závisí také na síle a typu mezimolekulárních přitažlivých sil, které existují mezi částicemi. Plyny, jejichž přitažlivé síly jsou slabé, jsou ideálnější než plyny se silnými přitažlivými silami. Při stejné teplotě a tlaku je neon ideálnější než vodní pára, protože atomy neonu jsou přitahovány pouze slabými disperzními silami, zatímco molekuly vodní páry jsou přitahovány relativně silnějšími vodíkovými vazbami. Helium je ideálnější plyn než neon, protože jeho menší počet elektronů znamená, že disperzní síly helia jsou ještě slabší než u neonu.