Pevnost vazby: Kovalentní vazby
Stabilní molekuly existují proto, že kovalentní vazby drží atomy pohromadě. Pevnost kovalentní vazby měříme energií potřebnou k jejímu přerušení, tj. energií nutnou k oddělení vázaných atomů. Oddělení jakékoli dvojice vázaných atomů vyžaduje energii; čím silnější je vazba, tím větší je energie potřebná k jejímu přerušení. Energie potřebná k přerušení určité kovalentní vazby v jednom molu plynných molekul se nazývá vazebná energie nebo energie disociace vazby. Energie vazby pro dvouatomovou molekulu, \(D_{X-Y}\), je definována jako standardní změna entalpie pro endotermickou reakci:
\
Například vazebná energie čisté kovalentní vazby H-H, \(\Delta_{H-H}\), je 436 kJ na mol přerušené vazby H-H:
\
Přerušení vazby vždy vyžaduje přidání energie do molekuly. A naopak, vytvořením vazby se vždy energie uvolní.
Molekuly se třemi nebo více atomy mají dvě nebo více vazeb. Součet energií všech vazeb v takové molekule je roven standardní změně entalpie pro endotermickou reakci, při níž se přeruší všechny vazby v molekule. Například součet energií čtyř vazeb C-H v CH4, 1660 kJ, se rovná standardní změně entalpie reakce:
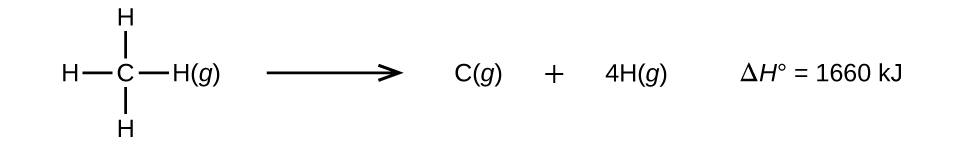
Průměrná energie vazby C-H, \(D_{C-H}\), je 1660/4 = 415 kJ/mol, protože na jeden mol reakce připadají čtyři moly porušených vazeb C-H. Ačkoli jsou čtyři vazby C-H v původní molekule ekvivalentní, nevyžadují každá z nich k přerušení stejnou energii; jakmile je přerušena první vazba (což vyžaduje 439 kJ/mol), zbývající vazby se přerušují snadněji. Hodnota 415 kJ/mol je průměrná, nikoliv přesná hodnota potřebná k přerušení kterékoliv vazby.
Síla vazby mezi dvěma atomy roste s rostoucím počtem elektronových párů ve vazbě. Obecně platí, že s rostoucí pevností vazby klesá její délka. Zjistíme tedy, že trojné vazby jsou silnější a kratší než dvojné vazby mezi stejnými dvěma atomy; podobně dvojné vazby jsou silnější a kratší než jednoduché vazby mezi stejnými dvěma atomy. Průměrné vazebné energie pro některé běžné vazby jsou uvedeny v tabulce \(\PageIndex{2}\) a srovnání vazebných délek a vazebných sil pro některé běžné vazby je uvedeno v tabulce \(\PageIndex{2}\). Když se jeden atom váže s různými atomy ve skupině, síla vazby obvykle klesá s postupem dolů po skupině. Například C-F má 439 kJ/mol, C-Cl 330 kJ/mol a C-Br 275 kJ/mol.
| Vazba | Vazbová energie | Vazba | Vazbová energie | Vazba | Vazba | Vazbová energie | ||
|---|---|---|---|---|---|---|---|---|
| H-H | 436 | C-S | 260 | F-Cl | 255 | |||
| H-C | 415 | C-Cl | 330 | F-Br | 235 | |||
| H-N | 390 | C-Br | 275 | Si-Si | 230 | |||
| H-O | 464 | C-I | 240 | Si-P | 215 | |||
| H-F | 569 | N-N | 160 | Si-S | 225 | |||
| H-Si | 395 | \(\mathrm{N=N}}) | 418 | Si-Cl | 359 | |||
| H-P | 320 | \(\mathrm{N≡N}\) | 946 | Si-Br | 290 | |||
| H-S | 340 | N-O | 200 | Si-I | 215 | |||
| H-Cl | 432 | N-F | 270 | P-P | 215 | |||
| H-Br | 370 | N-P | 210 | P-S | 230 | |||
| H-I | 295 | N-Cl | 200 | P-Cl | 330 | |||
| C-C | 345 | N-Br | 245 | P-Br | 270 | |||
| 611 | O-O | 140 | P-I | 215 | ||||
| \(\mathrm{C≡C}\) | 837 | \(\mathrm{O=O}\) | 498 | S-S | 215 | |||
| C-N | 290 | O-F | 160 | S-Cl | 250 | |||
| \(\mathrm{C=N}\) | 615 | O-Si | 370 | S-Br | 215 | |||
| \(\mathrm{C≡N}\) | 891 | O-P | 350 | Cl-Cl | 243 | |||
| C-O | 350 | O-Cl | 205 | Cl-Br | 220 | |||
| \(\mathrm{C=O}\) | 741 | O-I | 200 | Cl-I | 210 | |||
| \(\mathrm{C≡O}\) | 1080 | F-F | 160 | Br-Br | 190 | |||
| C-F | 439 | F-Si | 540 | Br-I | 180 | |||
| C-Si | 360 | F-P | 489 | I-I | 150 | |||
| C-P | 265 | F-S | 285 |
| Vazba | Délka vazby (Å) | Energie vazby (kJ/mol) |
|---|---|---|
| C-C | 1.54 | 345 |
| \(\mathrm{C=C}\) | 1.34 | 611 |
| \(\mathrm{C≡C}\) | 1.20 | 837 |
| C-N | 1,43 | 290 |
| \(\mathrm{C=N}\) | 1.38 | 615 |
| \(\mathrm{C≡N}\) | 1.16 | 891 |
| C-O | 1,43 | 350 |
| \(\mathrm{C=O}\) | 1.23 | 741 |
| \(\mathrm{C≡O}\) | 1,13 | 1080 |
Vazbové energie můžeme použít k výpočtu přibližných změn entalpií u reakcí, kde nejsou k dispozici entalpie vzniku. Výpočty tohoto typu nám také řeknou, zda je reakce exotermická nebo endotermická.
- Exotermická reakce (ΔH záporné, vzniká teplo) nastává, když jsou vazby v produktech silnější než vazby v reaktantech.
- Endotermická reakce (ΔH kladné, pohlcené teplo) nastává, když jsou vazby v produktech slabší než vazby v reaktantech.
Změna entalpie, ΔH, u chemické reakce se přibližně rovná součtu energie potřebné k přerušení všech vazeb v reaktantech (energie „in“, kladné znaménko) plus energie uvolněné při vzniku všech vazeb v produktech (energie „out“, záporné znaménko). To lze matematicky vyjádřit následujícím způsobem:
\
V tomto výrazu znamená symbol \(\Sigma\) „součet“ a D představuje vazebnou energii v kilojoulech na mol, což je vždy kladné číslo. Vazbová energie se získá z tabulky a závisí na tom, zda je daná vazba jednoduchá, dvojná nebo trojná. Při výpočtu entalpie tímto způsobem je tedy důležité, abychom zohlednili vazbu ve všech reaktantech a produktech. Protože hodnoty D jsou obvykle průměrné hodnoty pro jeden typ vazby v mnoha různých molekulách, poskytuje tento výpočet hrubý odhad, nikoliv přesnou hodnotu entalpie reakce.
Přemýšlejte o následující reakci:
nebo
\
K vytvoření dvou molů HCl je třeba přerušit jeden mol vazeb H-H a jeden mol vazeb Cl-Cl. Energie potřebná k přerušení těchto vazeb je součtem vazebné energie vazby H-H (436 kJ/mol) a vazby Cl-Cl (243 kJ/mol). Během reakce vzniknou dva moly vazeb H-Cl (vazebná energie = 432 kJ/mol), čímž se uvolní 2 × 432 kJ; neboli 864 kJ. Protože vazby v produktech jsou silnější než vazby v reaktantech, reakce uvolňuje více energie, než spotřebuje:
\-2D_{H-Cl}}\
&=\mathrm{-2(432)=-185\:kJ}
\konec {align*}\]
Tato přebytečná energie se uvolňuje jako teplo, takže reakce je exotermická. Tabulka T2 uvádí hodnotu standardní molární entalpie vzniku HCl(g), \(ΔH^\\circ_\ce f\), -92,307 kJ/mol. Dvojnásobek této hodnoty je -184,6 kJ, což dobře souhlasí s dříve získanou odpovědí pro vznik dvou molů HCl.
Příklad \(\PageIndex{1}\):
Metanol, CH3OH, může být vynikajícím alternativním palivem. Vysokoteplotní reakcí vodní páry a uhlíku vzniká směs plynů oxidu uhelnatého, CO, a vodíku, H2, ze které lze vyrobit metanol. Pomocí vazebných energií v tabulce \(\PageIndex{2}\) vypočítejte přibližnou změnu entalpie, ΔH, pro tuto reakci:
\
Roztok
Nejprve musíme zapsat Lewisovy struktury reaktantů a produktů:
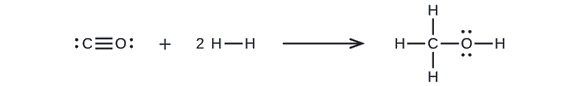
Z toho vidíme, že ΔH pro tuto reakci zahrnuje energii potřebnou k přerušení trojné vazby C-O a dvou jednovazných vazeb H-H, jakož i energii vzniklou vytvořením tří jednovazných vazeb C-H, jedné jednovazné vazby C-O a jedné jednovazné vazby O-H. Můžeme to vyjádřit takto (pomocí rovnice \ref{EQ3}):
\-}
\end {align*}\]
Při použití hodnot vazebné energie v tabulce \(\PageIndex{2}\) dostaneme:
&=\ce{-107\:kJ}
\konec {align*}\]
Tuto hodnotu můžeme porovnat s hodnotou vypočtenou na základě údajů \(ΔH^\circ_\ce f\) z přílohy G:
&=-\\
&=\mathrm{-90.5\:kJ}
\end {align*}\]
Všimněte si, že mezi hodnotami vypočtenými pomocí dvou různých metod je poměrně značný rozdíl. K tomu dochází proto, že hodnoty D jsou průměrem různých vazebných sil; proto často poskytují pouze hrubou shodu s jinými údaji.
Cvičení \(\PageIndex{1}\)
Etylalkohol, CH3CH2OH, byl jednou z prvních organických chemických látek záměrně syntetizovaných člověkem. Má mnoho využití v průmyslu a je to alkohol obsažený v alkoholických nápojích. Lze ho získat kvašením cukru nebo syntetizovat hydratací ethylenu v následující reakci:

S využitím vazebných energií v tabulce \(\PageIndex{2}\) vypočítejte přibližnou změnu entalpie ΔH pro tuto reakci.
Souhrn
Video \(\PageIndex{2}\):
Kovalentní vazby vznikají při sdílení elektronů mezi atomy, které jsou přitahovány jádry obou atomů. V čistě kovalentních vazbách jsou elektrony sdíleny rovnoměrně. V polárních kovalentních vazbách jsou elektrony sdíleny nerovnoměrně, protože jeden atom působí na elektrony větší přitažlivou silou než druhý.
Síla kovalentní vazby se měří její disociační energií, tj. množstvím energie potřebným k rozpadu dané vazby v jednom molu molekul. Vícenásobné vazby jsou silnější než jednoduché vazby mezi stejnými atomy. Entalpii reakce lze odhadnout na základě energie potřebné k rozpadu vazeb a energie uvolněné při vzniku nových vazeb.
Klíčové rovnice
- Energie vazby pro dvouatomovou molekulu: \(\ce{XY}(g)⟶\ce{X}(g)+\ce{Y}(g)\hspace{20px}\ce{D_{X–Y}}=ΔH°\)
- Enthalpy change: ΔH = ƩVazby přerušeny – ƩVazby vytvořeny
Poznámky
- Tato otázka je převzata ze zkoušky Chemistry Advanced Placement Examination a je použita se souhlasem Educational Testing Service.
Slovníček
vazebná energie (také vazebná disociační energie) energie potřebná k přerušení kovalentní vazby v plynné látce
Přispěvatelé
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) a Richard Langley (Stephen F. Mayer). Austin State University) s přispívajícími autory. Obsah učebnice vytvořený společností OpenStax College je licencován pod licencí Creative Commons Attribution License 4.0. Ke stažení zdarma na http://cnx.org/contents/85abf193-2bd…[email protected]).
- Adelaide Clark, Oregon Institute of Technology
- Fuse School, Open Educational Resource zdarma, pod licencí Creative Commons: (Zobrazit licenční smlouvu: https://creativecommons.org/licenses/by-nc/4.0/)
- Crash Course Chemistry:
Zpětná vazba
Máte zpětnou vazbu k tomuto textu? Klikněte zde.
Nalezli jste překlep a chcete získat kredity navíc? Klikněte zde.
.