Co je kobalt
Kobalt (výslovnost: KO-bolt) je tvrdý, lesklý stříbřitě modrý prvek patřící do skupiny přechodných kovů a je reprezentován chemickou značkou Co . Je chemicky aktivní a může tvořit mnoho sloučenin . Je to feromagnetický kov, který lze zmagnetovat a který se leguje s niklem a hliníkem k výrobě silných magnetů .

Kobalt Symbol
Izotopy
Má jeden stabilní, v přírodě se vyskytující izotop 59Co a 28 radioizotopů, z nichž nejstabilnější jsou 60Co, 57Co, 56Co a 58Co s poločasy rozpadu 5,2714 roku, 271,8 dne, 77,27 dne a 70,86 dne . Doby poločasu rozpadu jeho ostatních radioizotopů jsou kratší než 18 hodin .
Kde se nachází kobalt
Kobalt se přirozeně vyskytuje v kombinaci s dalšími prvky v minerálních rudách, jako je kobaltit (sulfid obsahující kobalt, arsen, železo a nikl), erytrit (hydratovaný arseničnan kobaltnatý) a skutterudit (arseničnan kobaltnatý) . Obvykle se získává jako vedlejší produkt při těžbě mědi a niklu .
Manganové konkrece nacházející se na dně oceánů představují obrovské zásoby přechodných kovů, které obsahují tuny kobaltu . Mezi tři země s největšími zásobami kobaltu patří Demokratická republika Kongo (DRK), Austrálie a Kuba, zatímco mezi tři největší producenty patří DRK, Čína a Zambie .

Kobalt
Historie
Původ názvu:
Kdo ho objevil: Název je odvozen od „kobald“, což v němčině znamená „skřet“, a od „cobalos“, řeckého slova znamenajícího „důl“ .
Kdo ho objevil? Prvek objevil švédský chemik a mineralog Georg Brandt .
Kdy a jak byl objeven
V hrobce Tutanchamona, staroegyptského faraona, který vládl v letech 1361-1352 př. n. l., byl tmavě modrý skleněný předmět, který byl vyroben z kobaltu . V Číně se kobaltová modř používala k výrobě keramických glazur .
Kromě starověkého původu se její objev v nedávné době datuje do 30. let 17. století, kdy se Georg Brandt zajímal o modrou rudu z některých místních dolů . Nakonec se mu podařilo prokázat, že modrá ruda obsahuje nový kov . Popsal její vlastnosti a výsledky publikoval v roce 1739 .
Jeho objev byl kontroverzní, protože ostatní chemici jeho zjištění po mnoho let zpochybňovali . Jeho kolega švédský chemik Torbern Bergman však provedl další studie a v roce 1780 objev Georga Brandta potvrdil .
Identifikace kobaltu |
|||
| Atomové číslo | 27 | ||
| Číslo CAS | 7440-48-.4 | ||
| Pozice v periodické tabulce | Skupina | Období | Blok |
| 9 | 4 | d | |
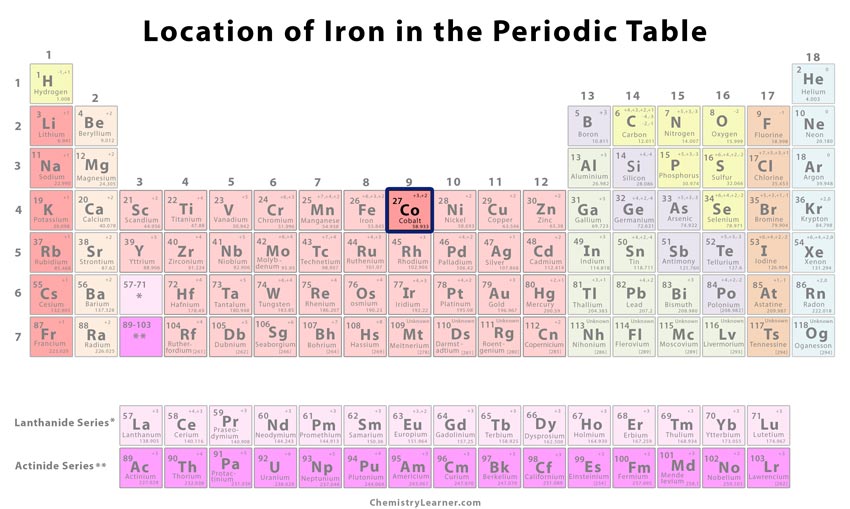
Kde? se kobalt nachází v periodické tabulce
Vlastnosti a charakteristika kobaltu
Všeobecné vlastnosti |
||||||||||||||||
| Relativní atomová hmotnost | 58.933 | |||||||||||||||
| Atomová hmotnost | 58,933 amu | |||||||||||||||
| Molární hmotnost | 58,9331950 ± 0,0000050 g/mol | |||||||||||||||
| Molekulová hmotnost | 58.933 g/mol | |||||||||||||||
Fyzikální vlastnosti |
||||||||||||||||
| Barva | Stříbřitě modrá, modrobílá | |||||||||||||||
| Teplota tání/teplota tuhnutí | 1495 °C, 2723 °F | |||||||||||||||
| Teplota varu | 2927 °C, 5301 °F | |||||||||||||||
| Hustota | 8.86 g cm-3 | |||||||||||||||
| Stav látky při pokojové teplotě (pevná látka/kapalina/plyn) | Tvrdá látka | |||||||||||||||
| Tvrdost | ||||||||||||||||
| – Brinell | 700 MPa | |||||||||||||||
| – Mohs | 5 | |||||||||||||||
| – Vickers | 1043 MPa | |||||||||||||||
| Elektrická vodivost | 1.7 X 107 S/m | |||||||||||||||
| Iontový náboj | 3+ | |||||||||||||||
| Tepelná (tepelná) vodivost | 100 W/(m K) | |||||||||||||||
| Měrné teplo | 421 J kg-1 K-1 | |||||||||||||||
| Modul pevnosti v tahu | neznámý | |||||||||||||||
| Modul pružnosti ve smyku | neznámý | |||||||||||||||
| Youngův modul | Neznámý | |||||||||||||||
| Tlak par | ||||||||||||||||
| – Teplota (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | |||||
| – Tlak (Pa) | – | – | – | 2.09 X 10-10 | 1,00 X 10-6 | 4,19 X 10-4 | 0,0379 | 1.15 | 16 | – | – | |||||
Chemické vlastnosti |
||||||||||||||||
| Oxidační stavy | 3, 2, 0, -1 | |||||||||||||||
| Izotopy | Izotop | Hmotnost | Hodnota (%) | Poloviční životnost | Způsob rozpadu | |||||||||||
| 59Co | 58.933 | 100 | – | – | ||||||||||||
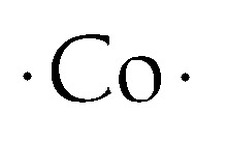
Kobalt Lewisova bodová struktura
Atomické údaje kobaltu (prvek 27)
| Valenční elektrony | 9 | |||||||
| Kvantová čísla | ||||||||
| – n | 3 | |||||||
| – ℓ | 2 | |||||||
| – mℓ | -1 | |||||||
| – ms | -1/2 | |||||||
| Elektronová konfigurace (konfigurace vzácného plynu) | 3d74s2 | |||||||
| Atomová struktura | ||||||||
| – Počet elektronů | 27 | |||||||
| – Počet neutronů | 32 | |||||||
| – Počet protonů | 27 | |||||||
| Poloměr atomu | ||||||||
| – Atomový poloměr | 2.00 Å | |||||||
| – Kovalentní poloměr | 1,18 Å | |||||||
| Elektronegativita (Paulingova stupnice) | 1,88 | |||||||
| Elektronová afinita | 63.873 kJ mol-1 | |||||||
| Ionizační energie (kJ mol-)1) | 1. | 2. | 3. | 4. | 5. | 6. | 7. | 8. |
| 760.402 | 1648.356 | 3232.3 | 4949.7 | 7670.6 | 9842 | 12437 | 15225.4 | |
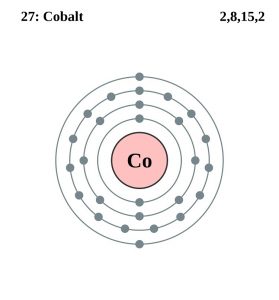
Kobaltová elektronová konfigurace (Bohrův model)
K čemu se kobalt používá
- Kobalt se leguje pro použití v generátorech plynových turbín a proudových turbín díky své pevnosti při vysokých teplotách a odolnosti proti korozi .
- Kobalt se příležitostně používá v galvanickém pokovování díky své tvrdosti a atraktivnímu vzhledu .
- Běžně se používá jako katodový materiál v lithium-iontových bateriích .
- Soli kobaltu se používají k dodávání intenzivních modrých barev sklu, porcelánu, keramice, smaltům a barvám .
- Radioaktivní 60Co se používá k léčbě rakoviny a při ozařování potravin pro kontrolu patogenů a prodloužení trvanlivosti .
- Stelitové superslitiny složené z chromu, kobaltu a wolframu se používají k výrobě řezných nástrojů odolných proti vysokým teplotám a opotřebení .
Toxicita kobaltu a účinky na zdraví
K otravě kobaltem může dojít při jeho náhodném požití, vdechnutí nebo styku s kůží ve velkém množství . Ve velkém množství může být kobalt pro člověka a některá zvířata karcinogenní .
V člověku se vyskytuje ve stopovém množství a je základní složkou vitaminu B12 . Malé dávky kobaltu se také podávají některým zvířatům, aby se u nich zabránilo nedostatku minerálů .

Minerál kobalt (kobaltit)
Zajímavá fakta
- Kobalt je graficky znázorněn „koboldem“ nebo skřetem (považovaným středověkými německými horníky za obtížný) s nějakým čínským porcelánem v pozadí, což odkazuje na jeho použití jako glazury na keramiku ve staré Číně .
- Kobalt si může zachovat své magnetické vlastnosti až do teploty (Curieho bodu) 1 121 °C (2049.8 °F), což je nejvyšší hodnota ze všech feromagnetických prvků .
- V roce 2010 němečtí vědci použili atom kobaltu k pořízení prvních snímků změny spinu .
Cena kobaltu
Cena čistého kobaltu je asi 0,21 USD za gram a ve velkém stojí asi 0 USD.044 za gram .
- http://www.rsc.org/periodic-table/element/27/cobalt
- https://education.jlab.org/itselemental/ele027.html
- https://www.livescience.com/29275-cobalt.html
- https://www.chemicool.com/elements/cobalt.html
- https://education.jlab.org/itselemental/iso027.html
- https://www.webqc.org/molecular-weight-of-Co%28cobalt%29.html
- https://pubchem.ncbi.nlm.nih.gov/compound/cobalt#section=Top
- http://periodictable.com/Elements/027/data.html
- http://www.gpb.org/files/pdfs/gpbclassroom/chemistry/ionicChargesChart.pdf
- http://dwb4.unl.edu/Chem/CHEM869B/CHEM869BLinks/learn.chem.vt.edu/tutorials/bonding/valence.html
- http://chemistry-reference.com/q_elements.asp?Symbol=Co&language=en
- https://medlineplus.gov/ency/article/002495.htm