Každý elektron v atomu lze jednoznačně identifikovat pomocí souboru čtyř kvantových čísel.

Ačkoli jejich objevení vyžadovalo pokročilou matematiku, jsou to všechno konvenční čísla:tři z nich mohou nabývat pouze jednoduchých celočíselných hodnot, čtvrté je jednoduchý zlomek.
První tři kvantová čísla vyplývají z vlnové funkce Ψ, získané řešením Schrödingerovy rovnice.
Čtvrté kvantové číslo, elektronový spin, vyplývá z objevu, že elektrony mají dvě možné orientace.
Čísla a jejich definice jsou následující:
Kvantová čísla
| Kvantové číslo | Název | Možné hodnoty | Informace |
|---|---|---|---|
| n | hlavní kvantové číslo | 1, 2, 3,…., n | Definuje energetický obal obsazený elektronem. Schránky nejbližší jádru mají nejnižší hodnotu n a nejnižší potenciální energii. n je první číslo zapsané v elektronových konfiguracích, jako je například hořčíková: 1s2 2s2 2p6 3s2 |
| l | orbitální kvantové číslo momentu hybnosti (nazývá se také azimutální kvantové číslo) |
0, 1, 2,…., (n-1) | Definuje energii podskupiny – v systémech s více než jedním elektronem mají podskupiny různé energie. l definuje písmeno podskupiny v elektronových konfiguracích. Například: 1s2 2s2 2p6 3s2 l = 0 dává podoblast s. l = 1 dává podoblast p. l = 2 dává podoblast d atd. |
| ml | magnetické kvantové číslo | -l, (l+1), …, 0,…. , (l+1), l | Definuje orientaci dílčího orbitalu. Podslupka p s l = 1 má tři hodnoty ml: -Tyto hodnoty označují, že existují tři p orbitaly, tj. orbitaly px, py a pz. Podslupka d, s l = 2, má pět hodnot ml: -Ty naznačují, že existuje pět d orbitalů. |
| ms | elektronové spinové kvantové číslo | -½ nebo +½ | Elektrony mají dvě možné spinové orientace. |
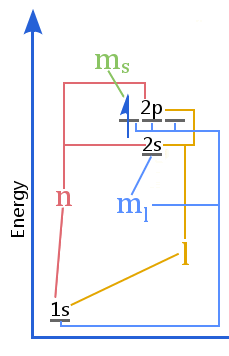
Diagram energetických hladin ukazuje vztah mezi kvantovými čísly vs slupkami, podslupkami, orbitaly a spinem elektronů v atomu.
Žádný elektron v atomu nesdílí všechna čtyři kvantová čísla.Každý elektron lze jednoznačně identifikovat podle jeho kvantového čísla – viz Pauliho vylučovací princip.
Tvary orbitalů nejsou dány kvantovými čísly, ale jsou to hustoty pravděpodobnosti – trojrozměrné mapy prostoru kolem jádra, kde se elektron bude nacházet v 99 procentech případů.Tvary orbitalů se získávají ze čtverce vlnové funkce Ψ2. Přesnou polohu a hybnost žádného elektronu nelze nikdy zjistit – viz Heisenbergův princip neurčitosti.

.