Úvod
Infekce virem hepatitidy B (HBV) je nejčastější příčinou jaterní cirhózy a hepatocelulárního karcinomu ve většině oblastí Asie.1,2 Patogeneze chronické hepatitidy je zprostředkována interakcí imunitní reakce hostitele a hepatocytů, které prezentují antigeny HBV.3,4 Dřívější studie prokázaly, že exprese antigenů HBV hepatocyty významně souvisí se stadiem a aktivitou chronického onemocnění jater. Ve fázi imunitní tolerance se jádrové antigeny hepatitidy B (HBcAg) nacházejí převážně v jádře a korelují s replikací HBV, zatímco v následné fázi imunitní clearance dochází k intrahepatálnímu přesunu HBcAg z jádra do cytoplazmy a souvisí s histologickou aktivitou chronické hepatitidy.5,6 V případech intrahepatální exprese povrchového antigenu hepatitidy B (HBsAg) byly zaznamenány tři vzorce – homogenní typ, typ I ground glass hepatocyte (GGH) a typ II GGH. Homogenní vzor ve skupinové, diskrétní nebo slabé prezentaci byl pozorován u pacientů s vysokou viremií nebo aktivní hepatitidou. GGH typu I jsou obvykle roztroušeny jednotlivě v jaterních lalůčcích s inkluzní hustou homogenní expresí, zatímco GGH typu II exprimují povrchové antigeny na periferii hepatocytů, které se shlukují do skupin a jsou obvykle přítomny ve fázi nízké replikace a převládají od aktivní hepatitidy až po jaterní cirhózu a hepatocelulární karcinom.7-10 Intrahepatální exprese HBcAg i HBsAg tedy úzce souvisí s přirozeným průběhem infekce a replikací HBV.
Mezi fázemi chronické hepatitidy B se imunitně čistá fáze nebo označovaná jako HBeAg-pozitivní chronická hepatitida B často vyskytovala u mladší populace, vykazovala méně závažné histologické aktivity a nesla menší míru mutace precore A1896 a mutace T1762/A1764 promotoru bazálního jádra (BCP) než HBeAg-negativní chronická hepatitida B.11-14 Průběh chronické hepatitidy B je dynamický a je výsledkem interakce virové replikace a imunitního systému hostitele. V důsledku toho je u HBeAg pozitivních pacientů běžně pozorována různorodost klinických příznaků nebo histologických aktivit. Například 34 až 55 % pacientů vykazuje v jaterní histologii přemosťující fibrózu nebo cirhózu, zatímco zbývající pacienti vykazují mírnou fibrózu.15,16 Bylo prokázáno, že akumulace HBsAg v hepatocytech souvisí se specifickými virovými mutacemi a souvisí s aktivitou onemocnění.8,9 Je zajímavé zkoumat charakteristiky intrahepatální exprese HBsAg u pacientů s různou závažností jaterní histologie.
Virové mutanty se obvykle vyvinuly pod tlakem imunitního dozoru hostitele. Mezi přirozeně se vyskytujícími mutantami HBV převládly s progresí onemocnění mutace BCP T1762/A1764, u nichž bylo často zjištěno, že jsou spojeny s pokročilým jaterním onemocněním a hepatocelulárním karcinomem.17,18 Vzorce intrahepatální exprese HBsAg se rovněž měnily v průběhu přirozeného průběhu chronické hepatitidy B. Souvislost mutací BCP T1762/A1764 a intrahepatální exprese HBsAg je dosud neznámá a zbývá ji prozkoumat.
Cílem této studie proto bylo zhodnotit vlastnosti intrahepatální exprese HBsAg a analyzovat souvislost s histologií jater, markery virové replikace a mutantami HBV u HBeAg pozitivní chronické hepatitidy B.
Materiál a metodyPacienti
Do této studie bylo retrospektivně zařazeno celkem 181 pacientů s pozitivním antigenem e hepatitidy B (HBeAg), kteří splňovali kritéria pro zařazení do studie. Zařazovací kritéria byla věk nad 18 let a méně než 70 let, pozitivita HBsAg v séru po dobu delší než 6 měsíců a sérová hladina HBV DNA ≥ 100 000 kopií/ml, abnormální sérová hladina alaninaminotransferázy, žádná jiná vysvětlitelná etiologie chronické hepatitidy, včetně alkoholu, autoimunitní hepatitidy nebo markerů infekce virem hepatitidy C, virem hepatitidy D nebo virem lidské imunodeficience, a absence anamnézy anti-HBV léčby a vzorku jaterní biopsie dostupného pro histologické hodnocení. Sérum a jaterní biopsie všech pacientů byly odebrány před zahájením antivirové léčby a vzorky byly až do vyšetření uchovávány při teplotě -70 oC. Tato studie byla schválena Institutional Review Board of National Cheng Kung University Hospital (č.: ER-99-398). Byl získán informovaný souhlas v souladu s Helsinskou deklarací.
HBV virologické testy
Genotypizace HBV byla provedena pomocí multiplexní polymerázové řetězové reakce, jak je popsáno jinde.19 Hladina HBV DNA v séru byla měřena pomocí testu COBAS Amplicor HBV Monitor (COBAS-AM assay, Roche Diagnostics, Branchburg, NJ). Hladina HBsAg v séru byla kvantifikována pomocí testu Abbott Architect HB-sAg QT (Abbott Diagnostics, Rungis, Francie) s dynamickým rozsahem 0,05-250,0 IU/ml. Vzorky s hladinou HBsAg > 250 IU/ml byly znovu testovány v ředění 1:20 a 1:1000.
Polymerázová řetězová reakce a sekvenování oblastí precore a BCP
HBV DNA byla extrahována z 50 μl séra pomocí sady Blood and Tissue Genomic Mini Kit (VIOGENE, Taipei, Taiwan). První kolo PCR bylo provedeno za následujících podmínek: (forward) a 3′-GGATTAAAGACAGTACAGTAGAAG (reverse). Druhé kolo PCR bylo provedeno za stejných podmínek s primery 5′-ATGTCAACGACCGACCTTGA (vpřed) a 3′-TTCCCACCTTATGAGTCCAAG (vzad). Purifikované produkty PCR byly poté přímo sekvenovány pomocí automatického sekvenátoru DNA ABI 310 a sady ABI PRISM Big Dye Terminator Cycle Sequencing Ready Reaction Kit (Applied Biosystems) s dopředným primerem, který byl použit během druhého kola PCR.
Histologie jater
Histologie jater byla hodnocena jedním patologem, který neznal původ pacientů. Nekroinflamace a fibróza byly hodnoceny na základě Knodellova stupně nekroinflamace (v rozmezí 0 až 18)20 a Ishakova stupně fibrózy (v rozmezí 0 až 6)21.
Imunohistochemické barvení bylo provedeno, jak je popsáno jinde22. Stručně řečeno, deparafinované řezy o tloušťce 5 μm byly inkubovány s monoklonální myší anti-HBsAg (klon 3E7, Dako Corp., Carpinteria,USA) a anti-HBcAg (Novocastra Laboratories, Newcastle, Velká Británie) přes noc při 4 °C. Optimální ředění anti-HBsAg nebo anti-HBcAg bylo stanoveno s použitím jaterní tkáně nosiče HBV jako pozitivní kontroly. K detekci výsledného imunitního komplexu byla použita sada StrAviGen Super Sensitive MultiLink Kit (BioGenex). Peroxidázová aktivita byla vizualizována pomocí soupravy aminoetylkarbazolového substrátu (Zymed Laboratory, Inc, San Francisco, CA). Nakonec byly řezy protibarveny hematoxylinem. Jako negativní kontrola byl při inkubaci nahrazen primární protilátkou neimunní myší imunoglobulin. Byly zaznamenány vzorce exprese HBcAg jádrem, cytoplazmou nebo obojím. Vzory exprese HBsAg byly klasifikovány jako homogenní, GGH typu I, GGH typu II.22 Homogenně obarvené hepatocyty byly identifikovány jako hepatocyty se středně silným až silným homogenním cytoplazmatickým barvením; GGH typu I byly identifikovány jako hepatocyty s hustým globulárním nebo „inkluzním“ barvením a GGH typu II byly identifikovány jako hepatocyty s barvením povrchového antigenu na okrajích nebo periferii buňky.6,22 GGH typu I jsou rozptýleny jednotlivě nebo se shlukují v jaterních lalůčcích, zatímco GGH typu II se důsledně shlukují v uzlinách. Úroveň exprese HBcAg a HBsAg byla hodnocena semikvantitativně podle podílu imunoznačených buněk na stupnici 0 až 4+, což odpovídá pozitivitě v 0, 1-10, 11-25, 25-50 % a více než 50 % vyšetřovaných hepatocytů.
Statistické analýzy
Údaje byly vyjádřeny jako průměr ± směrodatná odchylka. Spojité proměnné byly porovnány pomocí Mannova-Whitneyho U testu nebo Kruskal-Wallisovy ANOVY pro jednorozměrnou analýzu. Kategoriální proměnné byly analyzovány pomocí χ2 testu nebo Fisherova přesného testu. Nezávislé faktory, které souvisely s úrovní intrahepatální exprese HBsAg, byly provedeny pomocí vícerozměrné logistické regresní analýzy. Zpracování dat a statistické analýzy byly provedeny pomocí softwaru SPSS pro Windows, verze 17.0 (SPSS Inc., Chicago, IL).
VýsledkyCharakteristika zařazených pacientů
Tabulka 1 uvádí demografické charakteristiky 181 zařazených pacientů. Většina pacientů byli muži (69,1 %) a 63,0 % z nich vykazovalo genotyp HBV C. Mutace precore A1896 byla zjištěna u 20 pacientů (11,0 %) a mutace BCP T1762/A1764 byla zjištěna u 38 pacientů (21,0 %). Ze 181 pacientů bylo pozitivní barvení HB-sAg zjištěno u 105 pacientů (58,0 %). Pacienti s HBsAg barvením vykazovali významně vyšší sérový HBsAg (P
Klinické, virologické a histologické charakteristiky 181 pacientů.
| Charakteristiky | Hodnota | |||
|---|---|---|---|---|
| Exprese HBsAg | P hodnota | |||
| Všichni pacienti (n = 181) | Negativní (n = 76) | Pozitivní (n = 105) | ||
| Věk (rok) ± SD | 36.4 ± 10.5 | 34,2 ± 9,2 | 38,0 ± 11,2 | 0,009 |
| Pohlaví (muž/žena) | 125/56 | 50/26 | 75/30 | 0.418 |
| Mediální hladina AST (U/L) ± SD | 59,7 ± 51,2 | 58,7 ± 42,5 | 60,5 ± 56.8 | 0,634 |
| Mediální hladina ALT (U/L) ± SD | 116,3 ± 124,2 | 120,2 ± 100,8 | 113,5 ± 139.1 | 0,282 |
| HBV genotyp (B/C) | 114/67 | 66/10 | 48/57 | |
| Předkr: G1896/A1896 | 20/161 | 13/63 | 7/98 | 0.027 |
| BCP:* mutant/divoký | 38/143 | 12/64 | 26/79 | 0,144 |
| HBV DNA (log kopií/ml) | 8,4 ± 1.1 | 4,0 ± 0,7 | 4,3 ± 0,7 | |
| Hladina HBsAg ((log IU/ml) | 4,2 ± 0.7 | 8,1 ± 1,0 | 8,6 ± 1,1 | 0,003 |
| Mediální stupeň nekroinflamace podle Knodella ± SD | 5.0 ± 3,0 | 5,3 ± 2,8 | 4,7 ± 3,0 | 0,128 |
| Mean Ishak fibrosis stage ± SD | 1,8 ± 1,6 | 1,7 ± 1,2 | 1,9 ± 1,7 | 0.703 |
Mutant, T1762 a A1764; divoký, A1762 a T1764. χ2 test byl použit pro proměnné pohlaví, genotyp HBV, mutace promotoru precore a bazálního jádra, zatímco pro ostatní proměnné byl použit Mann-Whitney U test. AST: aspartátaminotransferáza. ALT: alaninaminotransferáza. BCP: promotor bazálního jádra. HBV: virus hepatitidy B.
Distribuční vzorce exprese HBsAg
U 105 pacientů, kteří vykazovali expresi HBsAg, byl homogenní vzorec (obrázek 1A) zjištěn u 34 (32.4 %) pacientů, GGH typu I (Obrázek 1B) byl zjištěn u 50 (47,6 %) pacientů, GGH typu II (Obrázek 1C) byl zjištěn u sedmi (6,7 %) pacientů a smíšený vzorec byl zjištěn u 14 (13,3 %) pacientů. Jak je uvedeno v tabulce 2, vyšší výskyt mutací BCP T1762/A1764 byl pozorován u GGH typu II (P =0,001) ve srovnání s ostatními vzory. Mezi expresí HBsAg a sérovými markery virové replikace byl zjištěn reciproční vztah. Na obrázku 1D je vidět, že pacienti s expresí GGH typu II měli nižší hladiny HBV DNA a titry HBsAg, ale vyšší hladiny intrahepatální exprese HBsAg (obrázek 1D). Kromě toho jaterní histologie vykazovala u GGH typu II významně závažnější nekroinflamaci jater a aktivitu fibrózy a vyšší hladinu intrahepatální exprese HBsAg (obrázek 1E).
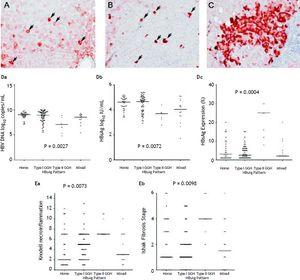
Styly obsahující HBsAg. A. Některé středně až silně homogenně cytoplazmaticky obarvené hepatocyty HBsAg (šipky) na pozadí slabě obarvených hepatocytů. Jádro každého homogenně obarveného hepatocytu se nacházelo ve středu buňky. B. V jaterním parenchymu byly roztroušeny hepatocyty typu I (GGH) s hustým globulárním nebo „inclusion-like“ barvením HBsAg (šipky). C. Shluk GGH typu II vykazoval barvení HBsAg na okraji nebo periferii buňky. Korelace vzorců exprese HBsAg a sérové hladiny HBV DNA (Da), sérové hladiny HBsAg (Db) a intrahepatální hladiny exprese HBsAg (Dc). Souvislost vzorců exprese HBsAg s Knodellovým stupněm nekroinflamace (Ea) a Ishakeovým stupněm fibrózy (Eb). Srovnání mezi skupinami bylo analyzováno pomocí Kruskal-Wallisovy ANOVY.
Demografické charakteristiky podle vzorců distribuce exprese f HBsAg.
| Vzor HBsAg (n = 105) | ||||||
|---|---|---|---|---|---|---|
| Smíšený (n = 14) | Homogenní | Typ I GGH | Typ II GGH | P hodnota | ||
| (n = 34) | (n = 50) | (n = 7) | ||||
| Věk (let) ± SD | 36.3 ± 9.2 | 36.3 ± 10.0 | 39.2 ± 12.7 | 40.0 ± 7.9 | 0.104 | |
| Pohlaví (muž/žena) | 11/3 | 26/11 | 35/15 | 6/1 | 0.720 | |
| Mediální hladina AST (U/L) ± SD | 64,9 ± 56,5 | 61,1 ± 38,6 | 49,9 ± 28,3 | 122.4 ± 168,7 | 0,474 | |
| Mediální hladina ALT (U/L) ± SD | 116,7 ± 112,4 | 114,6 ± 91,1 | 91,5 ± 63,8 | 259,1 ± 447.6 | 0,651 | |
| HBV genotyp (B/C) | 10/4 | 15/19 | 22/28 | 1/6 | 0,085 | |
| Předp: G1896/A1896 | 0/14 | 3/31 | 4/46 | 0/7 | 0.594 | |
| BCP:* mutant/divoký | 4/10 | 4/30 | 12/38 | 6/1 | 0.001 | |
| HBV DNA (log kopií/ml) | 3,9 ± 1,0 | 4.5 ± 0,5 | 4,4 ± 0,7 | 3,6 ± 0,5 | 0,001 | |
| Hladina HBsAg ((log IU/ml) | 8,2 ± 1.1 | 8,9 ± 0,7 | 8,7 ± 1,1 | 6,9 ± 1,5 | ||
| Stupeň nekroinflamace Knodell ± SD | 4.2 ± 2.9 | 4.2 ± 3.3 | 4.7 ± 2.7 | 8.6 ± 2.0 | 0.003 | |
| Ishakovo stadium fibrózy ± SD | 1,9 ± 1,9 | 1,9 ± 1,9 | 1,5 ± 1,3 | 4,1 ± 1,5 | 0.007 |
Mutant, T1762 a A1764; divoký, A1762 a T1764. χ2 test byl použit pro proměnné pohlaví, genotyp HBV, mutace promotoru precore a bazálního jádra, zatímco pro ostatní proměnné byl použit Mann-Whitney U test. AST: aspartátaminotransferáza. ALT: alaninaminotransferáza. BCP: promotor bazálního jádra. HBV: virus hepatitidy B.
Hladina exprese HBsAg
Obrázek 2A až 2D znázorňuje semikvantitativní měření exprese HBsAg. V této studii nebyl žádný pacient, který by měl škálu 4+ exprese HBsAg. Byl pozorován reciproční vztah mezi virovou replikací a histologií jater. Pacienti se škálou exprese HBsAg 2+/3+ měli nižší hladiny titrů HBsAg a hladiny HBV DNA, ale výrazně těžší stupeň nekroinflamace a stadium fibrózy než pacienti se škálou exprese HBsAg 1+ a negativním barvením HBsAg (obr. 2E). Pacienti, kteří vykazovali Knodellův stupeň nekroinflamace ≥ 5 bodů nebo Ishakeovo stadium fibrózy ≥ 1, měli významně vyšší procento exprese HBsAg (obrázek 3).
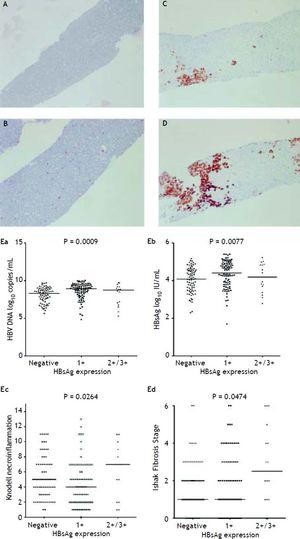
Exprese HBsAg měřená semikvantitativně podle podílu imunoznačených buněk na stupnici 0 až 3+, což odpovídá pozitivitě v (A) 0 % (0), (B) 1-10 % (C) 11-25 % (2+) a (D) 25-50 % (3+) vyšetřovaných hepatocytů. Korelace úrovně exprese HBsAg a sérových hladin HBV DNA (Ea) a HBsAg (Eb) a Knodellova stupně nekroinflamace (Ec) a Ishakova stupně fibrózy (Ed). Srovnání mezi skupinami bylo analyzováno pomocí Kruskal-Wallisovy ANOVY.

Korelace exprese intrahepatálního HBsAg s Knodellovým stupněm nekroinflamace (A) a Ishakovým stupněm fibrózy (B). Srovnání mezi skupinami bylo analyzováno pomocí Mannova-Whitneyho U testu.
Klinické rysy exprese HBsAg
Nejprve jsme zkoumali souvislost virových faktorů a exprese HBcAg/HBsAg. Exprese HBsAg, nikoli exprese HBcAg, vykazovala významně nižší úroveň v přítomnosti prekurzorové mutace (P = 0,001). Pacienti s genotypem C vykazovali vyšší stupeň jaterní fibrózy (P = 0,004). U pacientů s mutací BCP T1762/A1764 byl zjištěn významně vyšší stupeň nekroinflamace a stadium fibrózy a nižší exprese HBcAg buď v cytoplazmě, nebo v jádře. Všechna tato pozorování naznačovala aktivní poškození jater. Pacienti s mutacemi BCP T1762/A1764 navíc vykazovali vyšší intrahepatální expresi HBsAg (9,3 ± 8,0 % vs. 4,3 ± 5,0 %, P = 0,008) (tabulka 3). Dále jsme zkoumali faktory, které mohou souviset s úrovní exprese HB-sAg. V tabulce 4 je uvedeno, že u 16 pacientů byla zjištěna exprese HBsAg ve stupnici 2+/3+ a u 89 pacientů ve stupnici 1+. Jednorozměrná analýza ukázala, že 2+/3+ škály exprese HBsAg byly spojeny s mutacemi BCP T1762/A1764 a závažnějším nekroinflamací a fibrózou jater. Multivariační regresní analýza ukázala, že mutace BCP T1762/A1764 byly nezávislým faktorem, který byl spojen s 2+/3+ stupnicemi intrahepatální exprese HBsAg.
Klinické, virologické a histologické charakteristiky pacientů s virovými mutacemi nebo bez nich.
| Předběžná mutace | P hodnota | BCP mutace | P hodnota | |||
|---|---|---|---|---|---|---|
| Ne (n = 98) | Ano (n = 7) | Ne (n = 79) | Ano (n = 26) | |||
| Věk (rok) ± SD | 37.8 ±11.0 | 40.0 ± 13.7 | 0.541 | 36,0 ± 10,6 | 43,8 ±11,1 | 0,005 |
| Pohlaví (muž/žena) | 70/28 | 5/2 | 1,000 | 54/25 | 21/5 | 0.318 |
| Mediální hladina AST (U/L) ± SD | 60,0 ± 58,3 | 71,3 ± 30,5 | 0,072 | 51,5 ± 32,1 | 87,3 ± 95.6 | 0,007 |
| Mediální hladina ALT (U/L) ±SD | 112,2 ± 143,6 | 131,6 ± 39,1 | 0,031 | 98,2 ± 77,9 | 160,0 ± 242.0 | 0,080 |
| HBV genotyp (B/C) | 45/53 | 3/4 | 1,000 | 44/35 | 4/22 | |
| Předkr: G1896/A1896 | 6/73 | 1/25 | 0,678 | |||
| BCP:* mutant/wild | 25/73 | 1/6 | 0.678 | |||
| HBV DNA (log kopií/ml) | 3,9 ± 1,0 | 4,5 ± 0.5 | 0,959 | 4,5 ± 0,6 | 3,7 ± 0,6 | |
| Hladina HBsAg ((log IU/ml) | 8.2 ± 1,1 | 8,9 ± 0,7 | 0,892 | 8,8 ± 0,9 | 7,7 ± 1,4 | |
| Stupeň nekroinflamace Knodell ± SD | 4,6 ± 3,0 | 6.1 ± 3,1 | 0,142 | 3,9 ± 2,7 | 7,2 ± 2,7 | |
| Ishakův stupeň fibrózy ± SD | 1,8 ± 1,8 | 2,1 ± 0,9 | 0.286 | 1,3 ± 1,4 | 3,4 ± 1,6 | |
| HBcAg cytoplazmatická exprese (%) | 53,6 ± 25,8 | 44,3 ± 30,5 | 0,402 | 56,3 ± 25.4 | 42,7 ± 25,8 | 0,018 |
| HBcAg jaderná exprese (%) | 13,5 ± 17,3 | 17,6 ± 31,6 | 0,800 | 17,6 ± 20,0 | 2,3 ±4.1 | |
| Exprese HBsAg (%) | 5,8 ± 6,5 | 2,4 ± 1,5 | 0,274 | 4,3 ± 5,0 | 9,3 ± 8,0 | 0.003 |
Mutant, T1762 a A1764; divoký, A1762 a T1764. χ2 test byl použit pro proměnné pohlaví, genotyp HBV, mutace promotoru precore a bazálního jádra, zatímco pro ostatní proměnné byl použit Mann-Whitney U test. AST: aspartátaminotransferáza. ALT: alaninaminotransferáza. BCP: promotor bazálního jádra. HBV: virus hepatitidy B.
Souvislost demografických charakteristik a stupně exprese HBsAg.
| Jednotlivé | Multivariační | |||||
|---|---|---|---|---|---|---|
| exprese HBsAg, stupnice | 1+ (n = 89) | 2+/3+ (n = 16) | P hodnota | Odds ratio (95% CI) | P hodnota | |
| Věk | 38.2 ±11.2 | 36.6 ±11.1 | 0.608 | 0,963 (0,903-1,026) | 0,242 | |
| Pohlaví (muž/žena) | 63/26 | 12/4 | 1.000 | |||
| Hladina AST (U/L) | 55,0 ± 37,7 | 90,4 ± 113,2 | 0,234 | 1,026 (0,991∼1.063) | 0,142 | |
| Hladina ALT (U/L) | 103,3 ± 84,4 | 170,1 ± 297,2 | 0,386 | 0,991 (0,978∼1.005) | 0,216 | |
| HBV genotyp (B/C) | 42/47 | 6/10 | 0,589 | 0,994 (0,234∼4,231) | 0.994 | |
| Předběžná mutace A1896 (+/-) | 7/82 | 0/16 | 0.592 | 0.000 (0.000∼) | 0.999 | |
| BCP:*mutant/Wild | 17/72 | 9/7 | 0.003 | 6.356 (1.204∼33.356) | 0.029 | |
| Hladina HBsAg (log10IU/ml) | 4,3 ± 0,7 | 4,2 ± 0,8 | 0,180 | 2,096 (0,598∼7,349) | 0.247 | |
| Sérová HBV DNA (log10 kopií/ml) | 8,6 ± 1,1 | 8,1 ± 1,4 | 0,135 | 0,731 (0,386∼1,383) | 0.335 | |
| Knodellův stupeň nekroinflamace | 4,4 ± 2,9 | 6,3 ± 3,3 | 0,027 | |||
| Ishakův stupeň fibrózy | 1.7 ± 1,6 | 2,9 ± 2,1 | 0,041 | |||
| HBcAg cytoplazmatická exprese (%) | 53.1 ± 25,8 | 52,3 ± 28,5 | 0,915 | |||
| HBcAg jaderná exprese (%) | 14,4 ± 18,3 | 10.1 ± 19,3 | 0,389 | |||
Mutant, T1762 a A1764; divoký, A1762 a T1764. Univariační analýza: χ2 test byl použit pro proměnné pohlaví, genotyp HBV, mutace promotoru prekóru a bazálního jádra, zatímco pro ostatní proměnné byl použit Mannův-Whitneyho U test. Multivariační analýza: Logistická regresní analýza vyjádřená jako poměr šancí s 95% intervalem spolehlivosti a hodnotami P. AST: aspartátaminotransferáza. ALT: alaninaminotransferáza. BCP: základní jádrový promotor. HBV: virus hepatitidy B.
Diskuse
Intrahepatální exprese HBsAg souvisí s různými replikačními stadii a vývojem onemocnění během přirozeného průběhu chronické hepatitidy B.7,10,23 GGH typu I se vyskytuje převážně ve stadiu aktivní hepatitidy, zatímco GGH typu II hlavně ve stadiu inaktivní hepatitidy nebo cirhózy.8 V této studii jsme prokázali, že GGH typu II vykazuje souvislost s těžší histologií jater, doprovázenou významně nižšími sérovými hladinami HBV DNA a titry HBsAg a relativně vyššími hladinami intrahepatální exprese HBsAg. Tento vzájemný vztah mezi jaterní histologií a replikací HBV naznačil, že výskyt GGH typu II by mohl být markerem pokročilého jaterního onemocnění během vývoje choroby u HBeAg pozitivní chronické hepatitidy B. Bylo zjištěno, že vzorce exprese HB-sAg souvisejí s odlišnými virovými mutacemi, které mají vliv na regulaci replikace HBV a defekt sekrece povrchového antigenu z hepatocytů.9,24 GGH typu II konzistentně nese deleční mutace Pre-S2, které snižují syntézu středních povrchových proteinů a následně vedou k akumulaci velkých povrchových proteinů v hepatocytech a defektu sekrece HBsAg.25 V této studii jsme provedli korelaci sérového HBsAg a HBV DNA mezi pacienty s nebo bez GGH typu II. Mírná korelace mezi oběma ukazateli replikace HBV se projevila u pacienta bez GGH typu II (r = 0,686, P 26,27 Delece Pre-S by mohla vést ke stresu ER a aktivovat přenos signálu souvisejícího se stresem. Oxidační poškození DNA hepatocytů a následně stimulované reparační mechanismy DNA by mohly vést ke genomové nestabilitě, která zhoršuje poškození jater a je náchylná ke karcinogenezi.28
Kromě vzorců exprese HBsAg jsme zjistili, že vyšší hladiny exprese provází závažnější histologické aktivity jater a vyšší míra mutací BCP T1762/A1764. Mutace BCP T1762/A1764 jsou silně spojeny s těžkými jaterními histologickými aktivitami a rakovinou jater.29,30 Podle našich znalostí existuje silná vazba mezi genotypem C a přítomností mutací BCP T1762/ A1764.30 V této studii se zdálo, že genotyp C nehraje žádnou roli v úrovni exprese HBsAg. Naopak mutace BCP T1762/A1764 vykazovaly silnou souvislost s expresí HBsAg. Co se týče virových mutací, mutace BCP T1762/A1764 mohou poskytovat základy pro další mutace HBV včetně delece pre-S a komplexních mutací, které se často vyskytují v přítomnosti mutací BCP T1762/ A1764. Komplexní mutanty HBV vykazovaly částečné nebo úplné defekty v expresi a sekreci e, core a povrchových proteinů.31 Snížená sekrece povrchového antigenu hepatitidy B korelovala s aberantní lokalizací povrchových proteinů v ER a vedla k vysoké expresi HBsAg. Kromě toho se mutace BCP T1762/A1764 považuje za důsledek virové zdatnosti v důsledku selekčního tlaku imunitního dozoru hostitele. Podobně mutace pre-S2, které se ukrývají v GGH typu II, se shodují s epitopy omezenými na lidské leukocytární antigeny T a B buněk.32 V okolí GGH typu II obvykle nedochází k nekróze buněk ani k infiltraci T lymfocytů, což naznačuje, že HBV se vznikem deleční mutace pre-S2 je také možným novým únikovým mutantem.33 K akumulaci povrchového antigenu v hepatocytech by však mohlo dojít i bez toho, aby nesl některou ze známých virových mutací v pre-S nebo S genomu nebo v povrchových promotorech.31,34 Exprese HBsAg by tedy mohla být sekvencí ve spojení s virovými mutacemi nebo bez nich.
Tato studie měla několik potenciálních omezení. Pozorování v této studii byla založena na retrospektivním průřezovém designu, ale nebylo provedeno žádné longitudinální sledování. Úroveň exprese HBsAg v hepatocytech a histologická závažnost se mohou lišit v různých částech jater u jednoho pacienta; jaterní biopsie sama o sobě nemůže přesně reprezentovat žádnou jaterní tkáň kromě bioptického jádra.
Shrnem lze říci, že u pacientů s typem II GGH nebo vyšší úrovní intrahepatální exprese HBsAg se projevuje reciproční vztah mezi závažnější histologickou aktivitou jater a nižší schopností replikace HBV. Silná souvislost mezi intrahepatální expresí HBsAg a mutacemi BCP T1762/A1764 naznačuje, že expresi HBsAg lze pravděpodobně považovat za histologický projev během genomické evoluce HBV pod imunitním tlakem hostitele.
Zkratky
- –
BCP: promotor bazálního jádra.
- –
GGH: hepatocyt z mletého skla.
- –
HBcAg: jádrový antigen hepatitidy B.
- –
HBeAg: antigen hepatitidy B e.
- –
HBsAg: povrchový antigen hepatitidy B.
- –
HBV: virus hepatitidy B.
Konflikty zájmů
T.-.T. C. obdržel finanční prostředky na výzkum od společností Gilead Sciences, Bristol-Myers Squibb Company, Glaxo-SmithKline, Merck Sharp & Dohme (I.A.) Corporation a Pfizer Inc. U ostatních autorů nedošlo ke střetu zájmů.