Úvod
Grampozitivní bakterie rodů Bacillus a Clostridium se mohou diferencovat a vytvářet endospory (spory), metabolicky klidné buňky vznikající v reakci na podmínky, které neumožňují růst buněk (McKenney et al., 2012). Jakmile se spora uvolní do prostředí, přežívá v klidovém stavu extrémně dlouhou dobu a odolává široké škále stresů, jako jsou vysoké teploty, dehydratace, nedostatek živin a přítomnost toxických chemických látek (McKenney et al., 2012). Klidová spóra je však schopna neustále monitorovat prostředí a reagovat na přítomnost vody a živin klíčením a vznikem vegetativní buňky, která je schopna růstu a sporulace (McKenney et al., 2012). Odolnost vůči nefyziologickým podmínkám je částečně dána povrchovými strukturami spór. U Bacillus subtilis, modelového systému pro tvůrce spor, je povrch spor uspořádán ve vícevrstevném plášti a v krustě, nedávno objevené vrstvě, která plášť spor obklopuje (McKenney et al., 2012). Spory B. subtilis jsou negativně nabité (Huang et al., 2010; Pesce et al., 2014) a mají relativní hydrofobicitu, která je částečně způsobena glykosylací některých povrchových proteinů spor (Cangiano et al., 2014; Rusciano et al., 2014). U několika druhů Bacillus a Clostridium, včetně B. cereus, B. anthracis, B. megaterium a C. difficile, je nejvnější strukturou spór exosporium, morfologicky odlišná vrstva složená z proteinů a glykoproteinů, která obklopuje obal (Díaz-González et al., 2015; Manetsberger et al., 2015b; Stewart, 2015).
Bakteriální spóra byla navržena jako platforma pro zobrazení heterologních proteinů s potenciálními aplikacemi od vývoje slizničních vakcín po opakovaně použitelné biokatalyzátory, diagnostické nástroje a bioremediační zařízení (Knecht et al., 2011; Isticato a Ricca, 2014; Ricca et al., 2014). Pozoruhodná a dobře zdokumentovaná odolnost spor (McKenney et al., 2012), přístupnost několika druhů tvořících spory ke genetické manipulaci (Harwood a Cutting, 1990) a bezpečnostní záznamy několika druhů (Cutting, 2011; Baccigalupi et al., 2015) podporují použití spor jako zobrazovacího a doručovacího systému. Byly vyvinuty dvě strategie pro zobrazení heterologních proteinů na povrchu spór. Rekombinantní strategie založená na konstrukci genových fúzí mezi DNA kódující vybraný protein na povrchu spory a DNA kódující protein, který má být zobrazen, byla v průběhu let použita k zobrazení různých heterologních proteinů (Isticato a Ricca, 2014). K zobrazení různých enzymů a antigenů byl použit také nerekombinantní přístup založený na spontánní adsorpci mezi purifikovanými sporami a purifikovanými proteiny (Ricca a kol., 2014). Molekulární detaily řídící adsorpci spor nebyly dosud zcela objasněny. Je známo, že adsorpce je účinnější, když je pH vazebného pufru kyselé (pH 4) (Huang et al., 2010; Sirec et al., 2012) a že se na interakci pravděpodobně podílí kombinace elektrostatických a hydrofobních interakcí (Huang et al., 2010; Sirec et al., 2012). Je také známo, že mutantní spory se silně změněným povrchem spor interagují s modelovými proteiny účinněji než izogenní spory divokého typu (Sirec et al., 2012; Donadio et al.,
Zde jsme použili fluorescenční protein, monomerní formu červeného fluorescenčního proteinu (mRFP) korálovce Discosoma sp. (Campbell et al., 2002), abychom zhodnotili, zda jsou spory B. megaterium schopny interagovat s modelovým heterologním proteinem a adsorbovat jej. B. megaterium zahrnuje řadu morfologicky odlišných kmenů, které sdílejí neobvykle velké rozměry buněk (délka až 4 μm a průměr 1,5 μm) i spor (délka až 3 μm a průměr 1 μm) (Di Luccia et al., 2016). Spory některých kmenů B. megaterium jsou obklopeny exosporiem, a protože dosud byly jako adsorpční platformy uvažovány pouze spory druhů, které exosporium nemají, nejsou k dispozici žádné údaje o vlivu exosporia na interakci s heterologními proteiny.
Kmen QM B1551 je nejlépe charakterizovaným kmenem B. megaterium. Tento kmen nese přibližně 11 % svého genomu na sedmi původních plazmidech (Rosso a Vary, 2005; Vary et al., 2007; Eppinger et al., 2011), z nichž dva – pBM500 a pBM600 – byly identifikovány jako nosiče genů, které jsou nezbytné pro tvorbu charakteristického „ořechového“ exosporia tohoto kmene (Manetsberger et al., 2015a). Složení proteinů exosporia QM B1551 je zatím nedostatečně charakterizováno, genomickými analýzami bylo identifikováno pouze několik genů kódujících ortology rozpoznaných proteinů exosporia u spor jiných druhů. Patří mezi ně geny kódující BclA nap proteiny, které tvoří lokalizovaný nap ve sporách B. megaterium QM B1551, plus ortolog proteinu BxpB, který tvoří bazální vrstvu exosporia ve sporách B. cereus. Zdá se, že posledně jmenovaný protein plní ve sporách B. megaterium QM B1551 jinou úlohu, protože nulový mutantní kmen si zachoval zjevně normální exosporium (Manetsberger et al., 2015a).
V této práci předkládáme údaje, které ukazují, že spory B. megaterium QM B1551 mohou účinně adsorbovat mRFP, a poskytujeme důkaz, že molekuly bílkovin jsou schopny překonat bariéru propustnosti představovanou exosporiem a lokalizovat se v meziplášťovém prostoru.
Materiál a metody
Bakteriální kmeny, spory a produkce RFP
Kmeny B. megaterium použité v této studii jsou QM B1551 a jeho bezplazmidový derivát PV361 (Rosso a Vary, 2005). Kmen B. subtilis použitý v této studii byl PY79 (Youngman a kol., 1984). Sporulace všech kmenů Bacillus byla indukována metodou vyčerpání (Cutting a Vander Horn, 1990). Po 30 hodinách růstu v médiu Difco Sporulation (DS) při 37 °C s intenzivním třepáním byly spory shromážděny a přečištěny podle popisu Nicholsona a Setlowa (1990) za použití noční inkubace v H2O při 4 °C k lyzi zbytkových sporangiálních buněk. Počet získaných přečištěných spor byl měřen přímým počítáním pomocí Bürkerovy komory pod optickým mikroskopem (Olympus BH-2 s 40× objektivem).
Pro produkci mRFP byly použity buňky Escherichia coli kmene RH161 (Donadio et al., 2016), nesoucí expresní vektor pRSET-A nesoucí in-frame fúzi 5′ konce kódující oblasti rfp se šesti histidinovými kodony pod transkripční kontrolou promotoru T7, byly pěstovány 18 h při 37 °C ve 100 ml autoindukčního média pro expresi heterologního proteinu (Isticato et al., 2010). Protein RFP značený His6 byl purifikován za nativních podmínek pomocí kolony His-Trap podle doporučení výrobce (GE Healthcare Life Science). Purifikovaný protein byl odsolen pomocí kolony PD10 (GE Healthcare Life Science), aby se odstranily vysoké koncentrace NaCl a imidazolu.
Adsorpční reakce
Není-li uvedeno jinak, bylo 5 μg purifikovaného rekombinantního mRFP přidáno k suspenzi spor (5 × 108) v 50 mM citrátu sodném pH 4,0 při 25 °C v konečném objemu 200 μl. Po 1 hodině inkubace byla vazebná směs odstředěna (10 min při 13 000 g), aby došlo k frakcionaci mRFP vázaného na spory v peletě od volného mRFP v supernatantu.
Westernova a Dot-Blot analýza
Pelety spor z adsorpčních reakcí byly resuspendovány ve 40 μl pufru pro extrakci pláště spor (Nicholson a Setlow, 1990; Giglio a kol.), 2011), inkubovány při 68 °C po dobu 1 hodiny, aby došlo k solubilizaci proteinů spórového pláště, a naloženy na 12% SDS-PAGE gel. Proteiny byly poté elektricky přeneseny na nitrocelulózové filtry (Amersham Pharmacia Biotech) a použity pro Western blot analýzu, jak bylo uvedeno dříve (Isticato et al., 2008), s použitím monoklonální protilátky anti-His rozpoznávající mRFP (Sigma). Kvantitativní stanovení množství mRFP bylo získáno pomocí dot blot experimentů porovnávajících sériová ředění purifikovaného mRFP a supernatantu vazebného testu. Filtry byly poté vizualizovány metodou ECL-prime (Amersham Pharmacia Biotech) a podrobeny denzitometrické analýze pomocí softwaru Quantity One 1-D Analysis Software (Bio-Rad). Dot blot a relativní denzitometrická analýza byly provedeny třikrát, aby se ověřila významnost výsledků.
Fluorescenční a imunofluorescenční mikroskopie
Po adsorpci byly spory resuspendovány v 50 μl 1x PBS pH 4,0 a 5 μl suspenze umístěno na mikroskopická sklíčka a překryto krycím sklíčkem předem ošetřeným po dobu 30 s poly-L-lysinem (Sigma). Imunofluorescence byla provedena podle popisu Isticata et al. (2013) s následujícími úpravami: 2,0 × 106 RFP-adsorbovaných spor kmenů QM B1551 a PV361 B. megaterium bylo předem ošetřeno 1% bovinním sérovým albuminem (BSA) – 1x PBS pH 4,0 po dobu 30 min před 2 h inkubací při 4 °C s anti-polyHistidinovými protilátkami (myš; Sigma) zředěnými 1:20 v 1x PBS pH 4,0-1% BSA. Jako kontrola specifičnosti této techniky byly neadsorbované spory přímo ošetřeny protilátkami anti-His. Po třech promytích byly vzorky inkubovány s 64krát zředěnou sekundární protilátkou proti myším konjugovanou s fluorescein isothiokyanátem, FITC (Santa Cruz Biotechnology, Inc.), a čtyřikrát promyty 1x PBS pH 4,0. V tomto případě byly vzorky inkubovány se sekundární protilátkou proti myším. Promyté vzorky byly resuspendovány ve 20 μl 1x PBS pH 4,0 a analyzováno bylo 10 μl. Všechny vzorky byly pozorovány fluorescenčním mikroskopem Olympus BX51 vybaveným 100× olejovým objektivem UPlan F1; k detekci červené emise fluorescence mRFP nebo zelené emise protilátek konjugovaných s FITC byly použity kostkové filtry U-MNG nebo U-MWIBBP. Doba expozice se pohybovala v rozmezí 200 až 3000 ms. Snímky byly pořízeny digitálním fotoaparátem Olympus DP70 a zpracovány pomocí softwaru Image Analysis Software (Olympus) pro drobné úpravy jasu, kontrastu a vyvážení barev (McCloy et al., 2014). Program ImageJ (v1.48, NIH) byl použit k vykreslení obrysu kolem 80 spor pro každý kmen a pro každou sporu byly zaznamenány minimální, maximální a průměrné hodnoty fluorescence na pixel. Hodnoty intenzity fluorescence byly následně zobrazeny jako krabicové grafy s 5-95% intervaly spolehlivosti (McCloy et al., 2014).
Statistická analýza
Výsledky analýzy dot blotu a fluorescenční mikroskopie jsou průměry ze tří nezávislých experimentů. Statistická významnost byla stanovena Studentovým t-testem a hladina významnosti byla stanovena na P < 0,05.
Výsledky
mRFP Discosoma sp. je adsorbován B. megaterium
Pro ověření, zda jsou spory B. megaterium QM B1551 schopny adsorbovat mRFP, bylo 5 μg purifikovaného proteinu (Materiály a metody) inkubováno s 5,0 × 108 purifikovanými sporami. Adsorpční reakce byla provedena v 50 mM citrátu sodném při pH 4,0, jak bylo popsáno dříve (Sirec et al., 2012). Po reakci byly spory důkladně promyty 1x PBS pH 4,0, povrchové proteiny spor byly extrahovány podle popisu v Materiálech a metodách a analyzovány metodou western blottingu s protilátkou proti polyHistidin-Peroxidase (Sigma), která rozpoznává histidinem značený N-konec mRFP. Jak ukazuje obrázek 1A, mRFP byl extrahován ze spor, což naznačuje, že byl absorbován během reakce a poté uvolněn extrakční úpravou. Abychom vyhodnotili účinnost adsorpce, analyzovali jsme množství mRFP, které zůstalo nenavázané, tj. spory po adsorpci byly odebrány odstředěním a supernatant byl sériově naředěn a analyzován metodou dot blotting (obrázek 1B). Denzitometrická analýza dot blotu (doplňková tabulka 1) ukázala, že při použití 5 μg mRFP v adsorpční reakci zůstalo nenavázáno méně než 1 %, což naznačuje, že přibližně 99 % heterologního proteinu bylo adsorbováno na spory B. megaterium.

OBRÁZEK 1. Spory Bacillus megaterium QM B1551 adsorbují mRFP. 5 × 108 spor bylo inkubováno s 5 μg purifikovaného mRFP a poté byly vzorky podrobeny centrifugaci. (A) Povrchové proteiny spór byly extrahovány z frakce pelet pomocí SDS-DTT, frakcionovány na SDS-PAGE a analyzovány pomocí Western blotu. Jako marker byl použit purifikovaný mRFP (20 μg). (B) Supernatant obsahující nenavázaný mRFP byl sériově naředěn a analyzován metodou dot blot (QM B1551). Jako standard byla použita sériová ředění purifikovaného mRFP (mRFP). (C) Spory adsorbované mRFP byly dvakrát promyty (W1 a W2) pufrem PBS o pH 3,0 nebo pH 7,0, nebo roztokem 1M NaCl, 0,1 % Triton X-100. Jako standardy byly použity sériové roztoky přečištěného mRFP a nenavázaného mRFP (UN-mRFP). Imunoreakce ve všech panelech byly provedeny s protilátkou anti-His rozpoznávající mRFP konjugovanou s křenovou peroxidázou.
Pro analýzu, zda byly adsorbované molekuly mRFP pevně vázány na povrch spór, byly spóry po adsorpční reakci dvakrát promyty pufrem PBS o pH 3,0 nebo pH 7,0 nebo roztokem 1M NaCl, 0,1 % Triton X-100, jak bylo popsáno dříve (Donadio et al., 2016). Jak ukazuje obrázek 1C a potvrzuje denzitometrická analýza dot blotu (doplňková tabulka 2), promývání při pH 3,0 nezpůsobilo žádné uvolnění adsorbovaného mRFP, zatímco promývání při pH 7,0 nebo s 1M NaCl, 0,1 % Triton X-100 způsobilo minimální, méně než 1% uvolnění molekul mRFP. Výsledky uvedené na obrázku 1 tedy naznačují, že mRFP byl účinně adsorbován a pevně vázán na spory B. megaterium. Abychom posoudili, zda si molekuly mRFP adsorbované na spory zachovaly své fluorescenční vlastnosti, provedli jsme analýzu fluorescenčním mikroskopem. Jak ukazuje obrázek 2, reakční spory po adsorpci byly spojeny se silným fluorescenčním signálem viditelným po celém povrchu spory.
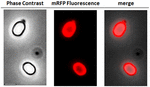
OBRÁZEK 2. Analýza spor B. megaterium QM B1551-mRFP pomocí fluorescenční mikroskopie. Spory QM B1551 inkubované s mRFP (5 μg) a následně promyté byly analyzovány pomocí fluorescenční mikroskopie. Stejné mikroskopické pole bylo pozorováno fázovým kontrastem a fluorescenční mikroskopií. Měřítko 1 μm. Uvádí se sloučený panel. Doba expozice byla 200 ms.
Exosporium má zásadní roli v adsorpci mRFP
Kmen QM B1551 B. megaterium obsahuje sedm původních plazmidů (Rosso a Vary, 2005; Eppinger et al., 2011) a geny kódované plazmidy jsou nezbytné pro tvorbu exosporia (Manetsberger et al., 2015a). PV361 je kultivovaný kmen QM B1551, který postrádá všech sedm plazmidů, a v důsledku toho zcela postrádá exosporium (Manetsberger et al., 2015a). K analýze úlohy exosporia při adsorpci mRFP jsme použili spory kmene PV361. Souběžně jsme použili také spory kmene B. subtilis PY79, u kterých bylo v předchozí studii prokázáno, že adsorbují mRFP (Donadio et al., 2016). Pro porovnání účinnosti adsorpce spor kmenů B. subtilis PY79 a B. megaterium QM B1551 a PV361 jsme adsorbovali 5 μg purifikovaného mRFP pomocí 5,0 × 108 spor každého ze tří kmenů. Po adsorpčních reakcích byly spory shromážděny centrifugací, proteiny extrahovány úpravou SDS-DTT a analyzovány pomocí western blotu s protilátkou anti-His rozpoznávající mRFP. Jak ukazuje obrázek 3A, mRFP byl zřejmě extrahován ve větším množství ze spor QM B1551 než ze spor ostatních dvou kmenů. Ve snaze kvantifikovat tyto zjevné rozdíly byl nenavázaný mRFP z adsorpčních reakcí sériově naředěn a analyzován metodou dot blottingu (obrázek 3B). Denzitometrická analýza dot blotu na obrázku 3B (doplňková tabulka 3) ukázala, že spory PY79 a PV361 adsorbovaly přibližně 90 % celkového mRFP, zatímco spory QM B1551 adsorbovaly téměř všechen (více než 99 %) přečištěný mRFP.
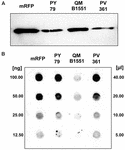
OBRÁZEK 3. Adsorpce monomerního červeného fluorescenčního proteinu na spory B. megaterium QM B1551 a PV361 a B. subtilis PY79. 5 × 108 spor každého kmene bylo inkubováno s 5 μg purifikovaného mRFP a poté byly vzorky podrobeny centrifugaci. Spory ve frakcích pelet byly použity k extrakci povrchových proteinů, které byly následně analyzovány metodou western blot (A), zatímco supernatanty byly sériově ředěny a analyzovány metodou dot blot (B). Jako standardy byly použity sériové ředění purifikovaného mRFP. Imunoreakce v obou panelech byly provedeny s protilátkou anti-His konjugovanou s křenovou peroxidázou.
Účinnost adsorpce spor tří kmenů byla rovněž analyzována pomocí fluorescenční mikroskopie (obrázek 4A a doplňkový obrázek S1). Mikroskopické snímky byly analyzovány pomocí softwaru ImageJ (v1.48, NIH) k provedení kvantitativní analýzy fluorescenčních snímků a fluorescence spor byla vypočtena podle popisu v části Materiály a metody. Analýza 80 spor každého kmene ukázala průměrnou hodnotu fluorescence na pixel 52,43 (± 5,94), 20,81 (± 2,71) a 32,33 (± 2.97; arbitrární jednotky) pro QM B1551, PV361 a PY79 (Obrázek 4B), což poskytuje další důkaz, že spory QM B1551 adsorbovaly více mRFP než spory ostatních dvou kmenů.
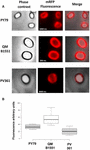
OBRÁZEK 4. Účinnost adsorpce mRFP na spory kmenů B. megaterium QM B1551 a PV361 a B. subtilis PY79. (A) Fluorescenční mikroskopické snímky spor PY79, QM B1551 a PV361 po adsorpci mRFP a promytí. Doba expozice je vyznačena. Jsou zobrazeny překryvy fázového kontrastu a červené fluorescence (slučovací panel). Měřítka 1 μm. (B) Krabicové grafy zobrazující intenzitu fluorescence osmdesáti různých spor každého kmene. Hranice každého boxu představují první a třetí kvartil (25 a 75 %) a hodnoty mimo boxy představují maximální a minimální hodnoty. Čára oddělující box označuje mediánovou hodnotu pro každý kmen. Hodnota P je menší než 0,0001.
Na základě výsledků na obrázcích 3 a 4 jsme dospěli k závěru, že exosporium, které je přítomno u QM B1551 a chybí u PV361, má relevantní roli v adsorpci mRFP.
Výsledky z obrázku 4 navíc ukázaly, že spory B. subtilis PY79 jsou při adsorpci mRFP účinnější než spory B. megaterium PV361, zatímco dot blotting uvedený na obrázku 3B ukázal podobnou účinnost adsorpce u obou kmenů. Domníváme se, že tento rozdíl je způsoben silným snížením fluorescence, když se mRFP váže na spory PV361, ale ne na spory PY79 nebo QM B1551 (viz níže).
Kvantitativní hodnocení adsorpce mRFP na spory kmene QM B1551
Experimenty s bodovou skvrnou (obr. 3B) ukázaly, že při použití 5 μg purifikovaného mRFP v adsorpčních reakcích s 5,0 × 108 sporami kmene QM B1551 se na spory navázal téměř celý heterologní protein. Abychom určili maximální množství mRFP, které může být adsorbováno na spory kmene QM B1551, opakovali jsme reakce s rostoucími koncentracemi purifikovaného mRFP, tj. 5,0 × 108 spor kmene QM B1551 reagovalo s 5, 10, 20, 40, 80 a 160 μg purifikovaného mRFP. Po reakcích byly spory shromážděny centrifugací a supernatanty obsahující nenavázaný mRFP byly sériově naředěny a analyzovány metodou dot blottingu (obrázek 5A). Na obrázku 5B jsou zobrazeny výsledky denzitometrické analýzy dot blotu (??), které ukazují, že při reakci 5-80 μg mRFP s 5 × 108 spor bylo procento proteinu vázaného na spory více než 90 %. Pokles vázaného mRFP byl pozorován, když bylo v reakci použito 160 μg purifikovaného proteinu. Nicméně i při použití 160 μg purifikovaného mRFP bylo absorbováno více než 60 % proteinu, což naznačuje, že 5,0 × 108 spor QM B1551 může adsorbovat přibližně 100 μg mRFP.
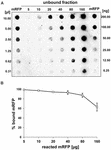
OBRÁZEK 5. Kvantitativní hodnocení adsorpce mRFP na spory B. megaterium QM B1551. 5 × 108 spor bylo inkubováno s 5, 10, 20, 40, 80 a 160 μg purifikovaného mRFP. Reakční směsi byly následně centrifugovány a supernatanty byly sériově naředěny a analyzovány metodou dot blot (A). Jako standardy byly použity sériové ředění purifikovaného mRFP. Imunoreakce v obou panelech byly provedeny s protilátkou anti-His konjugovanou s křenovou peroxidázou. (B) Procento mRFP adsorbovaného na spory po reakci s definovaným množstvím endogenního mRFP. Chybové úsečky ukazují směrodatné chyby průměru ze tří experimentů a hodnotu P nikdy vyšší než 0,0025.
mRFP se lokalizuje v meziplášťovém prostoru u spor B. megaterium QM B1551
K posouzení, zda jsou adsorbované molekuly mRFP vystaveny na povrchu spor B. megaterium QM B1551, byl použit přístup imunofluorescenční mikroskopie. Spóry QM B1551 adsorbované různým množstvím mRFP byly zreagovány s monoklonální protilátkou anti-His rozpoznávající rekombinantní mRFP, poté s fluorescenční sekundární protilátkou proti myším (Santa Cruz Biotechnology, Inc.) a pozorovány pod fluorescenčním mikroskopem (obr. 6). Při nejnižším množství mRFP použitém v tomto experimentu (2 μg) byl fluorescenční signál mRFP (červený) pozorován v celém okolí spory, zatímco imunofluorescenční signál (zelený) byl slabý a soustředil se hlavně na pólech spory, což naznačuje, že pouze v těchto místech byl mRFP vystaven na povrchu spory. Se zvyšujícím se množstvím mRFP použitého v reakci se počet zelených skvrn zvyšoval (5 a 10 μg) a při nejvyšším množství mRFP použitého v reakci (20 μg) byl kolem spory pozorován téměř úplný zelený prstenec. Na základě výsledků uvedených na obrázku 6 jsme předpokládali, že molekuly mRFP pronikají exosporiem a lokalizují se v meziplášťovém prostoru mezi vnějším pláštěm a exosporiem, tj. při použití nízkého množství mRFP jsou téměř všechny molekuly proteinu uvnitř exosporia a jsou dostupné protilátce pouze na několika místech. Zvyšující se množství mRFP v adsorpčních reakcích vede k „zaplnění“ meziplášťového prostoru, až je nakonec protilátce k dispozici více molekul mRFP na povrchu spory. Z této hypotézy vyplývá, že pokud exosporium chybí, měly by být všechny mRFP dostupné protilátce. Abychom to ověřili, porovnali jsme pomocí imunofluorescenční mikroskopie stejný počet spor QM B1551 (s exosporiem) a PV361 (bez exosporia) inkubovaných se stejným množstvím mRFP (5 μg). Pokud bylo přítomno exosporium (QM B1551), byl mRFP pro protilátku dostupný pouze částečně a byly pozorovány zelené skvrny (obrázek 7 a doplňkový obrázek S2). Když exosporium nebylo přítomno (PV361), adsorbovaný mRFP byl pro protilátku dostupný po celém obvodu spory a vytvořil se kompletní zelený prstenec, což podporuje hypotézu, že mRFP je ve sporách QM B1551 uvnitř exosporia.
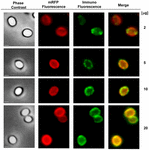
Obr. 6. Imunofluorescenční analýza spor B. megaterium QM B1551 s adsorbovaným mRFP. Alikvoty 5 × 108 spor QM B1551 byly inkubovány s různými koncentracemi mRFP a následně analyzovány pomocí fázového kontrastu, fluorescenční a imunofluorescenční mikroskopie, jak je popsáno v Materiálech a metodách. Stejné mikroskopické pole pro každou reakci je uvedeno spolu se sloučeným panelem. Doba expozice byla u všech snímků 200 ms. Měřítko, 1 μm.
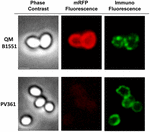
Obrrázek 7. Imunofluorescence mRFP adsorbovaného na spory B. megaterium QM B1551 a PV361. 5 × 108 spor QM B1551 a PV361 bylo inkubováno s 5 μg mRFP a poté analyzováno imunofluorescenční mikroskopií, jak je popsáno v části Materiály a metody. Pro každé pole je zobrazen fázový kontrast a imunofluorescenční mikroskopie. Doba expozice byla u všech snímků 200 ms. Měřítko 1 μm.
Zatímco spory QM B1551 použité v experimentech na obrázku 7 vykazovaly kompletní červený fluorescenční prstenec jako na obrázku 2, spory PV361 vykazovaly velmi slabý červený fluorescenční signál. U spor PV361 byl červený signál pozorován pouze při použití dlouhých expozičních časů ve fluorescenčním mikroskopu (obrázek 4). Vzhledem k tomu, že mRFP je přítomen v okolí spor PV361 (obrázky 3 a 7), dospěli jsme k závěru, že fluorescence mRFP je oslabena, když je protein adsorbován na spory PV361. K úplnému vyřešení tohoto bodu budou zapotřebí další experimenty.
Diskuse
Hlavní zjištění této zprávy jsou, že spory B. megaterium jsou mimořádně účinné při adsorpci heterologního modelového proteinu mRFP, že exosporium má v tomto procesu důležitou roli a že molekuly mRFP pronikají exosporiem a lokalizují se mezi vnějším pláštěm a exosporiem. Tyto výsledky rozšiřují předchozí práci provedenou na sporách B. subtilis a ukazují, že k dodávání heterologních proteinů adsorpční metodou lze použít i spory jiného druhu. Vysoká účinnost adsorpce pozorovaná u spor B. megaterium je částečně způsobena velkou velikostí jeho spor ve srovnání se sporami B. subtilis. Povrch spory B. megaterium je totiž asi 2,5krát větší než povrch spory B. subtilis, s povrchem 5,33 μm2 (h: 1,60 ± 0,16 w: 0,84 ± 0,07) oproti 1,98 μm2 (h: 1,07 ± 0,09 w: 0,48 ± 0,03). Velké rozměry umožňují adsorpci až 100 μg mRFP při reakci 160 μg proteinu se sporami.
Pozorování, že mRFP prochází exosporiem, naznačuje, že je propustné pro mRFP, protein o hmotnosti 27 kDa. Propustnost exosporu není zcela překvapivá, protože zárodečné látky přítomné v prostředí musí projít vnějšími vrstvami spory, aby se dostaly ke svým receptorům, i když zárodečné látky jsou obvykle malé molekuly s molekulovou hmotností obvykle <200 Da. Kromě toho jsou údaje mRFP v zásadě v souladu s výsledky předchozích studií provedených se značenými dextrany a příbuznými molekulami (Koshikawa et al., 1984; Nishihara et al., 1989). V těchto studiích bylo navrženo, že exosporium B. megaterium QM B1551 představuje bariéru propustnosti pro molekuly s molekulovou hmotností větší než 100 KDa, přičemž ovlivňuje průchod molekul s hmotností někde mezi 2 a 40 kDa (Koshikawa et al., 1984; Nishihara et al., 1989).
Zajímavou výzvou pro budoucí práci bude stanovit mechanismus nebo cestu průniku, kterou se mRFP, a odvozeně i další heterologní proteiny, které jsou předmětem zájmu, dostávají do meziplášťového prostoru. Zkoumání rozřezaných spor B. megaterium QM B1551 transmisní elektronovou mikroskopií ukazuje, že exosporium se skládá ze dvou identických „skořápek“ (Manetsberger et al., 2015a), a je možné, že rozhraní mezi každou z těchto struktur (v prvních pracích popsané jako „apikální otvory“) umožňuje průnik relativně velkých molekul. Zajímavé bude také rozeznat, na základě čeho dochází ke zjevné ztrátě fluorescence mRFP po adsorpci na spory PV361 a zda jsou molekuly mRFP schopny pronikat do vrstev vnějšího pláště, jak bylo pozorováno u spor B. subtilis (Donadio et al., 2016).
V současné studii předpokládáme, že molekuly mRFP přednostně překračují exosporium a hromadí se v meziplášťovém prostoru mezi vnějším pláštěm a exosporiem. V tomto modelu jsou molekuly mRFP adsorbovány a zobrazeny na povrchu spory až poté, co jsou adsorpční místa (nebo objemová kapacita?) v meziplášťovém prostoru dostatečně obsazena. Z toho vyplývá, že adsorpční přístup k povrchovému zobrazení lze použít u spor B. megaterium QM B1551, ačkoli systém závisí na poměru spory a proteinu použitém v adsorpčních reakcích. Vzhledem k tomu, že různé kmeny B. megaterium se již dlouho průmyslově využívají k výrobě enzymů, jako jsou amylázy a dehydrogenázy, vitaminy a antimikrobiální molekuly (Vary et al., 2007), naše údaje naznačují nové biotechnologické využití spor B. megaterium jako nosiče pro vazbu a dodávku heterologních proteinů.
Příspěvky autorů
ML a GD – provedli většinu experimentů; RA a AS – přispěli k interpretaci dat pro práci; GiC, LB a GrC – přispěli k vypracování práce a jejímu kritickému přepracování; ER – přispěl k diskusím a návrhům v průběhu práce a podílel se na psaní rukopisu; RI – vedl práci a podílel se na psaní rukopisu. Všichni autoři přečetli a schválili konečnou verzi rukopisu.
Financování
Tato práce byla podpořena grantem (STAR Linea1- 2014) Univerzity Federico II v Neapoli a společnosti Compagnia di San Paolo, Itálie pro RI.
Prohlášení o střetu zájmů
Autoři prohlašují, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Přídavné materiály
Přídavné materiály k tomuto článku naleznete online na adrese: https://www.frontiersin.org/article/10.3389/fmicb.2016.01752/full#supplementary-material
Obrázek S1 | Snímky celého pole z analýzy fluorescenční mikroskopie uvedené na obrázku 4. Stejné mikroskopické pole bylo pozorováno pomocí fázového kontrastu a fluorescenční mikroskopie. Měřítko 5 μm. Uvádí se sloučení panelů. Je uvedena doba expozice.
OBRÁZEK S2 | Snímky celého pole imunofluorescenční analýzy uvedené na obrázku 7. Stejné mikroskopické pole bylo pozorováno fázovým kontrastem a fluorescenční mikroskopií. Měřítko 5 μm. Doba expozice byla u všech snímků 200 ms.
OBRÁZEK S1 | Denzitometrická analýza dot blot experimentů se supernatanty adsorpční reakce se sporami QM B1551 (obrázek 1B).
TABULKA S2 | Denzitometrická analýza dot blot experimentů se supernatanty různých promývání po adsorpční reakci (obrázek 1C).
TABULKA S3 | Denzitometrická analýza dot blot experimentů se supernatanty adsorpční reakce provedené se sporami kmenů PY79, QM B1551 a PV361 (obrázek 3B).
TABULKA S4 | Denzitometrická analýza dot blot experimentů se supernatanty adsorpční reakce provedené s různými množstvími mRFP.
Baccigalupi, L., Ricca, E., and Ghelardi, E. (2015). „Non-LAB probiotics: spore Formers,“ in Probiotics and Prebiotics: Current Research and Future Trends, eds K. Venema and A. P. do Carmo (Norfolk, VA: Caister Academic Press), 93-103. doi: 10.21775/9781910190098.06
CrossRef Full Text | Google Scholar
Campbell, R. E., Tour, O., Palmer, A. E., Steinbach, P. A., Baird, G. S., Zacharias, D. A. a další (2002). Monomerní červený fluorescenční protein. Proc. Natl. Acad. Sci. U.S.A. 99, 7877-7882. doi: 10.1073/pnas.082243699
PubMed Abstract | CrossRef Full Text | Google Scholar
Cangiano, G., Sirec, T., Panarella, C., Isticato, R., Baccigalupi, L., De Felice, M., et al. (2014). Produkty genu sps ovlivňují klíčení, hydrofobicitu a adsorpci proteinů spor Bacillus subtilis. Appl. environ. Microbiol. 80, 7293-7302. doi: 10.1128/AEM.02893-14
PubMed Abstract | CrossRef Full Text | Google Scholar
Cutting, S. M. (2011). Probiotika rodu Bacillus. Food Microbiol. 28, 214-220. doi: 10.1016/j.fm.2010.03.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Cutting, S., and Vander Horn, P. B. (1990). „Genetic analysis,“ in Molecular Biological Methods for Bacillus, eds C. Harwood and S. Cutting (Chichester: John Wiley and Sons), 27-74.
Google Scholar
Díaz-González, F., Milano, M., Olguin-Araneda, V., Pizarro-Cerda, J., Castro-Córdova, P., Tzeng, S. C., et al. (2015). Proteinové složení nejzevnější vrstvy podobné exosporiu spór Clostridium difficile 630. J. Proteom. 123, 1-13. doi: 10.1016/j.jprot.2015.03.035
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Luccia, B., D’Apuzzo, E., Varriale, F., Baccigalupi, L., Ricca, E., and Pollice, A. (2016). Bacillus megaterium SF185 indukuje stresové dráhy a ovlivňuje distribuci buněčného cyklu lidských střevních epiteliálních buněk. Benef. Microb. 7, 609-620. doi: 10.3920/BM2016.0020
PubMed Abstract | CrossRef Full Text | Google Scholar
Donadio, G., Lanzilli, M., Sirec, T., Ricca, E., and Isticato, R. (2016) Protein adsorption and localization on wild type and mutant spores of Bacillus subtilis. Microb. Cell Fact. 15:153. doi: 10.1186/s12934-016-0551-2
PubMed Abstract | CrossRef Full Text
Eppinger, M., Bunk, B., Johns, M. A., Edirisinghe, J. N., Kutumbaka, K. K., Koenig, S. S., et al. (2011). Sekvence genomu biotechnologicky významných kmenů Bacillus megaterium QM B1551 a DSM319. J. Bacteriol. 193, 4199-4213. doi: 10.1128/JB.00449-11
PubMed Abstract | CrossRef Full Text | Google Scholar
Giglio, R., Fani, R., Isticato, R., De Felice, M., Ricca, E., and Baccigalupi, L. (2011). Organizace a evoluce genů cotG a cotH bakterie Bacillus subtilis. J. Bacteriol. 193, 6664-6673. doi: 10.1128/jb.06121-11
PubMed Abstract | CrossRef Full Text | Google Scholar
Harwood, C. R., and Cutting, S. M. (1990). Molekulárně biologické metody pro bacily. Chichester: John Wiley and Sons.
Google Scholar
Huang, J. M., Hong, H. A., Van Tong, H., Hoang, T. H., Brisson, A., and Cutting, S. M. (2010). Slizniční podání antigenů pomocí adsorpce na bakteriální spory. Vaccine 28, 1021-1030. doi: 10.1016/j.vaccine.2009.10.127
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Pelosi, A., De Felice, M., and Ricca, E. (2010). CotE se váže na CotC a CotU a zprostředkovává jejich interakci během tvorby pláště spór u Bacillus subtilis. J. Bacteriol. 192, 949-954. doi: 10.1128/JB.01408-09
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Pelosi, A., Zilhão, R., Baccigalupi, L., Henriques, A. O., De Felice, M., et al. (2008). Heterodimerizace CotC-CotU během sestavování pláště spór Bacillus subtilis. J. Bacteriol. 190, 1267-1275. doi: 10.1128/JB.01425-07
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., and Ricca, E. (2014). Zobrazení povrchu spor. Microbiol. Spectr. 2, 351-366. doi: 10.1128/microbiolspec.TBS-0011-2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Isticato, R., Sirec, T., Treppiccione, L., Maurano, F., De Felice, M., Rossi, M., et al. (2013). Nerekombinantní zobrazení podjednotky B tepelně labilního toxinu Escherichia coli na sporách divokého typu a mutantních sporách Bacillus subtilis. Microb. Cell Fact. 12:98. doi: 10.1186/1475-2859-12-98
PubMed Abstract | CrossRef Full Text | Google Scholar
Knecht, L. D., Pasini, P., and Daunert, S. (2011). Bakteriální spory jako platformy pro bioanalytické a biomedicínské aplikace. Anal. Bioanal. Chem. 400, 977-989. doi: 10.1007/s00216-011-4835-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Koshikawa, T., Beaman, T. C., Pankratz, H. S., Nakashio, S., Corner, T. R., and Gerhardt, P. (1984). Odolnost, klíčení a korelace propustnosti spor Bacillus megaterium postupně zbavených obalových vrstev. J. Bacteriol. 159, 624-632.
PubMed Abstract | Google Scholar
Manetsberger, J., Hall, E. A. H., and Christie, G. (2015a). Geny kódované plazmidy ovlivňují sestavení a morfologii exospor u spor Bacillus megaterium QM B1551. FEMS Microbiol. Lett. 362:fnv147. doi: 10.1093/femsle/fnv147
PubMed Abstract | CrossRef Full Text | Google Scholar
Manetsberger, J., Manton, J. D., Erdelyi, M. J., Lin, H., Rees, D., Christie, G., et al. (2015b). Elipsoidní lokalizační mikroskopie umožňuje odvodit velikost a pořadí vrstev proteinů v obalech spor Bacillus. Biophys. J. 109, 2058-2066. doi: 10.1016/j.bpj.2015.09.023
PubMed Abstract | CrossRef Full Text | Google Scholar
McCloy, R., Rogers, S., Caldon, E., Lorca, T., Castro, A., and Burgess, A. (2014). Částečná inhibice Cdk1 ve fázi G2 překonává SAC a odděluje mitotické děje. Cell Cycle 13, 1400-1412. doi: 10.4161/cc.28401
PubMed Abstract | CrossRef Full Text | Google Scholar
McKenney, P. T., Driks, A., and Eichemberger, P. (2012). Endospory Bacillus subtilis: sestavení a funkce vícevrstvého pláště. Nat. Rev. Microbiol. 11, 33-44. doi: 10.1038/nrmicro2921
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicholson, W. L., and Setlow, P. (1990). „Sporulation, germination and out-growth,“ in Molecular biological methods for Bacillus, eds C. Harwood and S. Cutting (Chichester: John Wiley and Sons), 391-450.
Google Scholar
Nishihara, T., Takubo, Y., Kawamata, E., Koshikawa, T., Ogaki, J. a Kondo, M. (1989). Role vnějšího pláště v odolnosti spor Bacillus megaterium. J. Biochem. 106, 270-273.
PubMed Abstract | Google Scholar
Pesce, G., Rusciano, G., Sirec, T., Isticato, R., Sasso, A., and Ricca, E. (2014). Měření povrchového náboje a hydrodynamického koeficientu spor Bacillus subtilis pomocí optické pinzety. Colloids Surf. B Biointerfaces 116C, 568-575. doi: 10.1016/j.colsurfb.2014.01.039
PubMed Abstract | CrossRef Full Text | Google Scholar
Ricca, E., Baccigalupi, L., Cangiano, G., De Felice, M., and Isticato, R. (2014). Slizniční podání vakcíny pomocí nerekombinantních spor Bacillus subtilis. Microb. Cell Fact. 13, 115. doi: 10.1186/s12934-014-0115-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Rosso, M. L., and Vary, P. S. (2005). Distribuce plazmidů Bacillus megaterium QM B1551 mezi dalšími kmeny B. megaterium a druhy Bacillus. Plasmid 53, 205-217. doi: 10.1016/j.plasmid.2004.10.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Rusciano, G. Zito, G., Isticato, R., Sirec, T., Ricca, E., Bailo, E., and Sasso, A. (2014). Chemické zobrazování spor Bacillus subtilis v nanoměřítku kombinací Ramanova rozptylu zesíleného hroty a pokročilých statistických nástrojů. ACS Nano 8, 12300-12309. doi: 10.1021/nn504595k
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirec, T., Strazzulli, A., Isticato, R., De Felice, M., Moracci, M., and Ricca, E. (2012). Adsorpce beta-galaktosidázy Alicyclobacillus acidocaldarius na spory divokého typu a mutanty Bacillus subtilis. Microb. Cell Fact. 11:100. doi: 10.1186/1475-2859-11-100
PubMed Abstract | CrossRef Full Text | Google Scholar
Stewart, G. C. (2015). Exosporiová vrstva bakteriálních spor: spojení s prostředím a infikovaným hostitelem. Microbiol. Mol. Biol. Rev. 79, 437-457. doi: 10.1128/MMBR.00050-15
PubMed Abstract | CrossRef Full Text | Google Scholar
Vary, P. S., Biedendieck, R., Fuerch, T., Meinhardt, F., Rohde, M., Deckwer, W.-D., et al. (2007). Bacillus megaterium – od jednoduché půdní bakterie k hostiteli průmyslové produkce proteinů. Appl. Microbiol. Biotechnol. 76, 957-967 doi: 10.1007/s00253-007-1089-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Youngman, P., Perkins, J. B., and Losick, R. (1984). Nová metoda rychlého klonování chromozomální DNA Bacillus subtilis v Escherichia coli v sousedství inzerce Tn917. Mol. Gen. Genet. 195, 424-433. doi: 10.1007/BF00341443
CrossRef Full Text | Google Scholar
.