Úvod
Rýže má komplexní kořenovou architekturu se směsí embryonálních a postembryonálních kořenů. Během klíčení se nejprve objevuje radikula, brzy poté následují embryonální koronární kořeny (Rebouillat et al., 2009; Coudert et al., 2010). První adventivní postembryonální kořeny vzniklé činností výhonkového apikálního meristému se objevují několik dní po vyklíčení semenáčků. Adventitivní kořeny se nazývají také koronární nebo korunní kořeny a vznikají po celý život rostliny.
Vnitřní anatomie kořenů rýže je dobře popsána, zejména ve fázích semenáčků (Rebouillat et al., 2009). Mezi epidermis a cévními pletivy se nachází několik koncentrických tkání (od periferie ke stéle) (obr. 1). Tato pletiva, souhrnně označovaná jako „přízemní pletiva“, se někdy označují také jako „kůra“ (Lux et al., 2004). Zde zachováváme obecný termín, tj. přízemní tkáň, pro popis exodermální, sklerenchymatické, kortikální a endodermální tkáně. Jako „kůru“ označujeme tkáň nacházející se mezi endodermis a sklerenchymem.
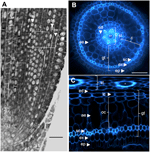
Figure 1. Anatomie 6denního radikulu Nipponbare. (A) Podélný řez radikulí fixovanou a zalitou paraplastem. Sloupek = 100 μm. (B) Příčný řez čerstvou radikulí pozorovaný v UV světle. Sloupek = 50 μm. (C) Polární transformovaný pohled B. Vrstvy tkání jsou označeny takto: stéla (st), přízemní tkáň (gt) složená z několika buněčných vrstev: jedna vrstva endodermis (ed), několik vrstev kůry (c), jedna vrstva sklerenchymu (sc) a jedna vrstva exodermis (ex). Vrstvy endodermis (ed) a exodermis (ex) lze snadno identifikovat podle absence/snížení fluorescence v centrech buněčných stěn těchto buněk. Řapík je chráněn jednou vrstvou epidermis (ep). Lze identifikovat dva typy korových vrstev: vnitřní kůru (ic), která sousedí s endodermis (ed), a vnější kůru (oc), která nakonec vytvoří aerenchym (ae). Ve stéle si všimněte přítomnosti velkého centrálního metaxylemu (cx), který je obklopen 6 metaxylemovými (x) cévami.
Zemská tkáň se skládá z několika vrstev tkání, které mají stejný parenchymatózní původ, ale různé specifické vlastnosti, které hrají v kořenech různé a důležité strukturní a funkční role. Například exodermis a endodermis jsou apoplastické bariéry, které řídí radiální transport vody a živin z půdy do fotosyntetických orgánů, což je většinou zajištěno ukládáním suberinových lamel a sekundární diferenciací buněčné stěny (Gregory, 2006). Sklerenchym jsou lignifikované buňky, které představují kritickou bariéru pro některé kovy a pravděpodobně hrají roli mechanické podpory (Huang et al., 2012). Na rozdíl od těchto tří jednovrstevných tkání se kortikální tkáň v rýžovém radikulu skládá ze čtyř nebo pěti vrstev. Tato tkáň, nazývaná také střední kůra nebo mezodermis, se vyznačuje schizogenní tvorbou prostorů, což u rýže vede k tvorbě aerenchymu (Justin a Armstrong, 1991; Kawai a kol., 1998). Aerenchym hraje významnou roli v toleranci k podmínkám zaplavení a zajišťuje nepřetržitý tok kyslíku z výhonu do kořene, což umožňuje růst kořene v anoxických podmínkách. Kůra má důležitou, ale proměnlivou funkci ve fyziologii kořenů mnoha druhů a podílí se na skladování, toleranci k zaplavení nebo symbiotických interakcích (Lux et al., 2004).
Radikulové a korunové kořeny vytvářejí tři typy postranních kořenů: malé postranní kořeny (SLR) a dva typy velkých postranních kořenů (Kawata a Shibayama, 1965; Kono et al., 1972; Rebouillat et al., 2009). Toto rozdělení je založeno na (i) průměru kořenů: SLR jsou nejmenší (50-60 μm) a L-LLR jsou největší (120-150 μm), (ii) větvení, které se vyskytuje pouze u LLR, (iii) přítomnost centrální metaxylemové cévy pouze u LLR a (iv) přítomnost sklerenchymové vrstvy pouze u L-LLR (Kono a kol., 1972; Kawata a kol., 1977; Rebouillat a kol., 2009). Navzdory této klasifikaci zůstává identita vnitřních kořenových pletiv u postranních kořenů, zejména SLR, nejistá. Rebouillat et al (2009) i Kawata et al (1977) totiž tvrdí, že přízemní tkáň SLR se skládá z endodermis, sklerenchymu a exodermis (zevnitř směrem ven), zatímco u Kono et al. (1972) popsali, že u SLR a T-LLR chybí sklerenchymatická vrstva buněk vnitřní kůry.
Pro vyřešení tohoto dilematu a pro studium vývoje a funkce jednotlivých tkání obecně je nutné použít markery identity. Většina dosud používaných tkáňových markerů jsou morfologické markery nebo histochemická barviva, která poskytovala užitečný způsob charakterizace buněčné identity. Berberin odhaluje přítomnost suberinu v buněčných stěnách, který se nachází téměř výhradně v kaspariových proužcích obklopujících každou jednotlivou buňku endodermis, a je tak dobrým nepřímým markerem identity endodermis (Brundett et al., 1988). U A. thaliana byly také vyvinuty tkáňově specifické markery pomocí tkáňově specifických promotorů spojených s reportérovými geny (GUS a/nebo GFP) v geneticky modifikovaných rostlinách. Například promotor SCARECROW se používá jako marker endodermální identity (Sugimoto et al., 2010). Linie QC25 a QC46 enhancer trap GUS (Sabatini et al., 2003) a QHB u rýže (Kamiya et al., 2003) byly také identifikovány jako markery klidového centra (QC) na základě jejich exprese specifické pro QC. Navzdory zájmu o tyto markery je jich k dispozici pouze několik a téměř výhradně u A. thaliana. Mají také své nevýhody. Například vhodnost použití promotoru SCARECROW (SCR) jako markeru „endodermis“ je sporná, pokud se řeší konkrétní otázky týkající se role SCR a SHORT ROOT (SHR) v diferenciaci přízemní tkáně. Geny SCR a SHR se totiž samy o sobě podílejí na tvorbě endodermis/kortexu (Wu a Gallagher, 2014). U A. thaliana jsou jedinými dostupnými markery kořenové kůry promotory Co2 a Co3 (Heidstra et al., 2004; Ten Hove et al., 2010). U rýže se tyto markery kůry zatím nepoužívají, protože pro geny Co2 a Co3 neexistují jasné ortology. U rýže se dosud používají pouze nepřímé morfologické markery, jako je tvorba aerenchymu pro určení kortikální identity (Rebouillat et al., 2009).
Další třídou markerů jsou komerčně dostupné protilátky namířené proti buněčným stěnám rostlin (http://www.plantprobes.net/index.php). Tyto markery byly v minulosti používány jen zřídka, ale jejich účinnost byla prokázána. Například protilátky proti buněčným stěnám CCRC-M2 a JIM13 byly použity u A. thaliana k prokázání, že jediná vrstva vnitřního pletiva přítomná u mutanta shr má kortikální identitu, zatímco vrstva přízemního pletiva mutanta scr vykazuje více identit (Di Laurenzio et al., 1996; Helariutta et al., 2000). Tyto markery mají mnoho výhod: jejich jednoduchost a možnost kombinovat sekundární protilátky spojené s různými fluorochromy, aby se omezilo překrývání s autofluorescencí, nevyžadují genetickou transformaci a lze je použít jako doplněk jiných tříd markerů.
V tomto článku nejprve popisujeme jednoduchý středně výkonný protokol pro imunoznačení čerstvých tkáňových řezů z vibratomu. Pomocí tohoto protokolu jsme provedli screening radiálních řezů rýžových radikulí pomocí velké knihovny 174 protilátek proti buněčným stěnám. Mezi nimi jsme identifikovali osm markerů specifických pro kortex a prokázali, že rýže má dva typy kortikálních tkání s odlišnou identitou. Tyto vrstvy jsme nazvali vnitřní a vnější kůra na základě jejich příslušné anatomické polohy v kořenových řezech. Abychom prokázali užitečnost těchto markerů specifických pro kůru, objasnili jsme identitu půdních tkání postranních kořenů pomocí tří z těchto protilátek. Zejména u SLR jsme ukázali, že vnitřní vrstva tkáně má identitu vnější kůry. Náš protokol je dostatečně obecný, aby mohl být použit pro vývoj tkáňových markerů u jakéhokoli druhu bez nutnosti vytvářet transgenní rostliny. Tento protokol lze snadno upravit s čerstvými výhonky, listy, kořeny nebo jakýmikoliv pletivy jiných rostlin a představuje jednoduchý a snadný způsob identifikace tkáňově specifických markerů. Navíc lze tyto markery použít ve spojení s dalšími molekulárními markery.
Výsledky
Imunoprofilování protilátek proti buněčné stěně v radiálních řezech kořenů rýže odhaluje specifické protilátky pro kortikální vrstvy
S cílem identifikovat markery založené na protilátkách pro kortikální buňky jsme nejprve vytvořili protokol pro středně výkonné imunoznačení radiálních řezů čerstvých kořenů rýže (podrobnosti viz materiály a metody a doplňkový obrázek 1). Poté jsme provedli screening s monoklonálními protilátkami vznesenými proti složkám buněčné stěny (od Complex Carbohydrate Research Center (CarboSource Services, Athens Georgia, USA) a Paul Knox Cell Wall lab (university of Leeds, UK), podrobnosti viz Materials and Methods)) s cílem identifikovat markery kůry. Ze 174 testovaných protilátek bylo pouze 12 zachováno jako domněle specifické pro kůru. Testovali jsme jejich opakovatelnost provedením dvou dalších experimentů a dospěli jsme k závěru, že osm protilátek vykazuje podobné a robustní profily mezi třemi opakováními (obrázek 2). Pět protilátek (JIM7, M14, M38, M130 a M131) poskytlo stejný vzor imunoznačení v kůře. Značeny byly pouze nepřilehlé buněčné stěny, což vedlo k jedinému značení všech korových buněk ve tvaru „diamantu“. U tří dalších protilátek (LM5, M133 a M107) bylo značení zjištěno v kůře a někdy i v buňkách sklerenchymu, zejména u protilátek LM5 a M107. Signál byl homogenní na buněčné stěně kůry, ale byl mnohem slabší ve vnitřních vrstvách kůry (vrstva kůry sousedící s endodermální vrstvou) než ve vnějších vrstvách kůry. Všechny tyto protilátky s profily komplementárními ke korovým tkáním jsou tedy specifickými markery, které lze použít k analýze identity korových buněk. Dvě odlišné kortikální značky, které definují dvě podkorové oblasti, navíc naznačují, že vnější a vnitřní vrstvy mají odlišnou molekulární identitu, která byla těmito protilátkami odhalena.
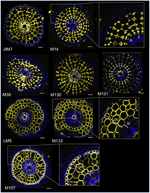
Obrázek 2. Vnější a vnitřní vrstvy mají odlišnou molekulární identitu. Identifikace osmi specifických protilátek proti kůře (JIM7, M14, M38, M130, M131, LM5, M133 a M107) mezi 174 prověřenými z knihovny monoklonálních protilátek proti buněčným stěnám. Pro každou protilátku byly po imunohistologickém značení získány sloučené snímky příčných řezů pod konfokálním mikroskopem: žlutě vzor protilátky při vlnové délce 561 nm a modře autofluorescence buněčné stěny v UV světle. Pět protilátek (JIM7, M14, M38, M130 a M131) vykazuje podobný profil v rámci všech obarvených vrstev kortikálních buněk (kosočtverce). Tři protilátky (LM5, M133 a M107) homogenně značí kortikální buněčné stěny. Všimněte si, že u těchto protilátek nejsou vnitřní kortikální vrstvy (ic) obarveny ve srovnání s vnějšími kortikálními vrstvami (oc). Vložky jsou detailní záběry odpovídajících snímků. Sloupce = 20 μm.
Některé specifické rysy těchto dvou podkorových vrstev byly zvýrazněny při použití zásuvného modulu „polar transformer“ softwaru ImageJ (http://imagej.nih.gov/ij/) k prohlížení snímků kořenových řezů (obr. 1B,C; Schneider et al., 2012; Lartaud et al., 2014). Vnitřní buňky se vyznačovaly silnou buněčnou stěnou ve srovnání s vnějšími buňkami, které vykazovaly různé dutiny obsahující vzduch, které vznikly splynutím buněčné stěny. Vnitřní kortikální buňky také vykazovaly zploštělý tvar připomínající endodermální buňky, na rozdíl od vnějších buněk, které byly kulatější. Na tomto proměněném obrázku není vidět radiální buněčná stěna, která je stěnou probíhající z vnitřní strany buňky na vnější stranu, autofluorescence endodermálních a exodermálních buněk, pravděpodobně v důsledku přítomnosti kaspariových proužků. Podobně, ale v menší míře, byly malé otvory vylučující autofluorescenci viditelné také na radiálních buněčných stěnách vnitřních kortikálních buněk.
Všechny typy postranních kořenů mají pouze vnější korovou tkáň
Abychom prokázali užitečnost korových markerů a charakterizovali identitu buněk, označili jsme tři typy postranních kořenů rýže (L-LLR, T-LLR a SLR) třemi z těchto protilátek (M107, M133 a M14). Pro tento experiment, protože L-LLR se často nevyvíjejí na Petriho miskách, byly boční kořeny odebrány ze semenáčků rýže pěstovaných v hydroponických podmínkách po dobu 2 týdnů. Nejprve jsme analyzovali uspořádání půdní tkáně každého typu postranního kořene pozorováním autofluorescence buněčných stěn v příčném a polárním pohledu na kořenové řezy (obr. 3). Tato první analýza odhalila mírně odlišnou vnitřní radiální anatomii u tří typů postranních kořenů. Podobně jako u řezů radikulí pozorovaných v UV světle lze endodermální a exodermální tkáně identifikovat podle zhasnutí fluorescence ve středu radiálních buněčných stěn. Tyto dvě tkáně byly přítomny ve všech postranních kořenech. Mezi endodermis a exodermis bylo u L-LLR a T-LLR přítomno několik vrstev tkání, zatímco SLR měly pouze jednu (neidentifikovanou) buněčnou vrstvu. Anatomie L-LLRs vypadala jako semenné kořeny a vně endodermis bylo při tvorbě aerenchymu snadno identifikovatelných několik vrstev korové tkáně. Kromě toho byla pozorována také sklerenchymatická vrstva tvořená těsně zabalenými buňkami se širokými buněčnými stěnami. V závislosti na experimentu nebyla tato vrstva buněk vždy zcela vyvinuta. V řezech T-LLR se vnější vrstva podobala kortikální tkáni a vnitřní vrstva se podobala jediné (neidentifikované) vrstvě SLR.
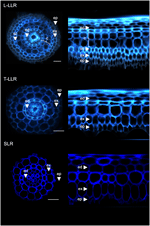
Figure 3. Složení tkání typů velkých postranních kořenů (Large-LLR a Thin-LLR) a malých postranních kořenů (SLR). Sazenice byly pěstovány v hydroponických podmínkách po dobu 2 týdnů. Autofluorescence buněčné stěny příčných řezů a polárně transformovaný pohled v UV světle. Tkáně jsou označeny takto: epidermis (ep), exodermis (ex), kůra (c), endodermis (ed). Všimněte si, že epidermis (ep) byla v průběhu experimentu často fragmentována. Sloupce = 20 μm.
Pro identifikaci buněčných vrstev přítomných v přízemních pletivech SLR a T-LLR a pro potvrzení kortikální identity v L-LLR jsme imunoznačili řezy postranních kořenů třemi protilátkami specifickými pro kortex (M107, M133 a M14; obr. 4). Protilátky M107 a M133 označily všechny buněčné vrstvy nacházející se mezi endodermis a exodermis ve všech postranních kořenech. Na základě barvení radikulí těmito protilátkami toto pozorování naznačovalo, že tyto buněčné vrstvy mohou mít sklerenchymatickou nebo kortikální identitu. Nicméně skutečnost, že M14 imunoznačil i tyto vrstvy, zejména v řezech SLR, jasně ukazuje, že tyto vrstvy měly vnější kortikální identitu.

Figure 4. Sloučené snímky typů velkých postranních kořenů (Large-LLR a Thin-LLR) a řezů malých postranních kořenů (SLR) imunoznačených M107, M133 a M14. Sazenice byly pěstovány v hydroponických podmínkách po dobu 2 týdnů. Žlutě je znázorněno značení protilátkou při vlnové délce 561 nm a modře autofluorescence pod UV světlem. Tkáně jsou označeny takto: epidermis (ep), exodermis (ex), kůra (c), endodermis (ed). Všimněte si, že epidermis (ep) byla v průběhu experimentu často fragmentována. Sloupce = 20 μm.
Rozdíly v počtu vnějších vrstev korových buněk (jedna v SLR, dvě v T-LLR, tři v L-LLR a čtyři až pět v radikule) hrají hlavní roli v průměrech kořenů rýže (obr. 5).
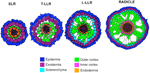
Obrázek 5: Průměry kořenů rýže. Schematické znázornění tkání postranního kořene a radikuly.
Závěry
Pro kvalifikaci podkorových oblastí v rostlinách již byly použity různé termíny. Například přítomnost „vnitřní“ lignifikované vrstvy kůry, srovnatelné se zde studovanou, již byla popsána u planě rostoucí rýže (Yang et al., 2014). U kukuřice jsou obě korové oblasti definovány odlišně (Baluška et al., 1993). „Vnitřní“ doménu tvoří aerenchym, který zde odpovídá vnější kůře, a „středně-vnější“ kůru tvoří lignifikované podpůrné pletivo, což by mohl být sklerenchym. U Arabidopsis byla také popsána buněčná vrstva „střední kůry“, která se nachází mezi kortikální monovrstvou a endodermis (Baum et al., 2002; Paquette a Benfey, 2005). Nejnovější výsledky naznačují, že tato kůrová vrstva, jejíž tvorba je regulována mimo jiné GA, oxidačním stresem a SHR a SCR, hraje roli v abiotické toleranci (Paquette a Benfey, 2005; Cui a Benfey, 2009; Pauluzzi a kol., 2012; Wu a Gallagher, 2014). Zajímavé je, že tato vrstva je také popisována jako šroubovice s typickým tvarem (Baum a kol., 2002). Mohla by být tato vrstva „střední kůry“ Arabidopsis funkčně a strukturálně podobná vrstvě vnitřní kůry radikuly rýže? Na podélných a příčných řezech rýže tvoří vnitřní korová vrstva obvykle také šroubovici, což naznačuje, že by tyto dvě tkáňové vrstvy mohly být srovnatelné. U Arabidopsis je vrstva „střední kůry“ odvozena z periklinálního dělení endodermis, které se objevuje od QC mezi 7. a 14. dnem po vyklíčení (Paquette a Benfey, 2005). K ověření těchto důležitých parametrů u rýže bude zapotřebí nových nástrojů. Dosud například nebyl popsán žádný mutant ovlivňující načasování tvorby této vrstvy. Kromě toho je také zapotřebí technický pokrok v zobrazování QC rýže. Nicméně naše markery specifické pro kůru nabízejí nový nástroj pro porovnání funkce a molekulární sítě zapojené do tvorby vnitřní kůry (rýže) oproti „střední kůře“ (Arabidopsis). V naší laboratoři probíhají práce na identifikaci molekulárních determinantů tvorby vnitřní a vnější kůry, přičemž ortologové rýže SCR a SHR jsou prvními kandidáty na regulaci tvorby kůry v kořenech rýže (Pauluzzi et al.,
Materiál a metody
Rostlinný materiál
Šestidenní sazenice
Sazenice Oryza sativa L. ssp. japonica kultivaru Nipponbare byla pěstována vertikálně ve sterilních Petriho miskách (Corning, 431301; 20 × 20 cm) v kontrolovaných podmínkách (rytmus den/noc: 12/12 h, 28/25 °C, intenzita světla: 500 μE m-2 s-1). Nejprve byla semena povrchově sterilizována opláchnutím v 70% ethanolu po dobu ~ 1 min. Poté byl etanol nahrazen roztokem složeným ze 40% bělidla v destilované vodě obsahující tři kapky tween 80 (Sigma-Aldrich P4780-500 ml). Semena byla v tomto roztoku namáčena 30 min za mírného míchání a poté alespoň čtyřikrát opláchnuta sterilní destilovanou vodou. Do Petriho misek se nalilo horké (~50 °C) autoklávem sterilizované poloviční síly médium Murashige a Skoog (MS/2) (250 ml) a nechalo se ~45 min tuhnout. Pevné médium MS/2 se skládá z 2,15 g.l-1 směsi bazických solí MS média (Duchefa Biochemie, M0221), 75 mg.l-1 směsi vitaminů MS (Duchefa Biochemie, M0409) a 8 g.l-1 agarózy typu II (Sigma-Aldrich, A6877). Sterilní semena se poté zatlačí do ztuhlého média MS/2 s radikuly orientovanými směrem dolů. Kořeny byly sklizeny po 6 dnech růstu.
Čtyřtýdenní rostliny
Po 3 dnech klíčení ve vodě byly semenáčky přeneseny do hydroponického systému v kontrolovaných podmínkách (rytmus den/noc: 12/12 h, 28/25 °C, intenzita světla: 500 μE m-2 s-1, relativní vlhkost: 55 %). Hydroponický systém se skládá z plastového boxu o objemu 50 l obsahujícího 30 l hydroponického roztoku, na kterém je položena pěnová matrace o tloušťce 1 cm. Pěnová matrace je propíchnutá mezerami, aby se udržely základy stonků sazenic. Hydroponické médium se skládá z (NH4)2SO4 (0,5 mM), MgSO4.7H2O (1,6 mM), Ca(NO3)2.4H2O (1,2 mM), KNO3 (0,7 mM), FeSO4 (0,1 mM), Na2EDTA (0,1 mM), MnSO4. H2O (1,7 μM), (NH4)6Mo7O24.4H2O (0,2 μM), ZnSO4.7H2O (0,2 μM), CuSO4.5H2O (0,2 μM), H3BO3 (1,4 μM) a KH2PO4 (0,6 mM). Roztok je provzdušňován čerpadlem umístěným na dně plastového boxu a vyměňován každých 10 dní. Hodnota pH byla upravena a udržována na 5,4 ± 0,2.
Rozřezání čerstvých kořenů
Vrcholky rostoucích radikulí nebo postranních kořenů (2 cm) byly odříznuty ostrým nožem a umístěny rovnoběžně vedle sebe, aby se srovnaly špičky kořenů (doplňkové obrázky 1A,B). Byly vloženy do jedné kapky 3% rozpuštěné agarózy (50 °C; doplňkový obrázek 1C). Záplaty obsahující kořenové špičky byly vloženy do jamky o rozměrech 3 × 1 × 1 cm naplněné 3% roztavenou agarózou (doplňkový obrázek 1D). Po ztuhnutí byly bloky změněny a nalepeny na vibratomovou destičku, aby mohly být nakrájeny na plátky. Parametry vibratomu (Hm650v (Thermo Scientific Microm)) byly rychlost 30, frekvence 70, amplituda 0,8 a tloušťka 60 μm (doplňkový obrázek 1E). Řezy byly přeneseny buď na komůrková sklíčka (Lab-teak 177402) pro imunobarvení (doplňkový obrázek 1F), nebo na sklíčka zvlhčená 1X alkalickým fosfátovým pufrem (PBS, Sigma-Aldrich P3813) pro pozorování.
Imunolokalizace
Řez umístěný na komůrkových sklíčkách (tři na komůrku) byl nejprve opláchnut v 0,1 M glycinu doplněném 1X PBS a poté dvakrát v 1X PBS, vždy po dobu 10 minut. Poté byly tkáně ponořeny do roztoku PBS obsahujícího 5% hovězí fetální sérum (blokovací roztok, Thermo Fisher 37520) při 4 °C přes noc za míchání. Primární protilátky, ředěné v poměru 1:10 v tomto blokovacím roztoku, byly aplikovány přes noc při 4 °C za míchání. Řezy byly poté 3x oplachovány v PBS 1X po dobu 10 min. Řezy kořenem byly inkubovány 2 h se sekundární protilátkou zředěnou 500krát v blokovacím roztoku za míchání. Tyto protilátky byly spojeny s fluoroforem, protilátkou Alexa 546 proti potkanům (Invitrogen A11081) nebo protilátkou Alexa 546 proti myším (Invitrogen A11060). Poté byly řezy opět třikrát opláchnuty v 1X PBS za míchání, vždy po dobu 10 minut. Komůrky byly vyjmuty a bylo přidáno několik kapek montážního média mowiol (Sigma-Aldrich 81381). Na řezy kořenem byl umístěn krycí sklíčko, které se nechalo 36 h schnout ve tmě při 4 °C.
Fixace v paraformaldehydu
Rady pěstované na Petriho miskách po dobu 6 dnů byly fixovány ve 4% paraformaldehydu (v PBS 1X) přes noc při 4 °C a dvakrát opláchnuty pomocí PBS 1X (Jackson, 1991). Fixované tkáně byly dehydratovány v ethanolu, očištěny v přípravku Histochoice Clearing Agent (HistoClear, Sigma Aldrich) a vloženy do Paraplastu (Fisher). Tkáně byly rozřezány (tloušťka 6 μm) na mikrotomu Leica RM2255 a upevněny na sklíčka SuperfrostPlus (Fisher).
Mikroskopie
Pozorování v jasném poli a autofluorescence byla provedena pomocí mikroskopu Leica DM4500. Pro autofluorescenci byly snímky pořízeny s kostkou filtru „A“ (excitační rozsah: UV; excitační filtr: BP 340-380; potlačovací filtr: LP 425). Imunobarvené řezy byly pozorovány konfokálním mikroskopem: Zeiss LSM 510 nebo Leica SP8. Buněčné stěny byly nejprve vizualizovány pomocí autofluorescence . Sekundární protilátka byla vizualizována pomocí heliového/neonového laseru při vlnové délce 543, resp. 561 nm. Snímky byly pořízeny barevnou kamerou Retiga 2000R (QIMAGING, Kanada) se softwarem pro pořizování snímků Volocity (Improvision, UK).
Příspěvky autorů
SH, FD, MB, CB: pořízení dat; SH, CP, AD analýza dat; SH, EG, CP, AD: vypracování rukopisu.
Prohlášení o střetu zájmů
Autoři prohlašují, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Poděkování
Děkujeme společnostem MRI (Montpellier RIO Imaging plateform), PHIV a La Gaillarde Plateforms za technickou podporu při imunolokalizaci a/nebo konfokálním a multifotonovém zobrazování. SH je podporován doktorandským stipendiem CIRAD.
Doplňkový materiál
Doplňkový materiál k tomuto článku naleznete online na adrese: https://www.frontiersin.org/article/10.3389/fpls.2015.01139
Zkratky
ae, aerenchym; c, cortex; ed, endodermis; ep, epidermis; ex, exodermis; gt, ground tissue; ic, inner cortex; L-LLR, Large-type Large Lateral Root; oc, outer cortex; sc, sclerenchyma; SLR, Small Lateral Root; st, stele; T-LLR, Thin-type Large Lateral Root; x, xylem.
Baluška, F., Brailsford, R. W., Hauskrecht, M., Jackson, M. B., and Barlow, P. W. (1993). Buněčný dimorfismus v kůře kořene kukuřice: zapojení mikrotubulů, ethylenu a giberelinu do diferenciace buněčného chování v postmitotických růstových zónách. Bot. Acta 106, 394-403. doi: 10.1111/j.1438-8677.1993.tb00766.x
CrossRef Full Text | Google Scholar
Baum, S. F., Dubrovsky, J. G., and Rost, T. L. (2002). Apikální uspořádání a zrání kůry a cévního válce v kořenech Arabidopsis thaliana (Brassicaceae). Am. J. Bot. 89, 908-920. doi: 10.3732/ajb.89.6.908
PubMed Abstract | CrossRef Full Text | Google Scholar
Brundett, M. C., Enstone, D. E., and Peterson, C. A. (1988). A Berberine-aniline blue fluorescent staining procedure for suberin, lignin, and callose in plant tissue. Protoplasma 146, 133-142. doi: 10.1007/BF01405922
CrossRef Full Text | Google Scholar
Coudert, Y., Périn, C., Courtois, B., Khong, N. G., and Gantet, P. (2010). Genetická kontrola vývoje kořenů u rýže, modelové obilniny. Trends Plant Sci. 15, 219-226. doi: 10.1016/j.tplants.2010.01.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., and Benfey, P. N. (2009). Vzájemné působení mezi SCARECROW, GA a LIKE HETEROCHROMATIN PROTEIN 1 při tvarování přízemní tkáně v kořeni Arabidopsis. Plant J. 58, 1016-1027. doi: 10.1111/j.1365-313X.2009.03839.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Laurenzio, L., Wysocka-Diller, J., Malamy, J. E., Pysh, L., Helariutta, Y., Freshour, G., et al. (1996). Gen SCARECROW reguluje asymetrické dělení buněk, které je nezbytné pro vytváření radiální organizace kořene Arabidopsis. Cell 86, 423-433. doi: 10.1016/S0092-8674(00)80115-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Gregory, P. J. (2006). Kořeny rostlin: Growth, Activity, and Interaction with Soils (Růst, činnost a interakce s půdou). Oxford; Ames, IA: Blackwell Pub.
Google Scholar
Heidstra, R., Welch, D., and Scheres, B. (2004). Mozaikové analýzy pomocí značených aktivačních a delečních klonů pitvají působení SCARECROW Arabidopsis při asymetrickém dělení buněk. Genes Dev. 18, 1964-1969. doi: 10.1101/gad.305504
PubMed Abstract | CrossRef Full Text | Google Scholar
Helariutta, Y., Fukaki, H., Wysocka-Diller, J., Nakajima, K., Jung, J., Sena, G., et al. (2000). Gen SHORT-ROOT řídí radiální vzorování kořene Arabidopsis prostřednictvím radiální signalizace. Cell 101, 555-567. doi: 10.1016/S0092-8674(00)80865-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, C. F., Yamaji, N., Ono, K., and Ma, J. F. (2012). Gen pro kinázu podobnou receptoru bohatému na leucin bohaté repetice se podílí na specifikaci vnějších buněčných vrstev v kořenech rýže. Plant J. 69, 565-576. doi: 10.1111/j.1365-313X.2011.04824.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Jackson, D. (1991). „In-situ hybridizace u rostlin“ in Molecular Plant Pathology: A Practical Approach, eds D. J. Bowles, M. McPherson, and S. J. Gurr (Totowa, NJ: Humana Press), 163-174.
Google Scholar
Justin, S. H. F. W., and Armstrong, W. (1991). Důkazy o zapojení ethylenu do tvorby aerenchymu v adventivních kořenech rýže (Oryza sativa L.). New Phytol. 118, 49-62. doi: 10.1111/j.1469-8137.1991.tb00564.x
CrossRef Full Text | Google Scholar
Kamiya, N., Nagasaki, H., Morikami, A., Sato, Y., and Matsuoka, M. (2003). Izolace a charakterizace rýžového homeoboxového genu typu WUSCHEL, který je specificky exprimován v centrálních buňkách klidového centra v kořenovém apikálním meristému. Plant J. 35, 429-441. doi: 10.1046/j.1365-313X.2003.01816.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kawai, M., Samarajeewa, P. K., Barrero, R. A., Nishiguchi, M., and Uchimiya, H. (1998). Cellular dissection of the degradation pattern of cortical cell death during aerenchyma formation of rice roots (Buněčná disekce vzorce degradace kortikální buněčné smrti během tvorby aerenchymu kořenů rýže). Planta 204, 277-287. doi: 10.1007/s004250050257
CrossRef Full Text | Google Scholar
Kawata, S., Sasaki, O., and Yamazaki, K. (1977). On the structure of the crown root and the lateral root, and the vessel connection between them, in rice plants [O struktuře korunního a postranního kořene a cévním spojení mezi nimi u rostlin rýže]. Jpn. J. Crop. Sci. 46, 569-579. doi: 10.1626/jcs.46.569
CrossRef Full Text | Google Scholar
Kawata, S., and Shibayama, B. (1965). On the lateral root primordia formation in the crown roots of rice plant [O tvorbě postranních kořenových primordií v korunních kořenech rýže]. Proc. Crop Sci. Soc. Jpn. 33, 423-431. doi: 10.1626/jcs.33.423
CrossRef Full Text | Google Scholar
Kono, Y., Igeta, M., and Yamada, N. (1972). Studies on the developmental physiology of the lateral roots in rice seminal roots [Studium vývojové fyziologie postranních kořenů u semenných kořenů rýže]. Jpn. J. Crop. Sci. 41, 192-204. doi: 10.1626/jcs.41.192
CrossRef Full Text
Lartaud, M., Perin, C., Courtois, B., Thomas, E., Henry, S., Bettembourg, M., et al. (2014). PHIV-RootCell: nástroj supervidované analýzy obrazu pro kvantifikaci anatomických parametrů kořenů rýže. Front. Plant Sci. 5:790. doi: 10.3389/fpls.2014.00790
PubMed Abstract | CrossRef Full Text | Google Scholar
Lux, A., Luxova, M., Abe, J., and Morita, S. (2004). Kořenová kůra: strukturální a funkční variabilita a reakce na stres prostředí. Root Res. 13, 117-131. doi: 10.3117/rootres.13.117
CrossRef Full Text | Google Scholar
Paquette, A. J., and Benfey, P. N. (2005). Dozrávání přízemní tkáně kořene je regulováno giberelinem a SCARECROW a vyžaduje SHORT-ROOT. Plant Physiol. 138, 636-640. doi: 10.1104/pp.104.058362
PubMed Abstract | CrossRef Full Text | Google Scholar
Pauluzzi, G., Divol, F., Puig, J., Guiderdoni, E., Dievart, A., and Périn, C. (2012). Surfování po genové síti kořenové přízemní tkáně. Dev. Biol. 365, 14-22. doi: 10.1016/j.ydbio.2012.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Rebouillat, J., Dievart, A., Verdeil, J., Escoute, J., Giese, G., Breitler, J. a další (2009). Molekulární genetika vývoje kořenů rýže. Rice 2, 15-34. doi: 10.1007/s12284-008-9016-5
CrossRef Full Text | Google Scholar
Sabatini, S., Heidstra, R., Wildwater, M., and Scheres, B. (2003). SCARECROW se podílí na umístění niky kmenových buněk v kořenovém meristému Arabidopsis. Genes Dev. 17, 354-358. doi: 10.1101/gad.252503
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, C. A., Rasband, W. S., and Eliceiri, K. W. (2012). NIH Image to ImageJ: 25 let analýzy obrazu. Nat. Methods 9, 671-675. doi: 10.1038/nmeth.2089
PubMed Abstract | CrossRef Full Text | Google Scholar
Sugimoto, K., Jiao, Y., and Meyerowitz, E. M. (2010). Regenerace Arabidopsis z více tkání probíhá cestou vývoje kořenů. Dev. Cell 18, 463-471. doi: 10.1016/j.devcel.2010.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Ten Hove, C. A., Willemsen, V., de Vries, W. J., Van Dijken, A., Scheres, B., and Heidstra, R. (2010). SCHIZORIZA kóduje jaderný faktor regulující asymetrii dělení kmenových buněk v kořeni Arabidopsis. Curr. Biol. 20, 452-457. doi: 10.1016/j.cub.2010.01.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., and Gallagher, K. L. (2014). Pohyb nebuněčného autonomního transkripčního faktoru SHORT-ROOT závisí na endomembránovém systému. Plant J. 80, 396-409. doi: 10.1111/tpj.12640
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, C., Zhang, X., Li, J., Bao, M., Ni, D., and Seago, J. L. (2014). Anatomie a histochemie kořenů a výhonků u divoké rýže (Zizania latifolia Griseb.). J. Bot. 2014, 9. doi: 10.1155/2014/181727
CrossRef Full Text | Google Scholar
.