US Pharm. 2012;37(5):HS-2-HS-7.
Bolest je nejčastějším důvodem, proč lidé vyhledávají lékařskou pomoc. 1 nedávná studie odhaduje, že bolest postihuje desítky milionů Američanů a stojí Spojené státy ročně 635 miliard dolarů kvůli zvýšené spotřebě lékařské péče a nepřímým nákladům z důvodu zameškaných pracovních dnů a ztráty produktivity.2 Léčba chronické bolesti pomocí léků, jako jsou opioidy, je běžnou strategií, ale chronická bolest může přetrvávat nebo se zhoršovat i přes agresivní léčbu opioidy. Cílem tohoto článku je objasnit fenomén opioidů, které jsou předepisovány k léčbě bolesti, ale způsobují novou bolest nebo její paradoxní zhoršení. tento stav se nazývá opioidy indukovaná hyperalgezie (OIH). OIH lze formálněji definovat jako zvýšenou nociceptivní senzibilizaci způsobenou expozicí opioidům.3OIH se výrazně liší od tolerance, závislosti, návyku a progrese onemocnění. Klinická prevalence OIH není známa.4
Diagnostika a prezentace
Jedním z hlavních problémů při správné diagnostice OIH je blízká podobnost tohoto stavu s tolerancí na opioidy. Tolerance a OIHsdílejí charakteristiku snížené analgetické odpovědi na dávku opioidu a pravděpodobně sdílejí mnoho stejných buněčných mechanismů.5Toleranci lze překonat zvýšením dávky opioidu, zatímco stejné zvýšení u pacienta s OIH vede ke zhoršení bolesti.4Tolerance má navíc tendenci vyvíjet se pomalu v průběhu času, zatímco ke zvýšení bolesti v důsledku léčby opioidy u pacienta s OIH dochází relativně rychle. Často se OIH liší od tolerance tím, že intenzita bolesti je silnější, než se původně uvádělo.6
Nedostatečná léčba bolesti je další možností, kterou je třeba vyloučit. Pokud je léčbaopioidy suboptimální, zvýšení dávky by mělo vést k úlevě od bolesti; pokud je přítomna OIH, měl by platit opak. Aby byla diagnóza OIH přesná, musí bolest ustoupit, jakmile je léčba opioidem, který ji způsobuje, ukončena.6 Aby se situace ještě více zkomplikovala, je hyperalgezie v důsledku vysazení opioidů dobře zdokumentovaným jevem.7Ústup bolesti po vysazení opioidů u OIH tedy nebude okamžitý a bude vyžadovat trpělivost. To představuje vlastní výzvu jak pro lékaře, tak pro pacienta.
OIH má tendenci se projevovat dalšími odlišnými charakteristikami (TABULKA 1).Bolest spojená s OIH bývá difuznější a méně kvalitní a škodlivé podněty bývají bolestivější, než by se normálně očekávalo. U OIH se bolest často projevuje v oblastech přesahujících oblast poranění nebo poškození tkáně. Bolest může u OIH přetrvávat navzdory odstranění původního zdroje bolesti nebo hojení poškozené tkáně. u OIH může s postupující léčbou opioidy bolest vyvolávat iluzi, že se zhoršuje oproti původnímu hlášení, a to navzdory času, odpočinku a dalším opatřením, která by normálně umožnila klinicky relevantní míru hojení.5 Kromě toho byla v řadě studií OIH u lidí i zvířat prokázána alodynie.8

Etiologie
Ohledně příčiny OIH existuje řada teorií. Teorie, která byla nejvíce prozkoumána a které je v současné době věnována největší pozornost, je neuroexcitační model. Předpokládá se, že některéopioidy a jejich metabolity agonizují N-methyl-D-aspartátový(NMDA) receptor. Aktivace NMDA receptoru způsobuje přílivkalcia, který výrazně zvyšuje excitabilitu neuronu. Když jsouNMDA receptor a odpovídající neurony aktivnější, mohou snadněji přenášet bolestivé impulzy iniciované cirkulující látkou Por jinými škodlivými podněty. Glutamát je primárním endogenním agonistouNDMA receptoru.9
Podporou této teorie pronocicepce modulované aktivací NMDA receptoru jsou studie prokazující zmírnění OIH po podání antagonistůNMDA receptoru. Tito antagonisté se nekompetitivně váží na fencyklidinové místo na NMDA kanálu a blokují přítok vápníku, k němuž by došlo, kdyby se na receptor navázal glutamát nebo jiný antagonista.10 Studie na zvířatech a lidech prokázaly, že subjekty s OIH, kterým byl podáván ketamin, antagonista NMDA receptorů, dosahovaly lepších výsledků při kontrolovaném testování bolestivých podnětů. V jedné studii byly potkanům několik dní podávány intratekální injekce morfinu, dokud se u nich neprojevila OIH citlivá na teplo. Podávání dizocilpinu, inhibitoru NMDA, bylo účinné při alespoň částečném zvrácení tepelné hyperalgezie5. Jiní antagonisté NMDA receptorů, jako je dextrometorfan, prokázali určité důkazy o zmírnění hyperalgických stavů prostřednictvím inhibice NMDAreceptoru.
Opioidy, jako je kodein, hydromorfon a morfin, procházejí v rámci normálního metabolického procesu řadou biotransformací.Kodein je metabolizován na morfin enzymem CYP2D6. Morfin jemetabolizován na řadu molekul, ale je metabolizován předevšímglukuronidací na morfin-3-glukuronid (M3G) a v menší míře na morfin-6-glukuronid (M6G) (OBRÁZEK 1).11
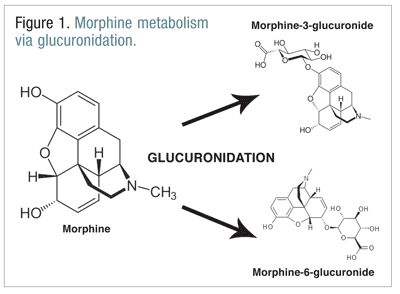
M6G je terapeuticky významný metabolit. Má podobnou afinitu k mu-receptorům jako morfin a je schopen vyvolatanalgezii, respirační depresi a další účinky podobné účinkům morfinu. M3G však není agonistou mu receptoru a ve srovnání s morfinem má k mu receptoru malou afinitu. Na rozdíl od morfinu, M6G a dalších opioidů je M3G agonistou NMDA. Prostřednictvímglukuronidace se M3G přeměňuje přibližně šestkrát rychleji než M6G.12 U jiných opioidů se předpokládá, že mají NMDA agonistickou aktivitu a paradoxní neuroexcitační účinky.6
Podporou teorie, že OIH je způsobena aktivitou jiných receptorů než mu opioidního receptoru, je důkaz, že OIH není zmírněna podáním opioidního antagonisty (např. naloxonu). U pacientůzažívajících OIH při léčbě vysokými dávkami opioidů způsobilo podání naloxonu zhoršení bolesti.13 Tím, že naloxon vytěsnil opioid z mu receptoru, zabránil opioidu poskytnout takovou analgezii, jaká byla možná prostřednictvím aktivace mu receptoru, zatímco současně hyperalgezie nyní zůstala nezvládnuta.14
Dynorfin se může rovněž podílet na vzniku OIH.15Dynorfin je endogenní opioidní peptid, který se váže především nakappa opioidní receptor a v menší míře na mu opioidní a NMDAreceptory. Předpokládá se, že agonismus dynorfinu na kappa opioidníreceptor a NMDA receptor hraje roli v pronocicepci OIHpřes přítomnost čistých agonistů mu receptorů. Studie ukázaly, že reverze dynorfinu může obnovit analgetické účinky morfinu, pokud je subjektům podáno antisérum dynorfinu. Kromě toho je známo, že dynorfin se zvyšuje během dlouhodobého podávání opioidů. Dynorfin také způsobuje uvolňování excitačních neuropeptidů v různýchmístech centrálního nervového systému.
Možnosti léčby
Po stanovení diagnózy OIH existuje řada možností léčby, z nichž je třeba pečlivě vybírat. Za předpokladu, že počáteční bolestivé poranění nebo poškození tkáně ustoupilo a bolest přetrvává navzdory – a kvůli – léčbě opioidy, je nejpřímočařejším přístupem vysazení inkriminovaného opioidu. Mělo by se tak dít postupně, aby se minimalizovaly nežádoucí abstinenční účinky. Je třeba poznamenat, že hyperalgezie se může pravděpodobně zhoršit na počátku procesu ukončení léčby.16 To představuje náročnou etickou situaci, v níž může mít lékař potíže přesvědčit pacienta, že léky předepsané k léčbě bolesti mohly bolest způsobovat nebo zhoršovat a že bolest se může ještě zhoršit, než nakonec ustoupí.17
Pokud oprávněná bolest přetrvává a je zapotřebí určitého množství analgezie opioidy, měly by být prozkoumány další strategie kromě úplného ukončení léčby opioidy. Pacienti, u nichž dochází k OIH, mohou dosáhnout úlevy snížením dávky opioidu.4 Existují zprávy o pacientech, kteří při snížení dávky opioidu nalezli přijatelnou rovnováhu mezi analgezií a úlevou od hyperalgezie.
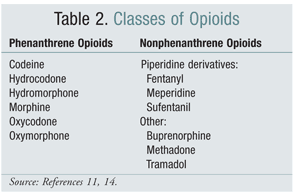
Přechod z jedné strukturní třídy opioidů na jinou byl v některých studiích účinnou možností zmírnění OIH. Dosavadní studie prokázaly, že OIH je silněji spojena s opioidy z fenantrenové třídy (TABULKA 2).4 Titrace fenantrenového opioidu a převedení na jiný může zajistit řešení OIH. Kodein, hydromorfon, morfin a strukturně podobné opioidy podléhají v rámci svého metabolismu glukuronidaci. Vyhnout se glukuronidovému metabolitu aktivujícímuNMDA receptor je možné přechodemna opioid, který je strukturně jedinečný, například fentanyl. V době psaní tohoto článku nebyla OIH prokázána ve studiích zahrnujících oxymorfon.4
Doplnění léčby opioidy inhibitorem cyklooxygenázy 2 (COX-2) je další strategií, která má určitou podporu. Snížením syntézyprostaglandinů mohou inhibitory COX-2 snížit senzibilizacipronociceptivních neuronů. Nesteroidní protizánětlivé léky (NSAID) a inhibitory COX-2 mají zřejmě analgetické účinky nezávislé na jejich schopnosti potlačovat syntézu prostaglandinůperiferně.9 Inhibitory COX-2 rovněž prokázaly schopnost antagonizovat NMDA receptor. Centrálně jsou NSAID schopna antagonizovat NMDA receptor blokováním glutamátu, substance P a dalších excitačních aminokyselin. Nezávisle na tom může aktivace NMDA receptoru zvýšit expresi COX-2.18
Vzhledem k pozornosti, které se NMDA receptoru dostalo pro jeho roli v OIH, se antagonizace tohoto receptoru zdá být rozumnou léčebnou strategií. Ketamin byl hodně zkoumán, ale jeho nežádoucí účinky mohou být závažné. Přestože antagonizuje NMDA a poskytuje anestetický účinek, který by podpořil analgezii, nežádoucí účinky jsou časté, různorodé a závažné.19 Tyto účinky zahrnují tachyarytmii, hypertenzi, kognitivní poruchy a psychomimetické reakce, včetně změn nálady, živých snů, deliria, halucinací a sedace. Ketamin je účinný při zvrácení hyperalgezie a zvýšení účinků opioidů u pacientů, kteří dostávají velké dávky, ale jehonežádoucí účinky brání tomu, aby byl reálnou možností léčby.
Dalším antagonistou NMDA receptorů, který byl zkoumán pro léčbu OIH, je dextrometorfan. Byl studován kombinovaný přípravek obsahující směs morfinu a dextrometorfanu v poměru 1:1.20Studie neprokázaly, že by kombinovaná léčba mohla dosáhnout lepší analgezie ve srovnání se samotným morfinem. K podobnému selhání terapie došlo i ve studii, která používala směs stejných látek v poměru 2:1. Studie byly kritizovány pro nedostatečné množstvídextrometorfanu k adekvátní antagonizaci NMDA receptoru.21Neznámá zůstává dávka dextrometorfanu potřebná buď ke zvýšení analgezie opioidu, nebo k zabránění OIH způsobené aktivací NMDAreceptoru.
Methadon je opioid s jedinečnými vlastnostmi, které z něj činí přesvědčivou možnost léčby bolesti u pacienta s OIH. Kromě svých analgetických účinků prostřednictvím vazby na mu-opioidní receptor je metadon slabým antagonistou NMDA receptorů.4 Bylo zaznamenáno, že přidání i nízké dávky metadonu byloúčinné pro snížení hyperalgezie. V jednom případě přidání nízké dávky metadonu (10 mg dvakrát denně) výrazně zlepšilo hlášení bolesti, přičemž celková dávka opioidů se snížila o 40 % až 50 %.22Populární léčebnou strategií je přechod z inkriminovaného opioidu na metadon. Tramadol a meperidin mají také určitou antagonistickou aktivitu NMDA receptorů.
Další léčebnou modalitou, která má určitý potenciál pro léčbu OIH, je buprenorfin.23,24 Buprenorfin je částečný opioidní agonista na mu receptoru a má také antagonistickou aktivitu na kappa receptoru.4Dynorfin, agonista kappa receptoru, se při léčbě opioidy zvyšuje. Aktivace receptoru kappa do značné míryantagonizuje účinky opioidů zprostředkované receptorem mu.25 Klinická užitečnost buprenorfinu při léčbě OIH dosud nebyla plně objasněna.
Závěr: Výhled do budoucna
Ještě je třeba vykonat mnoho práce, než bude možné prohlásit, že OIH jepochopena. Přesný buněčný mechanismus a signální dráhyodpovědné za tento jev nejsou definovány. Aby to bylo ještě komplikovanější,existují protichůdné zprávy o tom, zda konkrétní složky hrají klíčovou nebo vůbec nějakou roli. Většina výzkumu zaměřeného na objasnění patofyziologie OIH se týkala zvířecího modelu. To má určitou hodnotu, ale informací z lidského modelu je málo.
Slabé pochopení příčiny stavu vytváří nejisté arzenál léčebných možností. Nejlepší dostupnou strategií je úplné vysazení problematického opioidu, ale to je pro pacienta, který vyžaduje úlevu od bolesti opioidního typu, málo užitečné. bylo zkoumáno několik dalších způsobů léčby, ale všechny by bylo vhodné dále studovat. Většina studií provedených na lidech se týká peroperačních pacientů, zotavujících se drogově závislých aexperimentálních modelů bolesti. Tyto studie nejsou bezcenné, ale tyto populace neodrážejí populaci s chronickou bolestí. K dalším omezením dostupných možností léčby patří nedostatečné výsledky,nadměrná toxicita navzdory mírným úspěchům a malé studie přinášející slabé závěry.
V době psaní tohoto článku probíhá nebo se plánuje řada klinických studií s použitím antagonisty NMDA receptorů memantinu k léčbě OIH.26Stále však existují rozporuplné zprávy o přesné roli NMDA receptorů v OIH. Je třeba provést další výzkum, aby se určily klíčové odpovědné receptory a mechanismy přítomné u OIH. Rozšíření velikosti vzorků studií pomůže podpořit již učiněné závěry o tom, které léčebné látky jsou zodpovědné za OIH a účinné při její léčbě. Provádění studií, které se zaměřují na chronickou bolest, spíše než na modely akutní bolesti, může přinést klinicky relevantní informace pro praktické lékaře.
Chapman a jeho kolegové vznesli specifické otázky, které je třeba zodpovědět, než bude možné diagnostikovat OIH a poskytnout účinnou léčbu.27 Jaké jsou vztahy dávky a délky užívání opioidů k OIH? U jakého typu bolesti nebo u jakého typu pacienta má OIH větší tendenci se rozvinout? To jsou otázky, kterými se musí řídit budoucíklinický výzkum.
1. Parselis Kelly J, Cook SF, Kaufman DW, et al. Prevalence a charakteristiky užívání opioidů v dospělé populaci USA. Pain (Bolest). 2008;138:507-513.
2. Institute of Medicine. Zmírnění bolesti v Americe: A Blueprint for Transforming Prevention, Care, Education, and Research [Plán transformace prevence, péče, vzdělávání a výzkumu]. Washington, DC: The National Academies Press; 2011.
3. Chu LF, Angst MS, Clark D. Opioidy indukovaná hyperalgezie u lidí: molekulární mechanismy a klinické úvahy. Clin J Pain. 2008;24:479-496.
4. Lee M, Silverman SM, Hansen H, et al. A comprehensive review of opioid-induced hyperalgesia. Pain Physician: Lékař zabývající se bolestí. 2011;14:145-161.
5. Mao J. Opioidy indukovaná abnormální citlivost na bolest: důsledky pro klinickou léčbu opioidy. Bolest. 2002;100:213-217.
6. Raffa RB, Pergolizzi JV Jr. Opioidy indukovaná hyperalgezie: má klinický význam pro léčbu pacientů s bolestí? Pain Manage Nurs. 2011;1-17.
7. Li X, Clark JD. Hyperalgezie během abstinence od opioidů: zprostředkování glutamátem a látkou P. Anesth Analg. 2002;95:979-984.
8. Pud D, Cohen D, Lawental E, Eisenberg E. Opioids and abnormal painperception: New evidence from a study of chronic opioid addicts andhealthy subjects. Drug Alcohol Depend. 2006;82:218-223.
9. Malmberg AB, Yaksh TL. Hyperalgezie zprostředkovaná míšním glutamátovýmreceptorem nebo receptorem pro látku P blokovaná inhibicí míšní cyklooxygenázy. Science. 1992;257:1276 -1279.
10. Fisher K, Coderre TJ, Hagen NA. Cílení naN-methyl-D-aspartátový receptor pro léčbu chronické bolesti. Preklinické studie na zvířatech, nedávné klinické zkušenosti a budoucí směry výzkumu. J Pain Symptom Manage. 2000;20:358-373.
11. Lötsch J. Opioidní metabolity. J Pain Symptom Manage. 2005;29:S10-S24.
12. Skarke C, Lötsch J. Morphine metabolites: clinical implications [Metabolity morfinu: klinické důsledky]. Semin Anesth, Perioperative Med Pain. 2002;21:258-264.
13. Juni A, Klein G, Kest B. Morphine hyperalgesia in mice isunrelated to opioid activity, analgesia, or tolerance: evidence formultiple diverse hyperalgesic systems. Brain Res. 2006;1070:35-44.
14. Angst M, Clark JD. Hyperalgezie vyvolaná opioidy: kvalitativní systematický přehled. Anesthesiology. 2006;104:570-587.
15. Vanderah TW, Gardell LR, Burgess SE, et al. Dynorphin promotes abnormal pain and spinal opioid antinociceptive tolerance. J Neurosci. 2000;20:7074-7079.
16. Hooten WM, Mantilla CB, Sandroni P, Townsend CO. Souvislostmezi vnímáním tepelné bolesti a dávkou opioidů u pacientů s chronickoubolestí podstupujících zužování opioidů. Pain Med. 2010;11:1587-1598.
17. Silverman S. Opioidy indukovaná hyperalgezie: klinické důsledky pro lékaře zabývající se bolestí. Lékař pro léčbu bolesti. 2009;12:679-684.
18. Li SQ, Xing YL, Chen WN, et al. Activation of NMDA receptor isassociated with up-regulation of COX-2 expression in the spinal dorsalhorn during nociceptive inputs in rats. Neurochem Res. 2009;34:1451-1463.
19. Okon T. Ketamin: úvod pro lékaře bolesti a paliativní medicíny. Pain Physician. 2007;10:493-500.
20. Galer BS, Lee D, Ma T, et al. MorphiDex (kombinace morfin sulfát/dextrometorfan hydrobromid) v léčběchronické bolesti: tři multicentrické, randomizované, dvojitě zaslepené, kontrolovanéklinické studie neprokázaly zvýšení opioidní analgezie nebosnížení tolerance. Pain. 2005;115:284-295.
21. Wiesenfeld-Hallin Z. Kombinovaná léčba opioidy a NMDA antagonisty. jaké výhody nabízí pro kontrolu bolestivých syndromů? Léky. 1998;55;1-4.
22. Vorobeychik Y, Chen L, Bush MC, Mao J. Zlepšení opioidního analgetického účinku po snížení dávky opioidů. Pain Med. 2008;9:724-727.
23. Baron MJ, McDonald PW. Významné snížení bolesti u pacientů s chronickou bolestí po detoxikaci od vysokých dávek opioidů. J Opioid Manag. 2006;2:277-282.
24. Koppert W, Ihmsen H, Körber N, et al. Different profiles ofbuprenorphine-induced analgesia and antihyperalgesia in a human painmodel. Pain. 2005;118:15-22.
25. Pan ZZ. Mu-opoziční působení kappa-opioidního receptoru. Trends Pharmacol Sci. 1998;19:94-98.
26. Ballantyne JC, Mao J. Opioidní terapie chronické bolesti. N Engl J Med. 2003;349:1943-1953.
27. Chapman CR, Lipschitz DL, Angst MS, et al. Opioid pharmacotherapyfor chronic non-cancer pain in the United States: a research guidelinefor developing an evidence-base. J Pain. 2010;11:807-829.