V Exeleadu přistupujeme ke smluvní výrobě se zaměřením na liposomální a PEGylované formulace pro léčbu vzácných onemocnění a malých nebo nedostatečně zásobených populací. Specializujeme se na vývoj a výrobu parenterálních léčivých přípravků na bázi lipidů a náš tým má více než 20 let zkušeností se spoluprací s širokou škálou preklinických, klinických a komerčních zákazníků v oblasti smluvní výroby.
Co jsou liposomy a jak se používají při podávání léčivých přípravků?
Liposomy jsou specializované nosiče, které plní řadu rolí při zlepšování schopností účinných farmaceutických látek (API). Zaprvé mohou chránit léčivo před detekcí imunitním systémem těla, napodobují biologické membrány a poskytují léčivu více času na dosažení zamýšleného cíle. Za druhé pomáhají rozpouštět vysoce lipofilní molekuly léčiv nebo modulovat farmakokinetiku a biodistribuci API, čímž pomáhají minimalizovat vedlejší účinky a zlepšit bezpečnostní profil přípravku.
Lipozomy mají jedinečnou vezikulární strukturu. Tyto vezikuly se skládají z lipidové dvojvrstvy, která má tvar duté koule obklopující vodnou fázi. Jakýkoli náklad, který je předmětem zájmu, tak může být zapouzdřen v liposomech buď ve vodní části (pokud je rozpustný ve vodě/hydrofilní), nebo v lipidové dvojvrstvě (pokud je rozpustný v tucích/lipofilní).
Některé základní lipidy používané k výrobě liposomů jsou fosfolipidy a sfingolipidy. Tyto dvě kategorie lipidů jsou jedinečné z hlediska hlavové skupiny, která je vodomilná/hydrofilní, a ocasní skupiny, která je vodomilná/lipofilní. Díky své amfifilní povaze se tyto molekuly po přidání do vodných roztoků spontánně samy sestavují do liposomů a dalších jedinečných 3D struktur. Tvar nebo morfologie 3D struktur závisí na řadě různých faktorů – například na složení lipidů, teplotě, pH nebo přítomnosti dalších pufrů, solí a cukrů ve vodě.

Zdroj obrázku: Chem Libre Texts
Jak lék interaguje s organismem a stává se dostupným pro použití, když je formulován jako lipozomální léčivý přípravek?
V posledních letech lipozomy přitahují značnou pozornost jako důvěryhodná třída nosičů léčiv. Jejich samouzavřené struktury mohou zapouzdřit více léčiv najednou a chránit uzavřený náklad před hydrolýzou a rozpadem. Kromě toho mohou cílové proteiny a povrchové funkční ligandy na vnějším obalu lipidové dvojvrstvy přidat novou funkčnost – umožnit cílený vstup liposomů do buněk, a to buď prostřednictvím protilátek, nebo ligandů cílených na receptory. Tyto ligandy se připojují k buněčným receptorům, které jsou v některých nemocných buňkách nadměrně exprimovány, a umožňují tak vstup léčiva přes buněčnou membránu.
„Liposomy chrání naložené molekuly léčiv před vnější degradací a jejich podobnost s biologickými membránami poskytuje jedinečné možnosti, jak dopravit molekuly léčiv do buněk nebo subcelulárních kompartmentů …“. Kromě toho lze měnit různé fyzikálně-chemické vlastnosti liposomů – včetně jejich velikosti, náboje a povrchových funkčních ligandů -, což vede k funkcím zvýhodňujícím specifické úkoly doručování léčiv. Díky těmto výhodám se liposomy staly přední platformou pro podávání léčiv se širokou škálou využití v klinice.“
– Liposome-like nanostructures for drug delivery | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Typicky se liposomy vyrábějí jako sterilní injekční přípravky pro podávání do krevního oběhu a k uvolnění léčiva dochází při rozpadu lipidových obalů – což se může stát v extracelulárním nebo intracelulárním prostředí.
Byly použity různé strategie pro konstrukci konvenčních liposomů se schopností spouštěného uvolňování, které zvyšují terapeutickou účinnost tím, že způsobují, že liposomy uvolňují zapouzdřenou API nebo „náklad“ na základě reakce na podnět. Toto uvolňování je buď řízeno konvenčním rozpadem liposomů, nebo je řízeno aktivními podněty a signály z prostředí, včetně tepelné energie, gradientu pH a smykového napětí.1
Formulatury uzpůsobené pro uvolňování v intracelulárním prostředí mohou zahrnovat lipidy citlivé na pH, které mění strukturu liposomů nebo se rozkládají v kyselých kompartmentech, což umožňuje uvolňování zapouzdřeného léčiva. Alternativně jsou někdy zahrnuty termosenzitivní nebo fotosenzitivní složky, které umožňují rozklad a modulaci struktury v důsledku změn teploty nebo reakce na světlo určitých vlnových délek.
Liposomům podobné nosiče léčiv mohou existovat v mnoha různých variantách, které vykazují širokou škálu biochemických a biofyzikálních vlastností. To je sice výhodné a umožňuje to těmto částicím na bázi lipidů nabývat užitečných aplikací ve stovkách různých prostředí, ale množství možných variant vyžaduje důslednou kontrolu výroby.2
Exelead vyrábí léčiva na bázi lipidů od počátku 90. let, počínaje produktem Abelcet. Amfotericin B, účinná látka přípravku Abelcet, je uložen v lipidovém komplexu a selektivně se spojuje s plísňovými membránami a cílí na buňky onemocnění.
Lipozomy vs. lipidové nanočástice
Lipozomy a lipidové nanočástice (LNP) jsou podobné svým designem, ale mírně se liší složením a funkcí. V obou případech se jedná o lipidové nanoformy a vynikající nosiče léčiv, které transportují zátěž zájmu uvnitř ochranné vnější vrstvy lipidů. Při použití však mohou LNP nabývat různých podob.
LNP jsou struktury podobné liposomům zaměřené zejména na zapouzdření široké škály nukleových kyselin (RNA a DNA); a jako takové jsou nejoblíbenějším nevirovým systémem pro doručování genů. Společnost Exelead vyvíjí a vyrábí LNP k zapouzdření různých typů genetických zátěží, včetně siRNA, mRNA a saRNA.
Tradiční liposomy zahrnují jeden nebo více prstenců lipidové dvojvrstvy obklopující vodní kapsu, ale ne všechny LNP mají přilehlou dvojvrstvu, která by je kvalifikovala jako lipidové vezikuly nebo liposomy. Některé LNP nabývají struktury podobné micelám a zapouzdřují molekuly léčiva do nevodného jádra.
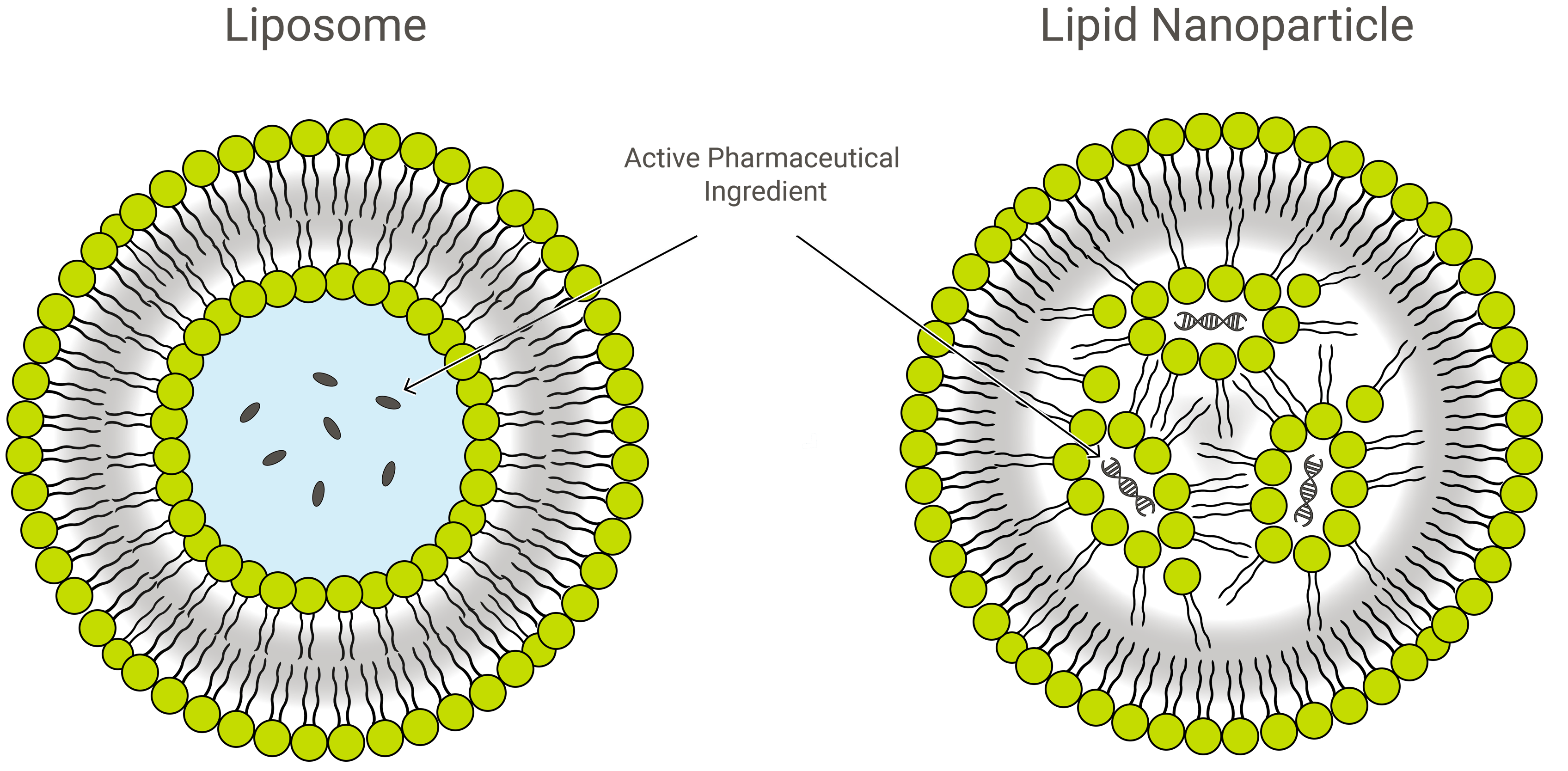
PEGylace LNP a struktury podobné liposomům pro podávání léčiv
LP se skládají především z kationtových lipidů (viz níže genová terapie) spolu s dalšími lipidovými složkami. Ty obvykle zahrnují neutrální fosfolipidové molekuly patřící do třídy fosfatidylcholinu (PC) a steroly, jako je cholesterol. Další běžnou lipidovou složkou je takzvaný PEGylovaný fosfolipid – polymer polyethylenglykolu (PEG) kovalentně připojený k hlavové skupině fosfolipidu.

PEGylované fosfolipidy se používají v mnoha nosičích léčiv na bázi lipidů především proto, že nabízejí takzvaný stealth efekt léčivého přípravku při jeho cirkulaci v těle. Lidský imunitní systém je veden snahou chránit tělo před jakýmkoli cizím předmětem a léčivé nanočástice nejsou výjimkou. Aby se napomohlo účinnosti doručování a aby molekuly nákladu měly více času na cirkulaci a dosáhly zamýšlených míst onemocnění, přidává se PEG, který tyto nanočástice chrání tím, že zabraňuje vstřebávání proteinů krevní plazmy do povrchu liposomu, čímž se prodlužuje životnost krevního oběhu.1
Druhou výhodou PEGylace je zvýšení stability nanostruktur podobných liposomům. Běžné liposomy, zejména ty s velikostí menší než 200 nm, mohou být samy o sobě nestabilní a mají tendenci se vzájemně slučovat, aby se snížilo jejich povrchové napětí. To může mít za následek ztrátu zapouzdřeného léčiva nebo nepříznivé promíchání nákladu různých vezikul. Jedním ze způsobů, jak se výrobci léčiv naučili tento problém překonávat, je pokrytí vnějšího povrchu liposomů polymery, jako je PEG.
Tyto nanočástice vybavené technologií stealth vyústily v novou generaci liposomálních přípravků a několik klinicky schválených produktů. PEGylované liposomy a LNP jsou v současné době novým paradigmatem pro většinu onkologických léčiv.
LNP v genové terapii
Po dlouhou dobu bylo nejúčinnějším způsobem, jak dopravit do lidských buněk léčiva založená na genech, použití viru, který byl upraven tak, aby nesl léčivý náklad, a nikoli škodlivé, samoreplikující se geny. Tato metoda se příležitostně používá dodnes a označuje se jako virové dodávání genů. Nevirové podávání genů se však v posledních 20 letech stalo populárním díky lepšímu bezpečnostnímu profilu, nižší míře nežádoucích imunogenních reakcí a snadné výrobě. Jednou z hlavních hnacích sil tohoto hnutí byl vývoj nosičů na bázi lipidů a polymerů, z nichž nejoblíbenější jsou LNP.
LNP používané k doručování genů jsou syntetizovány především pomocí kationtových neboli kladně nabitých lipidů, které se spojují s aniontovými neboli záporně nabitými nukleovými kyselinami. Mohou být přidány i další složky na bázi lipidů, aby se modulovala účinnost doručení a uvolnění místa genetického nákladu. LNP také poskytují mechanickou stabilitu, řízenou morfologii a úzkou distribuci velikosti.1
Jako jádra lipozomálních nanočástic byly zkoumány anorganické materiály, organické materiály a hydrogely, které jsou zapouzdřeny v různém počtu lipidových vrstev tvořících obal. Jedna z nejúspěšnějších variant těchto hybridních nanočástic obsahuje polymery PLA nebo PGLA uvnitř lipidové monovrstvy. Tyto dva základní biopolymery jsou obzvláště užitečné při podávání léčiv, protože usnadňují řízené uvolňování léčiv1.

Výše uvedená formulace nanočástic je hybrid lipidů a polymerů s hydrofobním jádrem PGLA a hydrofilním pláštěm z lipidů a PEG.
Rozšiřující se oblast
„Liposomy urazily dlouhou cestu k tomu, aby se staly třídou ověřených nosičů léčiv … Vyvíjí se stále více různých nanostruktur podobných liposomům, z nichž každá má jedinečné přednosti vhodné pro specifické úkoly podávání léčiv. Mezitím rychle postupuje pochopení interakcí mezi těmito nanostrukturami a biologickými systémy. Bylo získáno značné množství informací o době jejich cirkulace, tkáňové akumulaci a potenciální toxicitě. Je jisté, že nanonosiče podobné liposomům budou v dohledné budoucnosti hrát větší roli při podávání léčiv.“
– Liposome-like nanostructures for drug delivery | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Přestože probíhají významné práce na vývoji léčivých látek s řízeným uvolňováním a nanokompartmenty, liposomy a LNP jsou obzvláště slibnou možností. Tyto struktury poskytují jedinečnou, přirozeně stabilní, buňkám podobnou morfologii pro nanomedicínu a jsou připraveny k pokroku směrem k pokročilejším terapeutickým strategiím. Společnost Exelead se zabývá takovými výzvami, včetně vývoje nanogelů, které obsahují řadu biologických látek a malých molekul.
Od konce 60. let 20. století, kdy byly liposomy poprvé navrženy jako systém pro podávání léčiv, se objevily varianty struktury a funkčnosti, které poskytují cenný pokrok z hlediska cílení na onemocnění. Léčiva LNP se objevila ve farmaceutickém průmyslu jako terapie určené k podávání protinádorových látek, antibiotik, genových léčiv, anestetik a protizánětlivých léčiv.3
„V klinických aplikacích se lipozomální léčiva ukázala jako nejužitečnější pro svou schopnost „pasivně“ se hromadit v místech zvýšené propustnosti cévního řečiště, kdy je jejich průměrný průměr v ultrafiltračním rozmezí (<200 nm v průměru), a pro svou schopnost snížit vedlejší účinky zapouzdřených léčiv oproti volným léčivům. To vedlo k celkovému zvýšení terapeutického indexu, který měří převahu účinnosti nad toxicitou.“
– Liposomální systémy pro doručování léčiv: od konceptu ke klinickým aplikacím | Allen TM, Cullis PR 3
Použití v personalizované medicíně – nová éra v léčebných strategiích
Na rozdíl od tradičních, velkofarmářských přístupů k léčbě nemocí bere personalizovaná medicína v úvahu individuální rozdíly v životním stylu, prostředí a biologii – včetně genetiky pacienta.
To je mimořádně použitelné u nemocí, jako je rakovina. Dokonce i v rámci jednoho typu rakoviny se typy nádorů u jednotlivých pacientů liší a pochopení konkrétní genetické mutace, která se u pacienta vyvinula, umožňuje lékařům použít specifičtější a přesnější léčbu.4
S příchodem personalizované genetické léčby mohou lékaři a vědci účinně přizpůsobit účinnou farmaceutickou látku – často RNA nebo DNA – specifickému profilu onemocnění konkrétního pacienta nebo malé skupiny pacientů. Tento přístup k hyper-specifickému zacílení na onemocnění zvyšuje účinnost a snižuje nežádoucí vedlejší účinky u skupin podobných pacientů.
LNP jako nosiče oligonukleotidů
Protože se velká část rostoucí oblasti personalizované medicíny zaměřuje na genetické terapie, LNP se staly obzvláště užitečnými jako platforma pro doručování léčiv. Do liposomu nebo LNP by teoreticky mohl být zapouzdřen jakýkoli oligonukleotid, ale siRNA jsou v současné době nejčastějším nákladem v těchto typech léčivých přípravků.
Teoreticky mohou být segmenty siRNA navrženy tak, aby umlčely jakýkoli gen, což je vzrušující koncept pro lékaře i výzkumníky. Bohužel doručení volných, nezapouzdřených RNA do lidských buněk je obtížné, protože jsou velké, v séru nestabilní a náchylné k degradaci nukleázami.5
Výzkumníci se sice pokusili stabilizovat siRNA v séru přidáním fosforothioátových vazeb, ale k účinnému umlčení genů u lidí jsou zapotřebí vysoké dávky. LNP poskytly řešení tohoto problému tím, že poskytují flexibilní a snadný způsob zapouzdření, chrání segmenty siRNA, dokud nedosáhnou zamýšleného cíle, a usnadňují jejich doručení do cílových buněk.5
„LNP obsahující ionizovatelné kationtové lipidy mají řadu vlastností nezbytných pro systémové doručení polynukleových kyselin, včetně malých rozměrů, stability v séru, nízkého povrchového zeta potenciálu při fyziologickém pH a kationtového náboje při kyselých hodnotách pH (např. v endosomech). Dále lze využitím „endogenních“ cílových procesů díky asociaci s ApoE po podání dosáhnout vysoce účinného vychytávání do hepatocytů po i.v. podání, což vede k vynikajícím schopnostem umlčování genů.“
– Lipidové nanočásticové doručovací systémy pro léčiva na bázi siRNA | Wan C, Allen TM, Cullis PR 5
Menší velikosti šarží
Personalizované léčivé přípravky se často vyrábějí v malých šaržích pro jednotlivé pacienty nebo malé populace a jejich výsledkem může být často méně než jeden litr produktu. Naproti tomu tradiční výrobní šarže pro běžné léčivé přípravky často produkují tisíce litrů léčivého přípravku ve velkém měřítku. Personalizovaná medicína vyžaduje jedinečný přístup a každá šarže musí být vyráběna za přísných podmínek cGMP.
Jelikož se personalizovaná medicína stala významným tématem ve vývoji léčiv, mnoho společností ve farmaceutickém průmyslu přizpůsobilo své výrobní postupy tak, aby kromě tradiční velkovýroby léčivých přípravků umožňovaly výrobu menších šarží určených pro malé skupiny pacientů.
Ve společnosti Exelead bylo vyvinuto rozsáhlé úsilí, aby se přizpůsobilo těmto malým šaržím léčivých přípravků, které často vyžadují drahé API a rychlou dobu realizace. U léků specifických pro pacienta nebo antigen nezbývá mnoho času od okamžiku, kdy je oligonukleotid sekvenován, do doby, kdy je třeba přípravek formulovat na našem pracovišti. Tyto krátkodobé prognózy, někdy jen šest týdnů, představují výzvu, kterou se nám podařilo překonat zdokonalením našich stávajících systémů a začleněním inovativních formulačních technik.
Široké uplatnění
Ačkoli personalizovaná medicína má potenciál léčit téměř jakoukoli nemoc, současný výzkum se zaměřuje především na 1) imunoterapii, 2) konvenční terapii rozšířenou pomocí farmakogenomiky a 3) léčbu rakoviny související s biomarkery. Liposomy a LNP mají uplatnění jako nosiče pro každou z těchto kategorií léčivých přípravků, což z nich činí nepostradatelný přínos v této nové oblasti farmaceutického vývoje.

Referenční články
- Gao W, Hu C-MJ, Fang RH, Zhang L. Liposome-like Nanostructures for Drug Delivery. Journal of materials chemistry B, Materials for biology and medicine. 2013;1(48):10.1039/C3TB21238F. doi:10.1039/C3TB21238F.
- Kraft JC, Freeling JP, Wang Z, Ho RJY. Emerging Research and Clinical Development Trends of Liposome and Lipid Nanoparticle Drug Delivery Systems [Nové trendy ve výzkumu a klinickém vývoji liposomů a lipidových nanočástic pro podávání léčiv]. Journal of pharmaceutical sciences. 2014;103(1):29-52. doi:10.1002/jps.23773.
- Theresa M. Allen, Pieter R. Cullis. Lipozomální systémy pro podávání léčiv: From concept to clinical applications [Od konceptu ke klinickým aplikacím]. Advanced Drug Delivery Reviews. 2013 Jan;65(1):36-48
- Esposito L. What Does Personalized Medicine Really Mean? US News: Health Care. 2018 Jan;
- Wan C, Allen TM, Cullis PR. Lipidové nanočásticové doručovací systémy pro terapie na bázi siRNA. Drug Deliv Transl Res. 2014 Feb;4(1):74-83. doi: 10.1007/s13346-013-0161-z.
- Vogenberg FR, Isaacson Barash C, Pursel M. Personalized Medicine: Část 1: Evoluce a vývoj k teranostice. Farmacie a terapie. 2010;35(10):560-576.