Úvod
Imunofluorescence (IF) využívá protilátky a fluorescenční detekci ke studiu lokalizace, relativní exprese a aktivačních stavů cílových proteinů ve fixovaných buňkách nebo tkáních. IF se široce používá v různých oblastech studia.
IF lze použít k zodpovězení otázek, jako jsou:
- Jaké buňky nebo tkáně exprimují můj cílový protein (proteiny)?
- Jak se mění exprese a/nebo aktivace mého cílového proteinu v reakci na experimentální poruchy?
- Kde v buňce/tkáni je cílový protein lokalizován?
- Jaký je prostorový vztah mezi různými cílovými proteiny v kontextu buněčné nebo tkáňové architektury?
Imnofluorescence zahrnuje řadu souvisejících technik, které se v průběhu času vyvíjely. Všechny tyto techniky využívají specifické rozpoznávání biologických cílů pomocí protilátek a detekci fluorescenčních reportérů v cytometrické analýze. Je důležité zajistit, aby byl biologický vzorek dobře zachován a zároveň byly cílové antigeny přístupné protilátkám, což však může představovat výzvu, která se liší v závislosti na vzorku, cíli a protilátce.
Na této stránce jsme shromáždili zdroje, které vám pomohou orientovat se v protokolech, zodpovědět běžné otázky a pomoci vám navrhnout úspěšné experimenty s IF.
Výběr správné techniky a protokolu IF
Optimální techniku/protokol IF ovlivňuje typ biologického materiálu, kroky zpracování vzorku, vlastnosti cílového antigenu a konkrétní použitá protilátka.
Mezi ně patří:
- Vstupním materiálem mohou být kultivované buněčné linie, zmrazená tkáň nebo tkáň fixovaná formalínem a zalitá parafínem (FFPE).
- Pro kultivované buněčné linie a primární buňky hledejte protilátky validované pro imunofluorescenční imunocytochemii (IF-IC).
- V mnoha laboratořích se „imunohistochemie/IHC“ používá jako souhrnný termín pro tkáň, která je buď zalitá v parafínu, nebo zmražená, a může zahrnovat jak chromogenní, tak fluorescenční detekci. Na stránkách cellsignal.com se v aplikacích rozlišuje mezi zmrazenými (IF-F) a parafinovými tkáňovými preparáty.
- Pro vzorky tkáně FFPE lze protilátky validované pro imunohistochemii (IHC-P) použít také s fluorescenční detekcí bez zesílení, pokud je cílový antigen hojný, nebo v multiplexované IHC (mIHC) se zesílením signálu.
- Protilátka může být validována pro jednu nebo více z výše uvedených aplikací. Doporučení pro protokoly jsou výsledkem testování vědců během procesu validace.
- Protokoly specifické pro jednotlivé produkty naleznete na webových stránkách každého produktu. U protilátek validovaných IF vyberte na stránce produktu položku „IF“ a zobrazte údaje o validaci IF a protokol. Základní informace (ředění/pracovní koncentrace, validované aplikace, druhová reaktivita, hostitelský druh) pro každou protilátku jsou uvedeny v datovém listu produktu.
- Nejčastěji používané protokoly IF naleznete také na stránce s protokoly.
- Nepotřebujete nebo nechcete používat fluorescenční detekci pro vzorky tkání? Alternativním přístupem je chromogenní detekce, která je popsána na stránce IHC.
Výběr protilátek pro IF: důležitost validace protilátek
Nejlepší protilátky poskytují silný, specifický signál s minimálním pozadím. Je důležité vybrat protilátky, které byly validovány v aplikaci, kterou budete používat. Validace protilátek v IF může zahrnovat experimenty s pozitivní a negativní expresí (pomocí knockoutovaných buněčných linií, genetických modelů, CRISPR nebo RNAi), experimentální manipulaci s lokalizací cílového proteinu nebo posttranslačními modifikacemi a optimalizaci protokolu.
Výkonnost protilátek se liší podle aplikace. Protilátka, která se dobře osvědčí například v experimentu Western blot, se může, ale nemusí osvědčit v IF. Během testování nových protilátek budou některé vykazovat drobné necílové vazby; ty se nikdy nedoporučují pro IF nebo jiné aplikace než WB. Kromě toho může protilátka dobře fungovat na zmražené tkáni, ale ne na tkáni FFPE, nebo naopak. Citlivost a výkonnost protilátek se může měnit v závislosti na způsobu fixace a zpracování vzorku a na podmínkách práce s protilátkou.
Pokud jste se rozhodli, jaký typ biologických vzorků použijete ve svém experimentu a jak budou připraveny, nejjednodušší způsob, jak procházet protilátky na webu cellsignal.com, je nejprve vybrat vhodnou aplikaci. Poté můžete zadat vyhledávací termíny nebo vybrat další atributy (například hostitelský druh, oblast výzkumu a další), abyste dále zpřesnili vyhledávání a vybrali protilátku, která byla validována v aplikaci, kterou potřebujete.
Návrh kontrolních experimentů pro IF
Chcete-li mít jistotu, že váš návrh experimentu a výsledky a že vaše protilátka věrně informuje o svém cíli, mohou být informativní pozitivní a negativní kontrolní experimenty. Například:
- Pouze sekundární kontroly vám mohou říci, zda nedochází k nespecifické vazbě sekundární protilátky.
- Potvrdit specifičnost primární protilátky navržením experimentů Knockout/siRNA nebo porovnáním známých exprimujících a neexprimujících buněčných linií.
- Experimenty s jedním cílem se používají při nastavení zobrazování se spektrálním odmícháním. Tento typ experimentu může pomoci určit, zda je nedostatečné barvení způsobeno sterickou překážkou, ke které dochází, když jsou 2 antigeny v těsné blízkosti jeden druhého.
- Ošetřete vzorky fosfatázou, abyste potvrdili, že fosfo-specifické protilátky rozpoznávají v IF pouze fosforylovaný cíl.
- Pokud máte podezření na problémy s fixací nebo permeabilizací, může vám při řešení problémů pomoci kontrola s protilátkou, která ve vaší laboratoři fungovala v minulosti.
Vědci společnosti Cell Signaling Technology (CST) běžně provádějí tyto typy kontrol jako součást našeho validačního procesu (viz příklad). Může se vyplatit nastavit podobné kontroly ve vašem experimentálním modelovém systému, zejména pokud máte potíže s dosažením požadovaných výsledků.
Primární vs. sekundární protilátky a přímé vs. nepřímé barvení
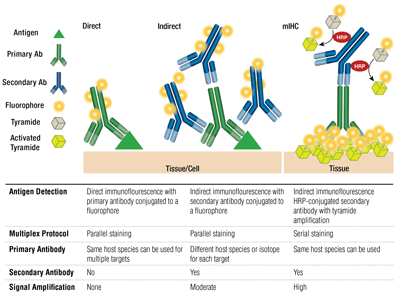
Primární protilátky zajišťují specifické rozpoznání cílového antigenu. Sekundární protilátky se vážou na primární protilátky na základě druhu, ve kterém byly vychovány. Primární protilátky, které byly vychovány na králíkovi nebo myši, lze detekovat pomocí sekundárních protilátek proti králíkovi, respektive proti myši.
Spojení primární protilátky a sekundární protilátky (specifické pro hostitelský druh primární protilátky), která je konjugována s fluoroforem, se nazývá nepřímé barvení. Použití primárních protilátek konjugovaných s fluorofory bez sekundárních protilátek je známo jako přímé barvení. Metody přímého barvení šetří čas a umožňují multiplexování pomocí protilátek vypěstovaných u stejného hostitelského druhu. Nepřímé barvení tradičně nabízí vyšší citlivost díky zesílení signálu, ke kterému dochází, když se na jednu primární protilátku naváže více sekundárních protilátek.
K dispozici jsou i další varianty těchto technik, například použití biotinylovaných primárních protilátek s fluorochromem konjugovaným s avidinem/streptavidinem. Fragmenty sekundárních protilátek konjugované s fluoroforem F(ab‘)2 (bez Fc domény) mohou pomoci snížit pozadí. Při mIHC se používají sekundární protilátky konjugované s křenovou peroxidázou (HRP), které katalyzují ukládání konjugátů tyramidu a fluoroforu.
Výběr protilátek fluoroforů
Výběr protilátek fluoroforů
Kolik cílů/protilátek lze multiplexovat?
Multiplexování využívá detekci více než 1 cíle najednou prostřednictvím více protilátek a detekci různých vlnových délek (barev) pro každý cíl. U nepřímého barvení je schopnost multiplexování založena na párování fluoroforem konjugovaných, druhově specifických sekundárních protilátek ke každé primární protilátce. Myší protilátky různých izotypů lze také multiplexovat pomocí izotypově specifických sekundárních protilátek, což umožňuje detekci až 5 myších protilátek najednou. Pro přímé barvení by měla být každá primární protilátka spojena s jiným fluoroforem. To umožňuje kombinovat více protilátek stejného druhu/izotypu a také umožňuje barvení „myš na myš“, protože nespecifická vazba sekundárních protilátek proti myším na myší tkáň není problémem.
Při navrhování multiplexních IF experimentů je třeba vzít v úvahu spektrální charakteristiky fluorescenčního mikroskopu, včetně dostupných excitačních zdrojů a filtračních sad, aby se zabránilo spektrálnímu prosakování. Moderní epifluorescenční a konfokální fluorescenční mikroskopy mají obvykle schopnost rozlišit 3 nebo více kanálů.
Kombinace barvení protilátek s barvivy nebo značkami
Buněčná barviva, která se aplikují po fixaci, nebo fixovatelné značky živých buněk lze začlenit do pracovního postupu IF. Značení organel se často používá k ověření subcelulární lokalizace cíle. Expresní značky, jako je GFP, se často používají ke sledování transfekovaných buněk nebo v mozaikových experimentech; pokud je fluorescenční signál GFP nízký, lze v IF použít protilátku proti GFP. Použití barviv nebo fluorescenčních proteinů obsadí fluorescenční kanály, takže jich zůstane méně k dispozici pro protilátky.
Výběr fluoroforů pro váš experiment
To bude záviset na spektrálních charakteristikách excitačního zdroje a excitační/emisní filtraci, kterou máte k dispozici. Před spuštěním experimentu vyhodnoťte excitační a emisní profil fluoroforu, abyste zabránili prosakování fluorescence. Společnost CST nabízí řadu primárních a sekundárních protilátek konjugovaných s fluoroforem, včetně barviv řady Alexa Fluor®.
Příprava vzorků
Tkáň
Tkáňové řezy lze připravit buď rychlým zmrazením v médiu s optimální řeznou teplotou (OCT), nebo fixací a vložením do parafínu. Zmrazené vzorky lze před dalším krokem rozřezat pomocí kryostatu a nechat na sklíčku 10 až 15 minut vyschnout na vzduchu před fixací. U vzorků tkáně FFPE se požadavky na kroky odběru, fixace a vložení do parafínu mohou lišit v závislosti na konkrétním typu tkáně.
Mražená vs. FFPE tkáň
Tkáň FFPE obecně poskytuje lepší morfologii než zmrazená tkáň vložená do OCT. To může usnadnit kvantifikaci pozitivních buněk nebo identifikaci hranic mezi barveními. Tkáň FFPE je také velmi stabilní; jednou vložené bloky tkáně lze skladovat roky. Tento typ tkáně se také snáze přepravuje mezi laboratořemi a je preferovanou metodou zpracování vzorků z lidské patologie.
Na druhou stranu tkáň FFPE prochází několika dalšími kroky zpracování, které snižují celkové množství antigenu v důsledku degradace proteinů, vyžadují kroky demaskování k detekci zbývajícího antigenu a zhoršují aldehydem indukovanou autofluorescenci. Pokud se nepracuje s velmi hojným proteinem, může být obtížné detekovat zbývající antigen pomocí nepřímé IF a může vyžadovat amplifikaci, aby se získalo vhodné barvení. Je také možné, že získávání antigenu může demaskovat antigeny, které by normálně nebyly detekovány, a protilátka, která jinak poskytuje očekávaný vzor barvení, může poskytnout nespecifické barvení. Stejně tak je možné pracovat s cílem, kde je k detekci cílového epitopu zapotřebí specifická metoda získávání antigenu. Proto je důležité zvážit, jakým způsobem je protilátka validována a jaké kroky jsou nutné k jejímu použití.
V případě zmrazené tkáně vložené do OCT je redukce zpracování upřednostněna před morfologií. Jedná se o nejrychlejší metodu získání výsledků imunobarvení, protože preparáty jsou připraveny k použití v okamžiku, kdy je tkáň rozřezána, a před vložením je třeba provést méně kroků zpracování. Dochází k menší degradaci bílkovin a pro navázání protilátky je k dispozici více antigenu, aniž by bylo nutné provádět další náročné kroky zpětného získávání. Protože tato metoda nevyžaduje amplifikaci, je citlivější na kvalitu tkáně. Typ fixace (alkohol vs. aldehyd), doba trvání (některé cíle, např. transkripční faktory, vyžadují kratší dobu fixace) a stáří tkáně (zejména po rozřezání) jsou důležité a liší se podle cíle. A konečně, práce se zmraženou tkání poskytuje větší flexibilitu při výběru cíle, protože ke zpracování může dojít po rozřezání, což umožňuje větší přizpůsobení návrhu testu.
Kultivované buňky
Buňky musí být nasazeny na podpůrný materiál kompatibilní s fluorescenční mikroskopií. Mezi typické nosiče patří misky pro kultivaci buněk se skleněným dnem, skleněné krycí sklíčka (uchovávané v plastových kultivačních miskách) připravené s polylysinem a/nebo složkami extracelulární matrix pro podporu adherentní buněčné kultury a komerčně dostupné komůrky s více jamkami namontované na skleněných sklíčkách, které jsou kompatibilní s mikroskopy.
Upozorňujeme, že podmínky kultivace buněk mohou ovlivnit zdraví buněk, morfologii a expresi/lokalizaci vašeho cílového proteinu a v konečném důsledku diktovat kvalitu vašich dat IF. Ujistěte se, že jsou vaše buňky zdravé, pravidelnou kontrolou kultivačního média na změny pH a kontrolou známek buněčného stresu (jako jsou vícejaderné buňky) při malém zvětšení na mikroskopu. Zkontrolujte také, zda je konfluence buněk vhodná pro daný typ buněk a cíl.
Fixace vzorku
Ideální fixační prostředek zachovává „živý“ snímek a zároveň rychle zastavuje degradační proces autolýzy zesíťováním a inhibicí endogenních enzymů a představuje antigen pro rozpoznání protilátkou. Bohužel neexistuje jediná fixační metoda, která by fungovala ideálně u každého vzorku a pro každý antigen. Dokonce i různé antigeny na stejném cílovém proteinu mohou vykazovat rozdíly mezi protokoly. Proto se nejlepší protokol může lišit nejen podle typu vzorku, ale i podle epitopu (a protilátky).
Tkáň
U čerstvě zmrazené tkáně by nyní měly být řezy, které byly zmrazeny a rozřezány kryostatem, ošetřeny fixativem. Alternativně lze vzorky tkáně uchovat nejprve fixací pomocí transkardiální perfuze nebo ponořením, postfixačními a kryokonzervačními kroky, po nichž následuje zmrazení a řez.
Při zpracování FFPE tkání se tkáň uchovává pomocí imerzní fixace formalinem (nebo jiným fixativem na bázi aldehydů) nebo perfuzí, jak je uvedeno výše, po níž následuje vložení do parafínu a řez. Před inkubací s protilátkou musí řezy projít kroky deparafinizace, rehydratace a získání antigenu, aby se protilátky dostaly ke vzorku a navázaly cílové molekuly.
Buňky
Opláchnutí buněk teplým bezproteinovým médiem nebo PBS bezprostředně před fixací může zabránit vysrážení extracelulárních proteinů a zbytků. Rychlé fixace se dosáhne rychlou výměnou média za fixační roztok.
Fixace aldehydem vs. fixace alkoholem
Fixační prostředky na bázi aldehydů, jako je formaldehyd, formalin (směs rozpuštěného formaldehydu s nižším procentem metanolu) a glutaraldehyd, se nejčastěji používají, pokud je nejdůležitější zachovat strukturu. Pro většinu protilátek doporučuje CST fixaci 4% formaldehydem (bez metanolu). Aldehydy reagují s primárními aminy buněčných proteinů a zesíťují je a stabilizují vzorek. Kromě toho se zesíťováním deaktivují buněčné enzymy, včetně fosfatáz a proteáz. Aldehydy procházejí plazmatickou membránou a fixují rozpustné proteiny lépe než alkoholy, ale některé cíle mohou zesíťováním aldehydů ztratit svou antigenicitu.
Dehydratační/denaturační alkoholová fixativa, jako je metanol, vytěsňují vodu kolem buněčných makromolekul, což vede k jejich denaturaci a vysrážení in situ. Denaturace cílového proteinu může odhalit pohřbené epitopy, což činí tento přístup pro některé protilátky výhodnější než aldehydová fixace. Dehydratační fixační prostředky jsou však méně vhodné pro rozpustné cíle a protilátky specifické pro stav modifikace, jako jsou fosfo-protilátky. Optimální způsob fixace zjistíte v datasheetu produktu.
Výběr permeabilizačního činidla
Pokud se použije síťovací fixační činidlo, bude plazmatická membrána stále neporušená, takže intracelulární cíle budou pro protilátky nepřístupné. Proto by měla být permeabilizace provedena až po síťující fixaci, pokud vaše protilátky nerozpoznávají extracelulární epitopy. Optimální metoda permeabilizace se liší v závislosti na protilátce; doporučený protokol vždy naleznete na stránce produktu.
Obvyklé je použití permeabilizace Tritonem® X-100 po fixaci. Triton a další detergenty, jako jsou NP-40, TWEEN®, Saponin, Digitonin a DOTMAC, interagují s buněčnými membránami a vytvářejí různě velké „póry“, které umožňují přístup k protilátkám.
Alternativně lze po kroku fixace provést permabilizaci alkoholem s etanolem nebo metanolem. Tato metoda kombinuje rychlou fixaci síťujícími fixativy s přechodnou denaturací proteinů a delipidací membrány. To může zlepšit signál pro určité cíle, zejména ty, které jsou spojeny s organelami nebo cytoskeletem.
Jaké fixační/permalizační podmínky mám použít při multiplexování?
Pokud multiplexujete s protilátkami, které vyžadují různé protokoly CST, možná budete muset upřednostnit, kterou protilátku použít při jejích optimálních podmínkách. Příklad optimalizace pořadí prováděné v mIHC je uveden v této aplikační poznámce (PDF). Provedení testovacího běhu v malém měřítku s porovnáním různých protokolů může být informativní před rozšířením vašich experimentů.
Výběr blokovacího činidla
Nejběžnějším doporučením je 5% normální kozí sérum (nebo sérum stejného druhu jako sekundární protilátka) v PBS + 0,3% Triton® X-100. Doporučené blokovací činidlo naleznete v datasheetu.
Jsou-li ve vzorku přítomny Fc receptory, signál protilátky bude pocházet ze směsi specifického rozpoznání cíle (prostřednictvím vazebného místa antigenu/variační oblasti protilátky) a také z nespecifické absorpce vazby těžkého řetězce protilátky na Fc receptory. Celkový IgG přítomný ve zvířecím séru blokuje Fc receptory, aby zabránil vazbě primárních a sekundárních protilátek a snížil šum pozadí. Výběr fragmentů F(ab‘)2 konjugovaných s fluoroforem rovněž zabrání vazbě Fc receptorů pro sekundární protilátku (ale ne pro primární protilátku)
V jiných aplikacích založených na protilátkách, jako je western blotting, snižují blokovací kroky signál pozadí způsobený nespecifickou vazbou primárních a sekundárních protilátek s nižší afinitou na jiná místa, než je jejich zamýšlený cíl. Zjistili jsme však, že rekombinantní králičí monoklonální protilátky, které byly důsledně testovány v IF, fungují dobře na mnoha vzorcích s blokováním i bez něj. Nakonec výběr kvalitních protilátek validovaných v imunofluorescenci značně pomáhá vyhnout se šumu na pozadí.
Koncentrace protilátek a poměr signál/šum v IF
Poměr signál/šum (S/N) souvisí se specifičností a citlivostí protilátky v konkrétní aplikaci. S/N lze vypočítat porovnáním „signálu“ intenzity fluorescence v buňkách, které exprimují sledovaný cíl, s „šumem pozadí“ buněk, které expresi postrádají. Pokud je protilátka aplikována v příliš nízké koncentraci, bude fluorescenční signál příliš slabý na to, aby se odlišil od šumu pozadí. Na druhou stranu příliš vysoká koncentrace přispěje k obarvení pozadí a sníží S/N. Doporučené ředění, které je založeno na titracích provedených během validace protilátky, vždy zjistěte v datovém listu produktu.
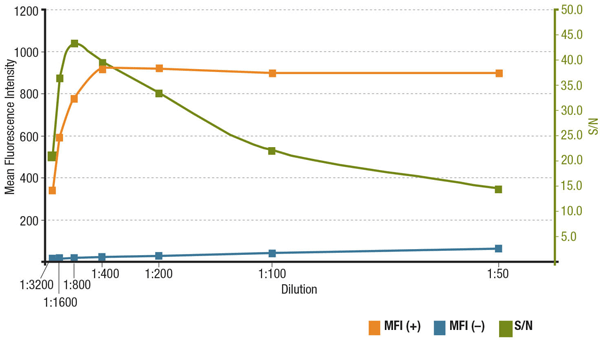
Analýza S/N pro MUC1 (D9O8K) XP® Rabbit mAb #14161 ředění. Kvantifikace střední intenzity fluorescence u exprimujících (MFI(+), oranžová) buněk ZR-75-1 a neexprimujících (MFI(-), modrá) buněk HCT 116 a výpočet S/N (zelená).
Analýza S/N pro MUC1 (D9O8K) XP® Rabbit mAb #14161 ředění. Kvantifikace střední intenzity fluorescence u exprimujících (MFI(+), oranžová) buněk ZR-75-1 a neexprimujících (MFI(-), modrá) buněk HCT 116 a vypočtená S/N (zelená).
Doba inkubace protilátky
Obecně platí, že inkubace přes noc při 4 °C vede k silnému signálu. Změna doby inkubace a teploty může změnit signál a S/N. Různé protilátky mohou na změnu inkubačních podmínek reagovat různě; více informací naleznete v tomto příspěvku na blogu.
Potřebuji k provedení IF přístup ke konfokálnímu mikroskopu?
IF lze provádět na jakémkoli fluorescenčním mikroskopu s vhodným zdrojem excitace a filtrací, včetně epifluorescenčních, skenovacích a konfokálních mikroskopů s rotujícím diskem. Imunofluorescence je také obecně kompatibilní se specializovanými fluorescenčními technikami, včetně fluorescence s totálním vnitřním odrazem (TIRF), mikroskopie světelného listu a některých technik superrozlišení.
Kompatibilita s automatizovaným vysoce výkonným screeningem/vysokoobsahovou analýzou
Každá protilátka schválená pro IF-IC může být použita při vysoce výkonném screeningu (HCS) a vysokoobsahové analýze (HCA). Tyto experimenty jsou založeny na standardních technikách IF, které zahrnují automatizaci.
Narazili jste na problémy s vaším experimentem IF?
Cell Signaling Technology, CST a XP jsou ochranné známky společnosti Cell Signaling Technology, Inc. Všechny ostatní ochranné známky jsou majetkem příslušných vlastníků.