Kekulé Structure for Benzene
O benzenu bylo známo, že má molekulový vzorec C6H6, ale jeho strukturní vzorec nebyl znám.
Pokud by byl benzen nenasycený uhlovodík s přímým řetězcem, měl by snadno podléhat adičním reakcím (stejně jako ostatní alkeny a alkyny).
Například brom, Br2, by měl adovat přes dvojnou nebo trojnou vazbu, jak je uvedeno níže:
| možná adiční reakce s přímou strukturou: | |||
| CH3-C≡C-C≡C-CH3 | + Br2 | → | CH3-CBr=CBr-C≡C-CH3 |
Ale, při přidání bromu k benzenu při 25 °C a 1 atm (101.3 kPa) tlaku, k žádné reakci zřejmě nedochází.
Možné struktury benzenu zahrnující dvojné a/nebo trojné vazby uspořádané do řetězce se tedy zdály být nanejvýš nepravděpodobné, protože by měly podléhat adičním reakcím.
Pokud se k benzenu přidá brom v přítomnosti FeBr3, proběhne substituční reakce, při níž je jeden z atomů vodíku nahrazen atomem bromu a vznikne sloučenina se vzorcem C6H5Br, jak je uvedeno níže:
| známá substituční reakce: | |||||||||
| C6H6 | + Br2 | FeBr3 → |
. | C6H5Br | + HBr | ||||
V tomto ohledu, se benzen choval mnohem více jako nasycený uhlovodík (pouze jednoduché vazby mezi atomy uhlíku).
Takže první struktura navržená Kekulém pro benzen v roce 1865 neobsahovala žádné dvojné vazby, ale uspořádala 6 atomů uhlíku do kruhu, jak je uvedeno níže:
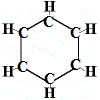
Kekulé si uvědomil, že tato molekula porušuje pravidlo tetravazby pro uhlík, to znamená, že každý atom uhlíku vytváří pouze 3 vazby, a nikoliv 4.
V roce 1872 tedy Kekulé navrhl strukturu benzenu složenou ze tří střídavých jednoduchých a dvojných vazeb, jak je uvedeno níže:

Všimněte si, že ačkoli atomy uhlíku nejsou ve struktuře zapsány, vždy se rozumí, že atom kabonu existuje tam, kde se spojují dvě linie šestiúhelníku, takže existuje 6 „spojů“, 6 úhlů, a tedy 6 atomů uhlíku.
V této struktuře je každý atom uhlíku vázán na atom vodíku a na dva další atomy uhlíku. Jedna z vazeb uhlík-uhlík je jednoduchá vazba, druhá vazba uhlík-uhlík je dvojná vazba. Každý atom uhlíku má vytvořeny 4 vazby.
Ačkoli tato struktura nevysvětluje, proč benzen nepodléhá adičním reakcím, mohla by vysvětlit, proč benzen tvoří pouze jeden strukturní izomer, když benzen reaguje s bromem v substituční reakci, jak je uvedeno níže:
 předpokládaná struktura benzenu |
+ Br2 | → |  pouze 1 strukturní izomer |
. | + HBr |
Ostatní navrhované struktury kruhu pro benzen by předpovídaly více než jeden strukturní izomer pro produkt substituční reakce, jak je uvedeno níže:
| jiná navrhovaná struktura kruhu reakce: | 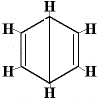 |
Br2 → |
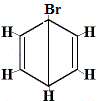 strukturní izomer 1 |
+ | . | 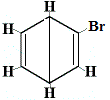 strukturní izomer 2 |
Co by se stalo, kdyby byl další atom vodíku nahrazen (substituován) atomem bromu?
| C6H5Br | + Br2 | FeBr3 → |
C6H4Br2 | + HBr |
Kolik strukturních izomerů C6H4Br2 by vzniklo?
 |
Br2 → FeBr3 |
.  strukturální izomer 1 |
+ | 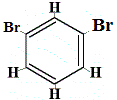 strukturální izomer 2 |
+ | 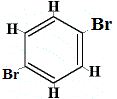 strukturní izomer 3 |
+ |  strukturní izomer 4 |
Strukturní izomery 1 a 4 se liší, protože v izomeru 1 jsou dva atomy Br vázány na atomy uhlíku na C-.C, zatímco v isomeru 4 jsou oba atomy Br vázány na atomy uhlíku na vazbě C=C.
Při substituční reakci C6H5Br vyrobeného z benzenu s bromem však vznikají pouze 3 strukturní izomery C6H4Br2!
Za účelem vyřešení tohoto problému Kekulé navrhl, že benzenový kruh je v rychlé rovnováze mezi strukturami, v nichž jsou dvojné vazby v alternativních polohách, jak je uvedeno níže:
 |
⇋ | 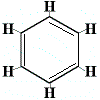 |
Když tedy brom reaguje s C6H5Br v substituční reakci za vzniku C6H4Br2, dvojice strukturních izomerů C6H4Br2 jsou mezi sebou v rovnováze.
To znamená, že výše uvedené strukturní izomery 1 a 4, které se liší pouze tím, že atomy Br jsou vázány přes jednoduchou nebo dvojnou vazbu, jsou nyní mezi sebou v rychlé rovnováze, jak je uvedeno níže:
| Br atomy na sousedních C atomech, strukturní izomer 1 má atomy Br přes C-C strukturní izomer 4 má atomy Br přes C=C |
 strukturní izomer 1 |
⇋ |  strukturní izomer 4 |
Podle Kekulého, jsou tyto dva strukturní izomery C6H4Br2 v tak rychlé rovnováze, že je nelze oddělit jako dvě samostatné molekuly, takže se zdá, že existují pouze 3 izomery místo 4.
Ačkoli se tato rychlá rovnovážná struktura pro benzen, známá jako Kekulého struktura, ukázala jako užitečná, nevysvětluje jedinečnou stabilitu (nedostatek reaktivity) benzenového kruhu, nevysvětluje, proč benzen nepodléhá snadno adičním reakcím, ale lze ho k adičním reakcím přimět.
Rozumíte tomu?
Připojte se k AUS-e-TUTE!
Napište si nyní test!
.