Definice vodíkové vazby
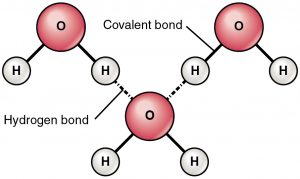
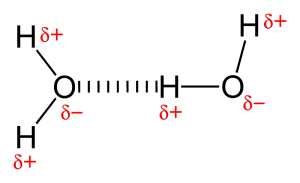
Vodíková vazba je přitažlivá síla mezi částečně kladně nabitým vodíkem a částečně záporně nabitým atomem (kyslík a dusík). Jedná se o velmi slabou vazbu a síla vodíkové vazby (5-10 Kcal na vazbu) je mnohem menší než síla kovalentní vazby. Vodíkové vazby se obvykle zobrazují jako tečkované čáry mezi dvěma atomy. Například vodíková vazba mezi dvěma molekulami vody je znázorněna níže:
Důvod vodíkové vazby
Vzhledem k přítomnosti velmi elektronegativního atomu, jako je kyslík nebo dusík, je společný elektronový pár mezi kyslíkem a vodíkem přitahován k elektronegativnějšímu atomu. Toto nerovnoměrné rozdělení elektronového páru vede ke vzniku dvou částečných dipólů. Částečně kladně nabitý vodík je pak přitahován druhým částečně záporně nabitým kyslíkem nebo dusíkem, což je známé jako vodíková vazba.
Typy vodíkové vazby
Vodíková vazba může vznikat mezi dvěma atomy stejné molekuly nebo mezi dvěma atomy různých molekul. V závislosti na tom jsou dva typy vodíkové vazby:
- Intermolekulární vodíková vazba
- Intramolekulární vodíková vazba
Intermolekulární vodíková vazba
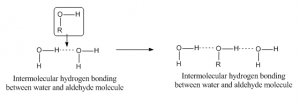
Když vodíková vazba vzniká mezi to atomy různých molekul, pak se nazývá intermolekulární vodíková vazba. Pro takovou vazbu by jedna molekula měla mít částečně kladný vodík jako akceptorový atom a druhá by měla mít částečně záporný nebo donorový atom. Jako příklad je uvedena vodíková vazba mezi aldehydem a molekulou vody:
2. Intramolekulární vodíková vazba
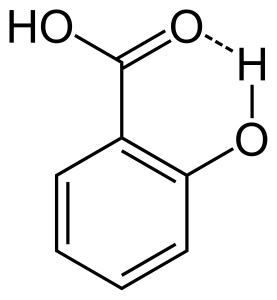
Když dochází k vodíkové vazbě mezi dvěma částečně nabitými atomy téže molekuly, nazývá se to intramolekulární vodíková vazba. K tomu dochází, když jsou ve stejné molekule přítomny dvě funkční skupiny, které se mohou vzájemně přitahovat a vytvářet vodíkovou vazbu. Například kyselina salicylová má dvě funkční skupiny alkohol a karboxylovou kyselinu. Zde dochází k intramolekulární vodíkové vazbě mezi atomem vodíku skupiny alkoholu a atomem kyslíku skupiny kyseliny karboxylové.
Vliv vodíkové vazby
Na bod varu
Očekává se, že bod varu látek o stejné nebo podobné molekulové hmotnosti by měl mít stejný nebo podobný bod varu. Teplota varu éteru a alkanu s podobnou molekulovou hmotností nejsou od sebe příliš vzdáleny. Bod varu alkoholů je však mnohem vyšší než bod varu éteru o podobné molekulové hmotnosti. To lze vysvětlit z hlediska vodíkových vazeb. Díky vodíkovým vazbám v alkoholu teplota varu stoupá. K přerušení vodíkové vazby před varem je zapotřebí dodatečná energie. Protože vodíkové vazby neexistují, alkany a étery mají nízký bod varu.

O rozpustnosti
Alkoholy jsou rozpustné ve vodě, ale alkany ne. Je to proto, že sloučeniny s mezimolekulární vodíkovou vazbou se mohou rozpouštět v rozpouštědle s mezimolekulární vodíkovou vazbou. Polární molekula, jako je alkohol, může vstoupit do dvou molekul vody a vytvořit vodíkovou vazbu, zatímco nepolární látka, jako jsou alkany, nikoli. S rostoucím počtem uhlíkových řetězců v alkoholech však rozpustnost klesá, protože dlouhý řetězec brání vytvoření vodíkové vazby.
Shrnutí
- Vodíková vazba je přitažlivá síla mezi částečně kladně nabitým vodíkem a částečně záporně nabitým atomem.
- Když vodíková vazba vzniká mezi to atomy různých molekul, pak se nazývá mezimolekulární vodíková vazba.
- Když vodíková vazba vzniká mezi dvěma částečně nabitými atomy téže molekuly, tak se nazývá intramolekulární vodíková vazba.
- V důsledku mezimolekulární vodíkové vazby je teplota varu polárních sloučenin vyšší než u nepolárních sloučenin se stejným a.
- V důsledku vodíkové vazby mezi organickou sloučeninou a vodou je možné do určité míry rozpustnost.