Kekulé struktur for benzen
Benzen var kendt for at have molekylformlen C6H6, men dets strukturformel var ukendt.
Hvis benzen var et retkædet umættet kulbrinte, skulle det let undergå additionsreaktioner (ligesom andre alkener og alkyner).
For eksempel skulle brom, Br2, tilføje over dobbelt- eller trippelbindingen som vist nedenfor:
| mulig retkædet strukturadditionsreaktion: | ||||
| CH3-C≡C-C≡C-CH3 | + Br2 | → | CH3-CBr=CBr-C≡C-CH3 | |
Men, når brom tilsættes til benzen ved 25°C og 1 atm (101.3 kPa) tryk, synes der ikke at ske nogen reaktion.
Så de mulige strukturer for benzen, der involverer dobbelt- og/eller trippelbindinger arrangeret i en kæde, syntes mest usandsynlige, da disse skulle undergå additionsreaktioner.
Hvis brom tilsættes til benzen i tilstedeværelse af FeBr3, gennemgår det en substitutionsreaktion, hvor et af hydrogenatomerne erstattes af et bromatom, hvorved der dannes en forbindelse med formlen C6H5Br, som vist nedenfor:
| kendt substitutionsreaktion: | ||||||||
| C6H6 | + Br2 | FeBr3 → |
C6H5Br | + HBr | ||||
I denne henseende, opførte benzen sig meget mere som et mættet kulbrinte (kun enkeltbindinger mellem kulstofatomer).
Så den første struktur, som Kekulé foreslog for benzen i 1865, indeholdt ingen dobbeltbindinger, men arrangerede de 6 kulstofatomer i en ring som vist nedenfor:
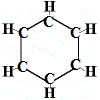
Kekulé indså, at dette molekyle bryder tetravalensreglen for kulstof, det vil sige, at hvert kulstofatom kun danner 3 bindinger i stedet for 4.
Så i 1872 foreslog Kekulé en benzenstruktur bestående af tre skiftende enkelt- og dobbeltbindinger som vist nedenfor:
Bemærk, at selv om kulstofatomerne ikke er skrevet i strukturen, forstås det altid, at der findes et cabonatom, hvor to linjer i sekskanten mødes, således at der er 6 “samlinger”, 6 vinkler og dermed 6 kulstofatomer.
I denne struktur er hvert kulstofatom bundet til et hydrogenatom, og til to andre kulstofatomer. Den ene af kulstof-kulstofbindingerne er en enkeltbinding, den anden kulstof-kulstofbinding er en dobbeltbinding. Hvert kulstofatom har lavet 4 bindinger.
Mens denne struktur ikke forklarer, hvorfor benzen ikke undergår additionsreaktioner, kan den forklare, hvorfor benzen kun danner én strukturel isomer, når benzen reagerer med brom i en substitutionsreaktion som vist nedenfor:
 foreslået benzenstruktur |
+ Br2 | → |  kun 1 strukturel isomer |
+ HBr |
De andre foreslåede ringstrukturer for benzen ville have forudsagt mere end én strukturel isomer for produktet af substitutionsreaktionen, som vist nedenfor:
| Andre foreslåede ringstrukturreaktioner: | 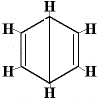 |
Br2 → |
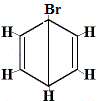 strukturisomer 1 |
+ | 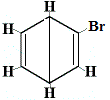 strukturel isomer 2 |
Hvad ville der ske, hvis et andet hydrogenatom blev erstattet (substitueret) med et bromatom?
| C6H5Br | + Br2 | FeBr3 → |
C6H4Br2 | + HBr |
Hvor mange strukturelle isomerer af C6H4Br2 vil der blive fremstillet?
 |
Br2 → FeBr3 |
 strukturel isomer 1 |
+ | 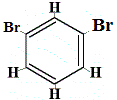 strukturel isomer 2 |
+ | 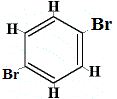 strukturel isomer 3 |
+ |  strukturel isomer 4 |
De strukturelle isomerer 1 og 4 er forskellige, fordi de to Br-atomer i isomer 1 er bundet til kulstofatomer på en C-C-binding, mens de to Br-atomer i isomer 4 er bundet til kulstofatomer på en C=C-binding.
Hvorimod, når C6H5Br fremstillet af benzen reagerer med brom i en substitutionsreaktion, dannes der kun 3 strukturelle isomerer af C6H4Br2!
For at løse dette problem foreslog Kekulé, at benzenringen er i hurtig ligevægt mellem strukturer, hvor dobbeltbindingerne befinder sig i de alternative positioner som vist nedenfor:
 |
⇋ | 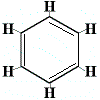 |
Så når brom reagerer med C6H5Br i en substitutionsreaktion for at producere C6H4Br2, er par af strukturelle isomerer af C6H4Br2 i ligevægt med hinanden.
Det betyder, at de ovenfor viste strukturisomerer 1 og 4, som kun adskiller sig ved, at Br-atomer er bundet over en enkeltbinding eller en dobbeltbinding, nu er i hurtig ligevægt med hinanden som vist nedenfor:
| Br-atomer på tilstødende C-atomer, strukturisomer 1 har Br-atomer på tværs af C-C strukturisomer 4 har Br-atomer på tværs af C=C |
 strukturisomer 1 |
⇋ |  strukturisomer 4 |
Ifølge Kekulé, er disse to strukturelle isomerer af C6H4Br2 i så hurtig ligevægt, at de ikke kan adskilles som to separate molekyler, så det ser ud til, at der kun er tre isomerer i stedet for fire.
Selv om denne hurtige ligevægtsstruktur for benzen, kendt som Kekulé-strukturen, viste sig at være nyttig, forklarer den ikke den unikke stabilitet (manglende reaktivitet) af benzenringen, den forklarer ikke, hvorfor benzen ikke let undergår additionsreaktioner, men kan induceres til at undergå additionsreaktioner.
Forstår du dette?
Gå med i AUS-e-TUTE!
Tag testen nu!