Kekulé Structuur voor Benzeen
Van benzeen was bekend dat het de molecuulformule C6H6 had, maar de structuurformule was onbekend.
Als benzeen een onverzadigde koolwaterstof met een rechte keten was, zou het gemakkelijk additiereacties moeten ondergaan (net als andere alkenen en alkynen).
Broom, Br2, zou bijvoorbeeld over de dubbele of drievoudige binding moeten toevoegen, zoals hieronder wordt getoond:
| mogelijke additiereactie met een rechte-ketenstructuur: | |||
| CH3-C≡C-C≡C-CH3 | + Br2 | → | CH3-CBr=CBr-C≡C-CH3 |
Maar, wanneer broom aan benzeen wordt toegevoegd bij 25°C en 1 atm (101.3 kPa) druk, lijkt er geen reactie op te treden.
Dus de mogelijke structuren voor benzeen met dubbele en/of drievoudige bindingen die in een keten zijn gerangschikt, leken het meest onwaarschijnlijk omdat deze additiereacties zouden moeten ondergaan.
Als broom aan benzeen wordt toegevoegd in aanwezigheid van FeBr3, ondergaat het een substitutiereactie waarbij een van de waterstofatomen wordt vervangen door een broomatoom om een verbinding met de formule C6H5Br te produceren, zoals hieronder getoond:
| bekende substitutiereactie: | ||||||||
| C6H6 | + Br2 | FeBr3 → |
C6H5Br | + HBr | ||||
In dit opzicht, gedroeg benzeen zich veel meer als een verzadigde koolwaterstof (alleen enkelvoudige bindingen tussen koolstofatomen).
De eerste structuur die Kekulé in 1865 voor benzeen voorstelde, bevatte dus geen dubbele bindingen, maar rangschikte de 6 koolstofatomen in een ring zoals hieronder is aangegeven:
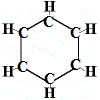
Kekulé realiseerde zich dat deze molecule de tetravalentie-regel voor koolstof breekt, dat wil zeggen dat elk koolstofatoom slechts 3 bindingen vormt in plaats van 4.
Dus stelde Kekulé in 1872 een benzeenstructuur voor, bestaande uit drie afwisselende enkele en dubbele bindingen, zoals hieronder weergegeven:

Merk op dat, hoewel de koolstofatomen niet in de structuur worden geschreven, men altijd begrijpt dat een cabonatoom bestaat waar twee lijnen van de zeshoek samenkomen, zodat er 6 “samenvoegingen” zijn, 6 hoeken, en dus 6 koolstofatomen.
In deze structuur is elk koolstofatoom gebonden aan een waterstofatoom, en, aan twee andere koolstofatomen. Eén van de koolstof-koolstofbindingen is een enkelvoudige binding, de andere koolstof-koolstofbinding is een dubbele binding. Elk koolstofatoom heeft 4 bindingen gemaakt.
Hoewel deze structuur niet verklaart waarom benzeen geen additiereacties ondergaat, zou het wel kunnen verklaren waarom benzeen slechts één structurele isomeer vormt wanneer benzeen reageert met broom in een substitutiereactie zoals hieronder getoond:
 voorgestelde structuur van benzeen |
+ Br2 | → |  slechts één structuurisomeer |
+ HBr |
De andere voorgestelde ringstructuren voor benzeen zouden meer dan één structurele isomeer hebben voorspeld voor het product van de substitutiereactie, zoals hieronder wordt weergegeven:
| andere voorgestelde ringstructuurreactie: | 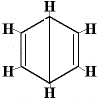 |
Br2 → |
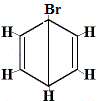 structureel isomeer 1 |
+ | 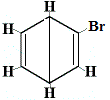 structuurisomeer 2 |
Wat zou er gebeuren als een ander waterstofatoom werd vervangen (gesubstitueerd) door een broomatoom?
| C6H5Br | + Br2 | FeBr3 → |
C6H4Br2 | + HBr |
Hoeveel structurele isomeren van C6H4Br2 zouden er ontstaan?
 |
Br2 → FeBr3 |
 structureel isomeer 1 |
+ | 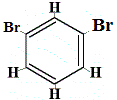 structureel isomeer 2 |
+ | 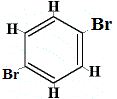 structuurisomeer 3 |
+ |  structuurisomeer 4 |
structuurisomeren 1 en 4 zijn verschillend omdat in isomeer 1 de twee Br-atomen gebonden zijn aan koolstofatomen op een C-C-binding, terwijl in isomeer 4 de twee Br-atomen zijn gebonden aan koolstofatomen op een C=C-binding.
Als C6H5Br gemaakt van benzeen echter in een substitutiereactie reageert met broom, ontstaan slechts 3 structuurisomeren van C6H4Br2!
Om dit probleem op te lossen, stelde Kekulé voor dat de benzeenring in snel evenwicht is tussen structuren waarin de dubbele bindingen zich in de alternatieve posities bevinden, zoals hieronder weergegeven:
 |
⇋ | 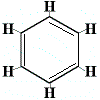 |
Wanneer broom dus in een substitutiereactie reageert met C6H5Br om C6H4Br2 te produceren, zijn paren van structurele isomeren van C6H4Br2 in evenwicht met elkaar.
Dit betekent dat de structurele isomeren 1 en 4 die hierboven zijn afgebeeld en die alleen verschillen in het feit dat de Br-atomen over een enkele binding of een dubbele binding zijn gebonden, nu in snel evenwicht met elkaar zijn zoals hieronder is afgebeeld:
| Br-atomen aan aangrenzende C-atomen, structuurisomeer 1 heeft Br atomen over C-C structuurisomeer 4 heeft Br atomen over C=C |
 structuurisomeer 1 |
⇋ |  structuurisomeer 4 |
Volgens Kekulé, zijn deze twee structurele isomeren van C6H4Br2 in zo’n snel evenwicht dat ze niet kunnen worden gescheiden als twee afzonderlijke moleculen, zodat het lijkt dat er slechts 3 isomeren zijn in plaats van 4.
Hoewel deze snelle-evenwichtsstructuur voor benzeen, bekend als de Kekulé-structuur, nuttig bleek te zijn, verklaart zij niet de unieke stabiliteit (gebrek aan reactiviteit) van de benzeenring, zij verklaart niet waarom benzeen niet gemakkelijk additiereacties ondergaat, maar wel kan worden geïnduceerd om additiereacties te ondergaan.
Begrijpt u dit?
Doet u mee aan AUS-e-TUTE!
Doe de test nu!