Generel introduktion
De fleste af os ved, at gær er en meget nyttig organisme, især i forbindelse med bagning, vinfremstilling og brygning. Men hvad er gær, og hvorfor er de genstand for så meget forskning?

Gær er svampe
Gær er encellede mikroorganismer, der sammen med skimmelsvampe og svampe er klassificeret som medlemmer af kongeriget svampe. Gær er evolutionært forskelligartet og er derfor klassificeret i to separate fylaer, Ascomycota eller sækkesvampe og Basidiomycota eller højere svampe, der tilsammen udgør underriget Dikarya. Knoppegær, også kaldet “ægte gær”, er medlemmer af phylum Ascomycota og ordenen Saccharomycetales. Sådanne klassifikationer er baseret på egenskaber ved cellen, ascosporen og kolonien samt på cellens fysiologi.
Gær er encellede, men med en celleorganisation, der ligner højere organismer
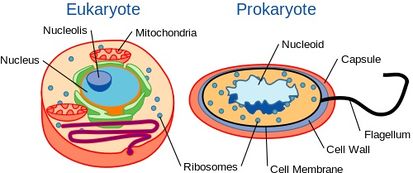
Selv om gær er encellede organismer, har de en celleopbygning, der ligner højere organismers, herunder menneskers. Mere specifikt er deres genetiske indhold indeholdt i en kerne. Dette klassificerer dem som eukaryote organismer i modsætning til deres encellede modstykker, bakterier, som ikke har en kerne og betragtes som prokaryoter.
Naturlige levesteder
Gær er vidt spredt i naturen med en bred vifte af levesteder. De findes almindeligvis på planteblade, blomster og frugter samt i jorden. Gær findes også på overfladen af huden og i tarmkanalen hos varmblodede dyr, hvor de kan leve i symbiose eller som parasitter. Den almindelige “gærinfektion” er typisk forårsaget af Candida albicans. Ud over at være årsag til vaginale gærinfektioner er Candida også årsag til udslæt i bleer og trøske i mund og hals.
Hvorfor studere gær?
Forestil dig en organisme, der vokser hurtigt i en kolbe, og hvis DNA let kan manipuleres, men som også giver indsigt i grundlæggende menneskelige biologiske processer, herunder sygdom. Gær passer på denne beskrivelse og er i fokus for forskere over hele verden, hvilket har resulteret i mere end 50.000 offentliggjorte videnskabelige artikler, der beskriver gærforskning!

Hvilke specifikke egenskaber ved gær gør den til en “modelorganisme” til studier og til genstand for så meget forskning? Gær er encellede (encellede) organismer, hvilket gør dem enkle at studere, men de har en celleorganisation, der ligner den, der findes i højere, flercellede organismer som f.eks. mennesker – dvs. de har en kerne og er derfor eukaryoter, som beskrevet ovenfor. Vigtigst af alt er, at ligheden i den cellulære organisation mellem gær og højere eukaryoter fører til ligheder i deres grundlæggende cellulære processer, så opdagelser i gær giver ofte direkte eller indirekte fingerpeg om, hvordan biologiske processer fungerer i mennesker.

En anden vigtig egenskab ved gær, der er afgørende for deres rolle som “modelorganismer”, er, at de er relativt nemme at arbejde med. Gær formerer sig hurtigt og er nemme at manipulere genetisk. Fordoblingstiden for gær (den tid, det tager for en celle at duplikere og dele sig selv) er ca. 90 minutter. I modsætning hertil skal menneskelige celler, der vokser i kultur, bruge omkring 24 timer på at fordoble sig. Der findes også veldefinerede genetiske metoder for gær, som gør det let for forskerne at isolere mutanter, krydse dem med andre mutanter eller med andre genetiske baggrunde og kortlægge genernes placering. Faktisk gav genetiske kort, der er konstrueret på grundlag af den genetiske afstand mellem generne, forskerne deres første overblik over genomet og dets organisation, og de var kulminationen på genetiske undersøgelser, der går tilbage til første halvdel af det 20. århundrede.
Et hurtigere opdagelsestempo blev muliggjort, efter at bagegærens (S. cerevisiae) genom, der repræsenterer dens komplette sæt af genetisk materiale, blev det første eukaryote genom, der blev sekventeret tilbage i 1996. Det er mindre og mere kompakt end det menneskelige genom (12 millioner basepar og ~6 000 gener sammenlignet med 3 milliarder basepar og ~20-25 000 proteinkodende gener). Alligevel viser sammenligninger af genomerne, at ~31 % af gærgenerne er meget lig menneskelige gener, og at 20 % af de menneskelige sygdomsgener har modstykker i gæren. Desuden kan gærceller eksistere enten som haploider (ét sæt kromosomer) eller som diploider (to sæt kromosomer). Da haploider kun har én kopi af hvert gen og en effektiv afbrydelse og genforening af DNA-strenge (rekombination), er det meget let at slette et bestemt gen i en haploid og observere virkningerne på cellen, eller “fænotypen” af deletionsmutanten. Diploide celler gør det på den anden side muligt at undersøge essentielle gener (de gener, der er nødvendige for vækst og levedygtighed) ved at slette den ene kopi af genet og foretage subtile ændringer i den anden kopi. Endelig er der med oplysningerne fra genomsekvensen blevet opbygget en omfattende værktøjskasse af molekylære reagenser og genom-dækkende samlinger, som giver forskerne effektive midler til at undersøge biologiske problemer. Hvis man ved, at et gærgen ligner et menneskeligt gen i DNA-sekvensen, kan undersøgelser i gæren give et godt fingerpeg om, hvilken rolle det eller de beslægtede gener spiller i mennesket. Den relative enkelhed, hvormed man kan studere cellulære funktioner i gær kombineret med dens relevans for højere organismer, gør den således til en meget effektiv “modelorganisme” til studier.
Gærs liv og cellecyklus
Gær vokser typisk aseksuelt ved knopskydning. En lille knop, som bliver dattercellen, dannes på modercellen og udvider sig ved fortsat vækst. Efterhånden som dattercellen vokser, duplikeres modercellen og adskiller derefter sit DNA. Kernen deler sig og vandrer ind i dattercellen. Når knoppen indeholder en kerne og har nået en vis størrelse, adskilles den fra modercellen. Den række af begivenheder, der finder sted i en celle og fører til fordobling og deling, kaldes cellecyklus. Cellecyklussen består af fire forskellige faser (G1, S, G2 og M) og er reguleret på samme måde som cellecyklussen i større eukaryoter. Så længe der er tilstrækkeligt med næringsstoffer som sukker, kvælstof og fosfat til stede, vil gærcellerne fortsætte med at dele sig aseksuelt.
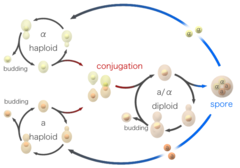
Gærceller kan også formere sig seksuelt. Gærceller findes som en af to forskellige parringstyper, a-celler og alfaceller. Når celler af modsatte parringstyper blandes sammen i laboratoriet eller tilfældigt kommer i kontakt i naturen, kan de parre sig (konjugere). Inden de forenes ændrer cellerne form i en proces, der kaldes shmooing. Udtrykket “shmoo” blev opfundet på grund af dets lighed i form med en fiktiv tegneseriefigur af samme navn, der blev skabt i slutningen af 40’erne af Al Capp, og som først optrådte i hans tegneserie L’il Abner. Under konjugationen smelter de haploide celler først sammen, og derefter smelter deres kerner sammen, hvilket resulterer i dannelsen af en diploid celle med to kopier af hvert kromosom. Når de er dannet, kan diploide celler reproducere sig aseksuelt ved knopskydning i lighed med haploide celler. Men når diploide celler bliver udsultet for næringsstoffer, gennemgår de sporulation. Under sporulationen gennemgår diploide celler meiose, en særlig form for celledeling, som reducerer antallet af kromosomer fra to kopier tilbage til én kopi. Efter meiosen pakkes de haploide kerner, der er produceret i meiosen, i fire sporer, der indeholder modificerede cellevægge, hvilket resulterer i strukturer, der er meget modstandsdygtige over for miljømæssig stress. Disse sporer kan overleve i lange perioder, indtil forholdene bliver mere gunstige, f.eks. ved tilstedeværelse af bedre næringsstoffer, hvorefter de er i stand til at spire og reproducere sig aseksuelt. Disse forskellige tilstande, knopning, konjugation og sporulation udgør tilsammen gærens livscyklus.

Gærvækst og stofskifte
Når gærceller dyrkes i rige kulstofkilder som f.eks. glukose foretrækker de at vokse ved gæring. Under fermenteringen omdannes glukose til kuldioxid og ethanol. Generelt sker gæringen i fravær af ilt og er derfor af natur anaerob. Selv i tilstedeværelse af ilt foretrækker gærceller at vokse fermentativt, og dette kaldes Crabtree-effekten efter den biolog, der opdagede denne præference. Denne vækstform udnyttes ved fremstillingen af brød, øl, vin og andre alkoholholdige drikkevarer. Selv om spirende gærceller foretrækker at vokse ved gæring, er de også i stand til at vokse ved celleånding, når næringsstofferne er begrænsede. Under respirationen omdanner cellerne glukose til kuldioxid og vand, idet de forbruger ilt i processen og resulterer i produktion af meget større mængder energi i form af ATP.
Historiske opdagelser

Jost er blevet brugt som en industriel mikroorganisme i 1000-vis af år. De gamle egyptere brugte gærgæring til at syrne brød. Der findes beviser på slibesten, bagekamre og tegninger af 4000 år gamle bagerier. Arkæologiske udgravninger har afdækket beviser i form af krukker med rester af vin, der er 7.000 år gamle.
Gebyr blev først visualiseret i 1680 af Antoni van Leeuwenhoek ved hjælp af højkvalitetsobjektiver. Han troede dog, at disse kugler var stivelsesholdige partikler fra det korn, der blev brugt til at fremstille urt, det flydende ekstrakt, der bruges til brygning, snarere end gærceller under gæring. I 1789 bidrog Antoine Lavoisier, en fransk kemiker, til vores forståelse af de grundlæggende kemiske reaktioner, der er nødvendige for at fremstille alkohol fra sukkerrør. Ved at vurdere andelen af udgangsmaterialer og produkter (ethanol og kuldioxid) efter tilsætning af gærpasta konkluderede han, at der blev anvendt to kemiske veje, hvor to tredjedele af sukkeret blev reduceret til alkohol og en tredjedel til kuldioxid. På det tidspunkt troede man imidlertid, at gæren blot var til stede for at sætte reaktionen i gang og ikke var nødvendig i hele processen.
I 1815 udviklede Joseph-Louis Gay-Lussac, en fransk kemiker, metoder til at holde druesaft i ugæret tilstand og opdagede, at det var nødvendigt at tilføre “ferment” (som indeholder gær) for at omdanne ugæret urt, hvilket viste gærens betydning for alkoholisk gæring. I 1835 brugte Charles Cagniard de la Tour et kraftigere mikroskop til at vise, at gær var encellede og formerede sig ved knopskydning. I 1850’erne opdagede Louis Pasteur, at fermenterede drikkevarer skyldes gærens omdannelse af glukose til ethanol, og han definerede fermentering som “åndedræt uden luft”. Mod slutningen af 1800-tallet brugte Eduard Buchner cellefrie ekstrakter, der blev fremstillet ved at kværne gærceller, til at påvise zymase, en samling enzymer, der fremmer eller katalyserer gæring, og for dette fik han Nobelprisen i 1907.
Meget af det banebrydende arbejde med gærgenetik blev udført af Øjvind Winge. Han opdagede, at gær veksler mellem haploide og diploide tilstande, og at gær er heterotallisk, da der kræves to stammer for at omdanne haploide til diploide (konjugation). Han og hans kollega Otto Laustsen udviklede teknikker til at mikromanipulere gær, så de kunne undersøges genetisk. Med denne teknik, der er kendt som “tetradanalyse”, anvendes en fin nål og et mikroskop til at isolere en struktur, der er kendt som en ascus, som indeholder de fire sporprodukter eller tetrad, der er resultatet af sporulationen af en diploid. Når ascus’en er isoleret, skilles sporerne i tetrad’en ad og får lov til at vokse til kolonier med henblik på genetisk analyse. Dette banebrydende arbejde gav ham titlen “Gærgenetikkens fader”. En del af dette arbejde blev yderligere afklaret af Carl Lindegren, som belyste parringstypesystemet i knopskydende gær, idet han påviste eksistensen af Mat a- og Mat alpha-celler, udtænkte metoder til at gennemføre masseparringer mellem celler af disse parringstyper og brugte denne viden til at studere genetikken for sukkerudnyttelse.
Siden den tid har mange andre forskere udført banebrydende forskning ved hjælp af knopskydende gær. Nogle af disse forskere er blevet tildelt Nobelprisen for vigtige opdagelser, der blev gjort under disse undersøgelser, bl.a: Dr. Leland Hartwell (2001) for opdagelsen af gener, der regulerer cellecyklussen (sammen med Paul Nurse og Tim Hunt), Roger Kornberg (2006) for hans undersøgelser af det første trin i genekspressionen, dvs. den måde, hvorpå en genes DNA-sekvens kopieres til messenger RNA (mRNA), dr. Elizabeth Blackburn, Carol Greider og Jack Szostak (2009) for at have opdaget og belyst de gener og midler, hvormed cellerne beskytter kromosomeenderne eller telomererne mod nedbrydning, og til Dr. Randy Schekman, James Rothman og Thomas Südhof (2013) for deres forskning i det maskineri, der regulerer vesikulær trafik. Senest har dr. Yoshinori Ohsumi fået prisen for sit arbejde med autofagi, som begyndte med studier i gær.
Kommercielle anvendelser

Gær har længe været anset for at være den foretrukne organisme til fremstilling af alkoholholdige drikkevarer, brød og en lang række industrielle produkter. Dette er baseret på den lethed, hvormed gærens stofskifte kan manipuleres ved hjælp af genteknikker, den hurtighed, hvormed den kan dyrkes til et højt celleudbytte (biomasse), den lethed, hvormed denne biomasse kan adskilles fra produkterne, og den viden, at den er generelt anerkendt som sikker (GRAS).
Den spirende gær S. cerevisiae og andre gærarter har længe været anvendt til at fermentere sukkerarter fra ris, hvede, byg og majs til fremstilling af alkoholholdige drikkevarer som f.eks. øl og vin. Der findes to hovedtyper af bryggerigær, overgærende ølgær og undergærende pilsnergær. Topgær som f.eks. cerevisiae stiger op til overfladen under gæringen og bruges til at brygge ales, portere, stouts og hvedebær. I modsætning hertil er S. pastorianus (tidligere kendt som S. carlsbergensis) en undergærende gær, der anvendes til fremstilling af lagerøl. Lagergær vokser bedst ved lavere temperaturer. Derfor vokser de langsommere, producerer mindre skum på overfladen og lægger sig derfor typisk i bunden af gæringsbeholderen. Pilsner, Märzen, Bocks og amerikansk maltlikør er alle typer af lagerøl. I moderne brygning er mange af de oprindelige topgærende stammer blevet modificeret til at blive bundgærere.
Gær producerer vin ved at gære sukker fra druesaft (most) til ethanol. Selv om gæringen af vinen kan indledes af naturligt forekommende gær, der er til stede i vinmarkerne, vælger mange vinhuse at tilsætte en ren gærkultur for at dominere og kontrollere gæringen. Boblerne i champagne og mousserende vin fremstilles ved en sekundær gæring, typisk på flaske, som fanger kuldioxiden. Kuldioxid, der produceres ved vinfremstilling, frigives som et biprodukt. En gærcelle kan gære ca. sin egen vægt i glukose i timen. Under optimale forhold kan S. cerevisiae producere op til 18 volumenprocent ethanol, idet 15-16 % er normen. Svovldioxiden i kommercielt fremstillet vin tilsættes lige efter, at druerne er knust, for at dræbe de naturligt tilstedeværende bakterier, skimmelsvampe og gær.

Saccharomyces cerevisiae eller bagegær har længe været brugt som hævemiddel i bagværk. Bakkegær gær gærer sukkerstoffer i dejen og producerer kuldioxid og ethanol. Kuldioxiden bliver fanget i små bobler i dejen, hvilket får dejen til at hæve. Surdejsbrød er en undtagelse, da det ikke fremstilles med bagergær, men i stedet med en kombination af vildgær og bakterier. Gæren Candida milleri bruges til at styrke gluten, og en syredannende bakterie “Lactobacillus sanfranciscensis” bruges til at fermentere maltosen.
Ud over disse traditionelle anvendelser er gær også blevet anvendt til mange andre kommercielle formål. Veganere bruger ofte gær som osteerstatning, og det bruges ofte som topping til produkter som popcorn. Den anvendes i den petrokemiske industri, hvor den er blevet udviklet til at producere biobrændstoffer som f.eks. ethanol og farnesen, en forløber for diesel og jetbrændstof. Det anvendes også til fremstilling af smøremidler og rengøringsmidler. Gær anvendes i fødevareindustrien til fremstilling af fødevaretilsætningsstoffer, herunder farvestoffer, antioxidanter og smagsforstærkere. Det anvendes ofte til fremstilling af lægemidler, herunder antiparasitære midler, kræftmidler, biofarmaceutiske midler som insulin, vacciner og nutraceutiske midler. Gær anvendes almindeligvis til fremstilling af industrielle enzymer og kemikalier. Inden for miljømæssig bioremediering er stammer endda blevet udnyttet til at fjerne metal fra mineaffald.
Anvendelse på sygdomme hos mennesker og forskning

I kraft af den høje grad af lighed mellem gærgener og deres menneskelige modstykker og den bevarede grundlæggende cellebiologi er gær blevet et populært modelsystem til undersøgelse af menneskelige sygdomsgener. Der er blevet anvendt flere metoder til at lære mere om menneskelige gener, når der er skabt en forbindelse mellem et menneske- og gærgen. I en af metoderne sammenlignes sekvensen af et humant sygdomsrelateret gen med sekvenserne af alle gener i gærgenomet for at finde frem til det eller de gener i gæren, der ligner mest. For at undersøge, om generne er funktionelt beslægtede, udtrykkes det menneskelige gen derefter i en gærfarve, hvor gærgenet først er blevet inaktiveret ved mutation. Dette giver forskerne mulighed for at afgøre, om det menneskelige gen er i stand til at redde levedygtighed, vækst eller mere specifikke defekter, der er forbundet med tab af gærgenet, en metode, der kaldes funktionel komplementering. Hvis de veje og/eller processer, som et gærgen er involveret i, er bevaret, kan man lære meget om det menneskelige gens funktion på grundlag af det, der allerede er kendt om det beslægtede gærgen. Når funktionel komplementering er blevet etableret, kan forskerne bruge dette system til yderligere at karakterisere funktionen af det beslægtede humane genprodukt. Mindre målrettede metoder, der ofte anvender højhastighedsmetoder (HTP) til tilfældigt at screene tusindvis af menneskelige gener på én gang for at identificere genet eller generne med komplementerende aktivitet. Sådanne tilgange er med succes blevet anvendt til at identificere konserverede cellecyklusregulatorer (CDC2), gener involveret i kræft og gener involveret i neurodegenerative sygdomme.
Der er mange scenarier, hvor undersøgelser kan give værdifulde oplysninger til forskere om de cellulære veje og/eller processer, som et humant gen er involveret i, når et beslægtet gærgen ikke er til stede. For eksempel opstår nogle neurodegenerative sygdomme som Alzheimers og Parkinsons sygdom, når proteinaggregater kaldet amyloid ophobes på grund af proteinfejlfoldning, og dette er giftigt for neuroner. Studiet af fejlfoldede gærproteiner med et lignende amyloiddannende potentiale, kaldet prioner, har givet forskerne indsigt i disse neurodegenerative sygdomme. Alternativt kan forhøjet ekspression af et sygdomsassocieret gen i gær resultere i en fænotype. For eksempel er alfa-synuclein, et gen, der er forbundet med Parkinsons sygdom, giftigt, når det udtrykkes i tilstrækkeligt høje niveauer. En sådan stamme kan derefter bruges til at screene for gærgener eller små molekyler, der undertrykker eller forstærker synucleininduceret toksicitet, hvilket ofte giver et fingerpeg om de relevante cellulære veje. Patienter med amyotrofisk lateral sklerose (ALS) eller Lou Gehrigs sygdom har ofte mutationer i et par RNA-bindingsproteiner, som gør dem tilbøjelige til at danne aggregater, der forstyrrer RNA-metabolismen. En gærscreening er blevet anvendt med succes til at identificere en række gærgener med lignende egenskaber (danner giftige aggregater), hvilket har givet forskerne nye kandidatgener til undersøgelse. Omvendt danner de humane RNA-bindingsproteiner, når de udtrykkes i gær, giftige aggregater, og denne stamme blev brugt til at identificere et gærgen, som, når det er muteret, blokerer produktionen af disse aggregater.
Gær er ved at blive den foretrukne organisme i undersøgelser, der sigter mod at identificere lægemiddelmål og virkemåden for forskellige lægemidler. Kemogenomik eller kemisk-genomik henviser til de screeninger, der anvender en kombination af kemikalier og genomik til at undersøge lægemiddelmål og potentielt identificere nye lægemidler. Der er blevet anvendt to hovedmetoder i disse kemisk-genomiske undersøgelser. I den første metode konstrueres en genom-dækkende samling af diploide stammer, hvor en af de to identiske kopier af et gen slettes, hvorved niveauerne af et bestemt genprodukt sænkes. Målgener og gener, der er involveret i målvejen, bliver mere følsomme over for stoffet og identificeres fortrinsvis i denne form for screening. I en anden metode slettes ikke-væsentlige gener systematisk, og samlingen screenes med et lægemiddel for at finde de gener, der er buffer for lægemidlets målvej. Denne fremgangsmåde forventes at identificere de gener, der er nødvendige for vækst i tilstedeværelsen af stoffet. Der er blevet anvendt yderligere metoder med overekspressionsscreening til at identificere gener, der er involveret i lægemiddelresistens, herunder det potentielle lægemiddelmål. Sammenligning af ekspressionsprofilen af gærceller, der er slettet for et gen, med ekspressionsprofilen af gærceller af vild type, der er behandlet med et bestemt lægemiddel, kan også være en effektiv måde at identificere gener, som kan fortælle forskerne noget om, hvordan lægemidlet virker i cellerne.
Dette er blot nogle få eksempler på, hvordan gær kan bruges både som hjælp til undersøgelse af sygdomme hos mennesker. Undersøgelser i gær kan hjælpe forskerne med at lære mere om den underliggende biologi ved hjælp af dette modelsystem, eller hjælpe dem med at identificere lægemiddelmål eller lægemidlernes virkemåde.
Ressourcer
- Saccharomyces Genome Database (SGD) giver omfattende integrerede biologiske oplysninger om den spirende gær Saccharomyces cerevisiae sammen med søge- og analyseværktøjer til at udforske disse data.
- MIPS Comprehensive Yeast Genome Database (CYPD) indeholder oplysninger om den molekylære struktur og det funktionelle netværk for den fuldstændigt sekventerede, velundersøgte model-eukaryot, den spirende gær Saccharomyces cerevisiae.
- Candida Genome Database (CGD), en ressource for genomiske sekvensdata og gen- og proteinoplysninger for Candida albicans.
- PomBase, en omfattende database for fissionsgæren Schizosaccharomyces pombe, der giver strukturel og funktionel annotation, litteraturkuratering og adgang til store datasæt.
- Fungal genome resources at NCBI, en guide til svampegenomressourcer på National Center for Biotechnology Information (NCBI).
- En omfattende liste over gærrelaterede ressourcer om emner lige fra generel gærinformation til nukleinsyrer, genomer og proteiner, ekspressionsdata, lokalisering, fænotyper og meget mere.
Suggested Reading
Bøger
- YeastBook. (2011) Et omfattende kompendium af anmeldelser, der præsenterer den aktuelle viden om molekylærbiologi, cellebiologi og genetik af gæren Saccharomyces cerevisiae, Genetik
- Fra a til alfa: Gær som en model for celledifferentiering. (2007) Hiten D. Madhani, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
- Landmark Papers in Yeast Biology. (2006), redigeret af Patrick Linder, David Shore og Michael N. Hall, Cold Spring Harbor Press, Cold Spring Harbor, New York.
- Methods in Yeast Genetics: A Cold Spring Harbor Laboratory Course Manual. (2005) David C. Amberg, Daniel J. Burke og Jeffrey N. Strathern. Cold Spring Laboratory Press, Cold Spring Harbor, New York.
- The Early Days of Yeast Genetics. (1993) redigeret af Michael N. Hall og Patrick Linder. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
- Volume I: The Molecular and Cellular Biology of the Yeast Saccharomyces cerevisiae: Genome Dynamics, Protein Synthesis, and Energetics. (1991) redigeret af James R. Broach, John R. Pringle og Elizabeth W. Jones. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
- Volume II: The Molecular and Cellular Biology of the Yeast Saccharomyces cerevisiae: Gene Expression: Gene Expression. (1992) redigeret af Elizabeth W. Jones, John R. Pringle og James R. Broach. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
- Volume III: The Molecular and Cellular Biology of the Yeast Saccharomyces cerevisiae: Cell Cycle and Cell Biology: Cell Cycle and Cell Biology. (1997) redigeret af John R. Pringle, James R. Broach og Elizabeth W. Jones. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
- Gær: A Practical Approach. (1988) redigeret af I. Campbell og , og John H. Duffus, IRL Press, Ithaca, New York.
Journal Articles
- Duina A.A., Miller M.E., og J.B. Keeney (2014) Budding Yeast for Budding Geneticists: A Primer on the Saccharomyces cerevisiae Model System. Genetics. 197:33-48.
- Botstein D. og G.R. Fink (2011) Yeast: An Experimental Organism for 21st Century Biology. Genetics. 189:695-704.
- Cherry J.M., Hong E.L., Amundsen C., Balakrishnan R., Binkley G., Chan E.T., Chan E.T., Christie K.R., Costanzo M.C., Dwight S.S., Engel S.R., Fisk D.G., Hirschman J.E., Hitz B.C., Karra K., Krieger C.J., Miyasato S.R., Nash R.S., Park J., Skrzypek M.S., Simison M., Weng S., og E.D. Wong (2011) Saccharomyces Genome Database: the genomics resource of budding yeast. Nucleic Acids Res. 40:D700-D705.
- Altman T.J., Boone C., Churchill G.A., Hengartner M.O., Mackay T.F. og D.L. Stemple (2011) The future of model organisms in human disease research. Nat. Rev. Genet. 18:575-582.
- Ho C.H., Piotrowski J., Dixon S.J., Baryshnikova A., Costanzo M., og C. Boone (2011) Combining functional genomics and chemical biology to identify targets of bioactive compounds. Curr Opin Chem Biol. 15:66-78.
- Smith A.M., Ammar R., Nislow C., og G. Giaever (2010) A survey of yeast genomic assays for drug and target discovery. Pharmacol Ther. 127:156-164.
- Dolinski K., og D. Botstein (2007) Orthology and functional conservation in eukaryotes. Annu. Rev. Genet. 41:465-507.
- Barnett J.A. (2007) A history of research on yeasts 10: foundations of yeast genetics. Yeast 24:799-845.
- Spradling A., Ganetsky B., Hieter P., Johnston M., Olson M., Orr-Weaver T., Rossant J., Sanchez A. og R. Waterston (2006) New roles for model genetic organisms in understanding and treating human disease: report from the 2006 Genetics Society of America meeting. Genetics 172:2025-2032.
- Sherman F. (2002) Getting started with yeast Methods Enzymol. 350:3-41.