Einführung
Die tiefen Mykosen sind seltene, durch Pilze verursachte Infektionen; sie werden in subkutane und systemische Mykosen unterteilt.1 Während Hautmanifestationen bei subkutanen Mykosen oder Implantationsmykosen, wie sie auch genannt werden, immer auftreten, werden sie bei systemischen Mykosen nur gelegentlich gesehen. In diesen Fällen ist die Haut entweder direkt durch das Eindringen des Pilzes in die Dermis oder indirekt durch eine Infektion betroffen, die sich von einem tieferen Herd aus ausgebreitet hat. Nach Angaben von Rezusta et al.2 werden die meisten subkutanen und systemischen Mykosen in Spanien importiert, mit wenigen Ausnahmen (z. B. Mukormykose). Epidemiologische Daten zur Prävalenz und Inzidenz von Mykosen in Spanien fehlen.
Subkutane Mykosen
Die subkutanen Mykosen umfassen mehrere klinische Entitäten, die durch die Invasion der Haut und des subkutanen Gewebes durch saprophytische Pilze verursacht werden, die in Boden und Vegetation leben. Obwohl Schnittverletzungen und Wunden bei Menschen in ländlichen Gebieten sehr häufig sind, gibt es insgesamt nur sehr wenige Fälle von subkutanen Mykosen.1
Der typische Eintrittsweg für den Pilz ist die traumatische Inokulation durch kontaminiertes Material wie Splitter, Dornen oder andere scharfe Gegenstände, was erklärt, warum subkutane Mykosen auch als Implantationsmykosen bezeichnet werden.3
Obwohl die für subkutane Mykosen verantwortlichen Pilze taxonomisch heterogen sind, werden sie durch die Tatsache vereint, dass sie den gleichen Eintrittsweg haben. Jede dieser Infektionen kann Menschen befallen, die in endemische Gebiete gereist sind, selbst Jahre nach ihrer Rückkehr.
Die häufigsten subkutanen Mykosen sind die Sporotrichose, die Chromoblastomykose und das Mycetom.1 Andere, weniger häufige Entitäten sind Lakaziose, Phäohyphomykose, Hyalohyphomykose und Konidiobolomykose.
Sporotrichose
Sporotrichose ist eine subakute oder chronische Infektion, die durch dimorphe Pilze verursacht wird, von denen Sporothrix schenckii die häufigste ist.4,5 Diese Pilze sind universell, obwohl sie in tropischen und subtropischen Gebieten häufiger vorkommen. Die geschätzte Inzidenz der Sporotrichose in Südamerika liegt zwischen 48 und 60 Fällen pro 100000 Einwohner pro Jahr.6,7 In Spanien und anderen Teilen Europas wurden nur wenige autochthone Fälle gemeldet,8 und die Mehrzahl der Fälle in diesen Gebieten wird importiert.9
Die Erreger gehören zu einem Artenkomplex, der als S. schenckii bekannt ist,10,11 der Sporothrix brasiliensis, Sporothrix mexicana, Sporothrix luriei, Sporothrix pallida (früher Sporothrix albicans) und Sporothrix schenckii sensu lato (sl.) umfasst, der die häufigste der fünf Arten ist.12
Nach einer Inkubationszeit von 15 bis 30 Tagen führt eine traumatische Inokulation durch Sporothrix spp. zu einer chronischen Infektion, die durch knotige Läsionen im kutanen und subkutanen Gewebe in Verbindung mit einer Lymphangitis im betroffenen Gebiet gekennzeichnet ist.
Sporothrix spp. leben in der Vegetation, in Pflanzen oder in Pflanzenresten im Boden, weshalb Infektionen bei Landarbeitern und Menschen, die in offenen Gebieten arbeiten, häufiger vorkommen. Die Sporotrichose gilt als Berufskrankheit bei Forstwirten, Gartenbauern, Gärtnern und Landarbeitern im Allgemeinen.4,13 Alkoholismus und Diabetes wurden ebenfalls als Risikofaktoren beschrieben. Eine Immunsuppression, unabhängig von der Ursache, ist ebenfalls ein prädisponierender Faktor für eine disseminierte oder systemische Erkrankung.1 Die Krankheit kann auch durch Manipulation des Pilzes in einer Laborumgebung erworben werden. Schließlich gab es eine interessante Epidemie in Südbrasilien, bei der die Sporotrichose durch Katzenkratzer auf den Menschen übertragen wurde, was darauf hindeutet, dass es sich um eine zoonotische Infektion handeln könnte.14 Die meisten der in diesen Fällen isolierten Arten waren S. brasiliensis.
Klinische Formen5
- 1)
Lymphokutane Sporotrichose. Diese auch als lymphangitische Sporotrichose bezeichnete klinische Form macht über 75 % aller Sporotrichosefälle aus.15 Die Läsionen treten an exponierten Stellen wie Händen, Gesicht und Füßen auf. Die Krankheit beginnt mit einem schmerzlosen violetten oder schwärzlichen Knötchen, das zu einem kleinen Geschwür (sporotrichotischer Schanker) mit geschwollenen Rändern, einem schmerzhaften granulomatösen Zentrum und minimalem Ausfluss erodiert. Darauf folgt eine Lymphangitis mit sekundären Knötchen entlang der Lymphdrainage, die sich zu Geschwüren entwickeln können; dieses charakteristische Muster ist als sporotrichoide Ausbreitung bekannt (Abb. 1).6 Der allgemeine Gesundheitszustand des Patienten ist nicht beeinträchtigt.15 Der Krankheitsverlauf hängt von der Immunantwort des Wirts, der Virulenz des Stammes, der Größe des Inokulums und der Tiefe der Läsion ab.
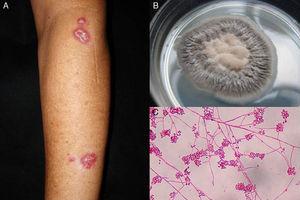 Abbildung 1.
Abbildung 1.A, Lymphangitische Sporotrichose. B, Kultur von Sporothrix schenckii. C, Mikroskopische Untersuchung der Kultur auf Sabouraud-Dextrose-Agar-Medium (Erythrosin 2%, Originalvergrößerung ×40).
(0.21MB). - 2)
Fixierte Sporotrichose. Diese Variante ist durch das Vorhandensein einer solitären Läsion gekennzeichnet. Die Infektion ist begrenzt und zeigt sich in der Regel als langsam wachsende, wenig progressive verruköse Plaque. Die fixe Sporotrichose befällt normalerweise nicht die Lymphgefäße und kommt häufiger in endemischen Gebieten vor.16
- 3)
Andere klinische Formen:
Osteoartikuläre Sporotrichose. Hierbei handelt es sich um eine disseminierte Form der Sporotrichose, die Knochen und Gelenke betrifft; sie ist die häufigste Form der systemischen Beteiligung.17
Primäre pulmonale Sporotrichose. Diese Variante betrifft bevorzugt immunsupprimierte Patienten und wird durch Einatmen erworben. Sie ahmt die kavitäre Tuberkulose nach.16
Metastasierende pulmonale Sporotrichose. Die metastatische Form der pulmonalen Sporotrichose ist selten und wurde nur in Einzelfällen beschrieben. Sie tritt bei immungeschwächten Patienten auf, insbesondere bei Patienten mit einer Infektion mit dem Humanen Immundefizienz-Virus (HIV) im AIDS-Stadium.18
Weit verbreitete Invasion. Eine disseminierte Erkrankung ist bei der Sporotrichose selten, obwohl bei immunsupprimierten Patienten mit unkontrolliertem Diabetes oder chronischem Alkoholismus eine meningeale und okuläre Beteiligung beschrieben wurde.
In Mexiko, wie auch in anderen Ländern Lateinamerikas (wo die größten Fallserien und die meisten Erfahrungen mit Sporotrichose vorliegen), macht die lymphokutane Sporotrichose 60 % bis 80 % aller Sporotrichose-Fälle aus, die fixe kutane Sporotrichose 10 % bis 30 % und andere klinische Formen 1 % bis 2 %.16
Die Sporotrichose muss von der Tuberkulose, der Leishmaniose, der Tularemie, der kutanen Nokardiose, den nichttuberkulösen mykobakteriellen Infektionen, dem Mycetom, der Chromoblastomykose und der lepromatösen Lepra unterschieden werden. Bei vielen dieser Erkrankungen kann eine sporotrichoide (lymphangitische) Ausbreitung beobachtet werden, was bei der Differentialdiagnose berücksichtigt werden muss.19
Diagnose
-
Eiter (aus Knötchen aspiriert). Eine direkte mikroskopische Untersuchung ist bei der Sporotrichose nicht aussagekräftig, da die Läsionen nur sehr wenige Hefeformen enthalten. Sabouraud-Dextrose-Agar (SDA) und SDA mit Antibiotika (Chloramphenicol und Cycloheximid) können für die Kultur verwendet werden, die Hefekolonien hervorbringt, die zunächst weiß sind und sich dann verdunkeln (Abb. 1). Das Wachstum ist typischerweise schnell (3-5 Tage)20 , aber es werden 2 Wochen benötigt, um den Pilz zu identifizieren und die Diagnose zu bestätigen.16 Eine molekulare Identifizierung durch Polymerasekettenreaktion (PCR) ist ebenfalls möglich.10,21
-
Histologie. Die histologische Untersuchung zeigt eine unspezifische gemischte granulomatöse Reaktion mit neutrophilen Mikroabszessen. Der Pilz präsentiert sich als kleine zigarrenförmige Hefeform, die manchmal von charakteristischem, ausstrahlendem eosinophilem Material umgeben ist, das als Asteroidkörper bekannt ist. Asteroidkörper können zwar die Diagnose erleichtern, sind aber nicht pathognomonisch,16,20 da sie auch intrazellulär bei Sarkoidose, Silikose und Lakaziose (Lobomykose) vorkommen. Extrazelluläre asteroide Körper sind jedoch eher charakteristisch für die Sporotrichose. Es können mehrere Proben erforderlich sein, um die Mikroorganismen sichtbar zu machen, obwohl sie im Falle einer disseminierten oder viszeralen Erkrankung leichter zu finden sind.
Behandlung
Die Sporotrichose kann in einigen Fällen spontan abklingen, z. B. während der Schwangerschaft, obwohl paradoxerweise auch bei schwangeren Frauen über eine Dissemination berichtet wurde.
-
Gesättigte Kaliumjodidlösung. Die Behandlung mit Kaliumjodid in Form einer gesättigten Lösung wird mit 5 Tropfen pro Mahlzeit begonnen. Diese Anfangsdosis wird dann schrittweise je nach Verträglichkeit auf 20 oder 30 Tropfen pro Mahlzeit erhöht. Die Behandlung sollte nach Abklingen der klinischen Symptome für 3 bis 4 Wochen fortgesetzt werden. Der Wirkmechanismus ist nicht bekannt, es wird jedoch angenommen, dass Kaliumiodid als Immunstimulans wirkt. Zu den unerwünschten Wirkungen gehören ein metallischer Geschmack im Mund, Rhinitis, Expektoration, Urtikaria, Petechien, bullöser oder akneiförmiger Ausschlag, Vaskulitis und die Induktion einer Hypothyreose oder Hyperthyreose. Kaliumjodid ist während der Schwangerschaft kontraindiziert.20,22
-
Itraconazol 200mg/d für 3 bis 6 Monate.22 Dies ist die in den meisten Behandlungsrichtlinien empfohlene Erstbehandlung. Es ist tendenziell etwas teurer als Kaliumjodid, hat aber weniger Nebenwirkungen.
-
Weitere Optionen. Terbinafin 250-1000mg/d für 3 bis 6 Monate23,24; Fluconazol 400mg/d für 3 bis 6 Monate22; Amphotericin B (Desoxycholat) 0.5-1mg/kg/d für systemische Erkrankungen oder liposomale oder Lipidformulierungen von Amphotericin B in einer Dosis von 3-5mg/kg/d22; lokale Wärme- oder Thermotherapie für 2 oder 3 Monate22 oder eine Kombination der oben genannten Behandlungen (Kaliumiodid mit Itraconazol, Itraconazol mit Terbinafin und Terbinafin mit Kaliumiodid).25 Die zusätzliche photodynamische Therapie mit Methylaminolevulinat oder noch besser intraläsionales Methylenblau 1% (kombiniert oder nicht mit Itraconazol) hat in vitro und bei einem Patienten gute Ergebnisse gezeigt.26
Die Chirurgie kann bei der osteoartikulären Sporotrichose eine wichtige Rolle spielen.22 Debridement und Arthrodese galten traditionell als Behandlungen der Wahl, aber auch der prothetische Gelenkersatz, gefolgt von einer langfristigen antimykotischen Behandlung, wurde als praktikable Option beschrieben
1.1Chromoblastomykose (Chromomykose)
Die Chromoblastomykose, auch als Chromomykose bekannt, ist eine chronische polymorphe Pilzinfektion der Haut und des Unterhautgewebes. Sie wird durch mehrere Arten melanisierter oder dematischer Pilze verursacht, die ein dunkles Pigment produzieren. Die parasitären Formen dieser Pilze werden als fumagoide oder muriforme Zellen (sklerotische Körper) bezeichnet.27-30
Die häufigsten Arten, die Chromoblastomykose verursachen, sind Fonsecaea pedrosoi, Fonsecaea monophora, Cladophialophora carrionii, Phialophora verrucosa und Rhinocladiella aquaspersa.5,27,28 Die meisten Patienten haben eine Vorgeschichte mit einer traumatischen Verletzung, die mit Holz oder Vegetation zu tun hat, und über 80 % sind Landarbeiter in Afrika, Asien und Südamerika, die in der Regel barfuß laufen. Die für die Chromoblastomykose verantwortlichen Pilze wurden weltweit gefunden, obwohl sie in tropischen und subtropischen Ländern häufiger vorkommen.27
Klinische Formen
Der Pilz dringt in der Regel durch eine Hautverletzung in die Haut ein, typischerweise an den unteren Gliedmaßen.31 Etwa ein bis zwei Monate später entwickelt der Infizierte eine Papel, die sich zu einem langsam wachsenden warzigen Knötchen entwickelt (Abb. 2). Die Infektion ist auf das subkutane Gewebe beschränkt und breitet sich nicht auf Muskeln oder Knochen aus, außer bei immungeschwächten Patienten. Einzelne Läsionen können ein dickes, blumenkohlartiges Aussehen entwickeln, und eine bakterielle Superinfektion ist häufig. Sekundäre Lymphödeme, die sich möglicherweise zu Elefantiasis entwickeln, und Plattenepithelkarzinome können auftreten.27
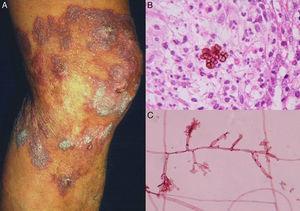
A, knotig-verruköse Chromoblastomykose. B, Biopsie mit fumagoiden Zellen. C, Direkte Untersuchung einer Fonsecaea pedrosoi-Kultur (Biopsie; Hämatoxylin-Eosin und Erythrosin 2%, Originalvergrößerung in beiden Fällen ×40).
Diagnose
-
Direkte Untersuchung. Bei der direkten Untersuchung von Krusten und Hautfragmenten können parasitäre Formen festgestellt werden, die isoliert auftreten oder charakteristische Septen bilden (Abb. 2). Die beobachteten mikroskopischen Strukturen sind allen Arten gemeinsam.27,28
-
Kultur. Die Pilze, die Chromoblastomykose verursachen, wachsen langsam, wenn sie auf SDA mit oder ohne Antibiotika (Chloramphenicol und Cycloheximid) kultiviert werden; sie bilden dunkle olivfarbene oder schwarze Kolonien mit einer flachen, samtigen Oberfläche und einem erhabenen Zentrum. Die Unterscheidung zwischen den Arten ist schwierig und basiert auf den Fortpflanzungsstrukturen und der molekularen Identifizierung.30 Molekularbiologische Techniken (PCR), insbesondere für die internen transkribierten Spacer-Regionen (ITS) der ribosomalen DNA (rDNA), sind ebenfalls nützlich.32,33
-
Histologie. Die histologische Untersuchung zeigt eine charakteristische pseudoepitheliomatöse Hyperplasie in der Epidermis und ein gemischtes granulomatöses entzündliches Infiltrat mit Riesenzellen, die charakteristische runde Pilzstrukturen enthalten (Abb. 2), in der Dermis.27
Behandlung
Die Behandlung der Chromoblastomykose ist äußerst schwierig und oft refraktär gegenüber verschiedenen Optionen, einschließlich nicht-pharmakologischer Behandlungen wie Kürettage, Elektrokoagulation und Kryochirurgie.5 Antimykotika müssen mindestens sechs Monate lang eingenommen werden, und obwohl sie zu einem günstigen klinischen Ergebnis führen können, sind Rezidive während oder nach der Therapie häufig. Die Behandlung sollte beendet werden, wenn alle Läsionen verschwunden sind.27
Andere Behandlungen umfassen die chirurgische Resektion kleiner Läsionen; lokale Kryochirurgie (in Verbindung mit einem Antimykotikum, um eine lymphatische Ausbreitung zu verhindern); Itraconazol 200-400 mg/d allein oder in Kombination mit 5-Fluorocitosin 30 mg/kg viermal täglich für sechs Monate; Terbinafin 250-500 mg/d für 12 Monate und im Falle einer systemischen Beteiligung intravenöses Amphotericin B in einer Dosis von 1 mg/kg oder liposomale oder Lipidformulierungen von Amphotericin B in einer Dosis von 3-5 mg/kg/d.27
Mycetom
Mycetom ist eine chronische lokale Infektion, die durch verschiedene Pilz- und Bakterienarten verursacht wird. Die Infektion wird Aktinomyzetom genannt, wenn sie durch aerobe fadenförmige Bakterien verursacht wird, und Eumyzetom, wenn sie durch Pilze verursacht wird.34 Sie ist durch die Bildung von Aggregaten der verursachenden Mikroorganismen in Abszessen gekennzeichnet. Diese Aggregate werden als Körner oder Granula bezeichnet. Die Körnchen können durch Sinusöffnungen in die Haut austreten oder benachbarte Knochen befallen. Die Krankheit schreitet durch direkte Ausbreitung voran, nur in sehr wenigen Fällen kommt es zu einer Ausbreitung auf entfernte Stellen. Die Erreger befinden sich in der Regel im Boden und gelangen über Hautverletzungen in den Körper. Die meisten Fälle betreffen Landarbeiter.
Ätiologie
-
Pilze. Die Pilze, die Eumyzetome verursachen, produzieren weiße oder dunkle Körnchen. Sie sind besonders häufig in Afrika, Indien und Mexiko anzutreffen. Dunkle Körnchen werden von Madurella mycetomatis, Trematosphaeria grisea und Leptosphaeria senegalensis gebildet,35 während weiße Körnchen von Fusarium spp., Acremonium spp. und Aspergillus nidulans gebildet werden.
-
Filamentöse Bakterien oder aerobe Actinomyceten. Die von diesen Arten gebildeten Körnchen sind rot (Actinomadura pelletieri), weiß-gelb (Actinomadura madurae, Nocardia brasiliensis und Nocardia spp.) oder gelb-braun (Streptomyces somaliensis). Aktinomyzeten kommen überall auf der Welt vor, nicht nur in tropischen Ländern.36
Klinische Formen
Die klinischen Merkmale des durch Pilze und Aktinomyzeten verursachten Mycetoms sind sehr ähnlich. Läsionen sind häufiger an den Füßen, Schienbeinen und Händen zu finden. Die früheste klinische Manifestation ist ein hartes, schmerzloses Knötchen, das sich langsam ausbreitet und Papeln und Sinus bildet, die Flüssigkeit mit Granulat auf die Hautoberfläche absondern.35,36 Die ursprüngliche Infektionsstelle wird durch lokale Gewebeschwellungen, die Bildung chronischer Sinus und eine späte Knochenbeteiligung entstellt (Abb. 3). Die Läsionen sind selten schmerzhaft, außer im Spätstadium.
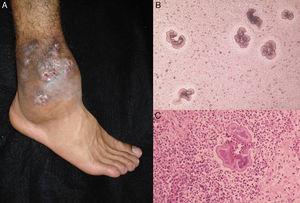
A, Aktinomyzetom des Fußes. B, Körnchen von Nocardia sp. bei direkter Untersuchung (KOH, Originalvergrößerung ×10). C, Biopsie (Hämatoxylin-Eosin ×40).
Diagnose
Mycetom-Granula (Abb. 3) sind ein wichtiger diagnostischer Befund und werden in der Regel bei der Untersuchung von Ausfluss aus Nasennebenhöhlen oder bei der Zerkleinerung einer Kruste aus einer Läsion gefunden. Die mikroskopische Untersuchung zeigt, ob diese Körnchen von kleinen Aktinomyzeten oder breiteren mykotischen Fäden gebildet werden. Die endgültige Identifizierung erfordert eine Kultur, die normalerweise auf SDA mit oder ohne Antibiotika (Chloramphenicol und Cycloheximid) durchgeführt wird; bei hyalinen Pilzen wird Chloramphenicol allein bevorzugt. Die Erreger können auch durch molekularbiologische Tests identifiziert werden, insbesondere durch PCR-Analysen, bei denen je nach Erreger unterschiedliche Marker37 verwendet werden (z. B. ITS-Regionen der rDNA, β-Tubulin38 und D1/D2). Die partielle ribosomale RNA-Gensequenzanalyse kann dagegen zur Identifizierung von Nocardia- und Actinomadura-Arten verwendet werden.36 Die histologischen Befunde sind bei allen Formen von Mycetomen ähnlich und umfassen ein Entzündungszentrum, das reich an polymorphkernigen Zellen (echte Abszesse), epitheloiden Zellen, Riesenzellen und Fibrose ist. Die Granula befinden sich im Zentrum der Entzündung.35,39 Bildgebende Untersuchungen können die Diagnose unterstützen, indem sie Weichteilschwellungen, osteolytische Läsionen und Kortikalverdickungen zeigen.
Die Differentialdiagnose sollte unter anderem bakterielle Osteomyelitis, tuberkulöse Osteomyelitis, Hidradenitis suppurativa, Kaposi-Sarkom und kutane Tuberkulose einschließen.35,39
Behandlung
Aktinomyzetom. Das Behandlungsschema mit der stärksten Evidenzbasis für nokardiale Myzetome ist Trimethoprim-Sulfamethoxazol plus Diaminodiphenylsulfon (Dapson) für 6 Monate bis 2 Jahre. Amoxicillin-Clavulansäure, verabreicht über 6 Monate, kann bei refraktären Fällen eingesetzt werden.40-42 Die Behandlung der Wahl bei ausgedehnten Infektionen und/oder viszeraler Beteiligung ist Amikacin in Kombination mit Trimetoprim-Sulfametoxazol39 oder Meropenem.43,44 Es gibt vereinzelte Berichte über erfolgreiche Ergebnisse mit anderen Wirkstoffen bei Patienten, die auf diese Behandlungen nicht ansprechen.36,39,45
Eumyzetom. Anders als beim Aktinomyzetom, bei dem eine pharmakologische Behandlung mit guten Ergebnissen verbunden ist, besteht die Standardbehandlung beim Eumyzetom aus einer Kombination von medikamentöser Behandlung und Operation. Für den Einsatz von Triazolen der letzten Generation, wie Itraconazol und Fluconazol, die allein oder in Kombination mit Terbinafin eingesetzt werden, wurden akzeptable Ergebnisse gemeldet. Diese Medikamente werden über einen langen Zeitraum und erst nach Ausschöpfung aller chirurgischen Möglichkeiten verabreicht.35,45
Phäohyphomykose
Die Phäohyphomykose ist eine heterogene Gruppe von Mykosen, die durch dunkelwandige (dematiaceous) Pilze verursacht werden.46,47 Diese Pilze kommen in allen Klimazonen vor, obwohl sie in tropischen Klimazonen häufiger vorkommen. In jüngster Zeit ist ein Anstieg der Fälle unter anderem bei immunsupprimierten Patienten mit HIV-Infektion oder AIDS, Transplantationsempfängern und Diabetikern zu verzeichnen.46,48
Die häufigsten Erreger sind Exophiala spp, Bipolaris spp, Curvularia spp, Pleurophomopsis spp, Phaeoacremonium spp und Alternaria spp. Die Pilze finden sich hauptsächlich in organischen Ablagerungen.
Klinische Formen
-
Subkutane Phaeohyphomykose. Nach einem lokalen Trauma oder einer Inokulation mit Fremdmaterial entwickeln die Patienten eine langsam wachsende, solitäre Läsion (im Allgemeinen eine Zyste oder ein Knötchen, möglicherweise auch eine Plaque oder ein Abszess), die sich normalerweise an den Extremitäten befindet (Abb. 4).48,49 Die Differentialdiagnose sollte Lipome, epidermale oder synoviale Zysten, Fibrome, Fremdkörperzysten und bakterielle Abszesse einschließen.
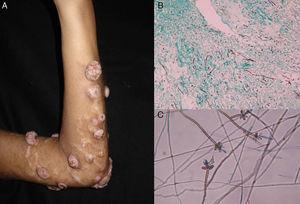 Abbildung 4.
Abbildung 4.A, Noduläre Phäohyphomykose. B, Filamente und Hefen in der Biopsieprobe (Grocott, Originalvergrößerung ×10). C, Mikroskopische Untersuchung von Veronaea botryosa (Lactophenol-Baumwollblau, Originalvergrößerung ×40).
(0.22MB). -
Systemische oder disseminierte Phäohyphomykose. Die systemische Phäohyphomykose ist zwar sehr selten, aber bei immunsupprimierten Patienten sehr ernst zu nehmen.50
Diagnose
Die Nassmikroskopie zeigt diagnostische dunkle septierte Hyphen, die Verzweigungen oder Ketten bilden (Abb. 4). Das Wachstum ist langsam (3-4 Wochen) auf SDA und die Kolonien nehmen eine olivfarbene oder dunkelbraune Farbe an. Die PCR-Analyse von Markern wie β-Tubulin und ITS-Regionen kann zur molekularen Identifizierung verwendet werden.51,52 Die Biopsie zeigt eine Zystenwand, die von palisadierenden Makrophagen mit mykotischen Hyphen gebildet wird.49
Behandlung
Die Behandlung von Infektionen, die durch Exophiala spp. verursacht werden, ist umstritten, und eine Option, die vorgeschlagen wurde, ist die chirurgische Resektion.48 Auch für die Behandlung von Alternaria-Infektionen gibt es keine Standardprotokolle.53 Die beste Option für die Phäohyphomykose scheint eine Kombination aus antimykotischer Therapie (Itraconazol, Ketoconazol oder Terbinafin) und Operation zu sein. Stämme von Exophiala spp. sind in der Regel resistent gegen Fluconazol. Disseminierte Infektionen werden mit Amphotericin B behandelt.48,49
Hyalohyphomykose
Hyalohyphomykose wird durch hyaline Pilze (Hyphomyceten) verursacht, die septierte Hyphen im Gewebe bilden.47 Diese Klassifizierung ist jedoch eher willkürlich, da es viele Arten von terrestrischen und aquatischen Hyphomyceten gibt. Nur wenige Organismen können jedoch Infektionen beim Menschen verursachen, von denen die meisten opportunistisch sind.54,55 Die meisten Gattungen, die an der Hyalohyphomykose beteiligt sind, sind morphologisch identisch, wenn sie in Gewebeschnitten beobachtet werden, und sie lösen die gleiche pathologische Reaktion aus. Pilze, die häufig Infektionen verursachen oder ein anderes besonders ausgeprägtes Merkmal aufweisen, werden einer anderen Kategorie zugeordnet (z. B. Aspergillose).
Die häufigsten Erreger der Hyalohyphomykose sind Aspergillus (fumigatus, niger, flavus), Scopulariopsis spp., Fusarium spp., Acremonium recifei, Paecilomyces spp., Purpureocillum spp. und Neoscytalidium spp.55 Sie sind in der Natur weit verbreitet und können in jeder Art von Boden, Holz oder sich zersetzendem Pflanzenmaterial gefunden werden.56 Sie befallen Menschen jeden Geschlechts und jeden Alters, und eine Immunsuppression ist keine notwendige Voraussetzung für eine Infektion.
Klinische Formen
Hyalohyphomykose kann als oberflächliche, subkutane oder systemische Form klassifiziert werden.
-
Oberflächliche Hyalohyphomykose. Zu den oberflächlichen Infektionen gehören Dermatomykose und Onychomykose. Sie treten häufig bei Landarbeitern, Fischern, Patienten mit schweren Verbrennungen und Frühgeborenen auf.57,58
-
Subkutane Hyalohyphomykose. Eine traumatische Inokulation verursacht Abszesse, Zysten und tumorähnliche Läsionen, die denen eines Mycetoms ähneln (Abb. 5).56
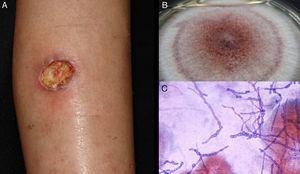 Abbildung 5.
Abbildung 5.Hyalohyphomykosegeschwür durch Acremonium sp. B, Kultur (Sabouraud-Dextrose-Agar-Medium). C, direkte Untersuchung des Exsudats (Giemsa, Originalvergrößerung ×40).
(0.17MB). -
Systemische Hyalohyphomykose. Systemische Infektionen sind zwar ungewöhnlich, aber sehr ernst. Sie betreffen immunsupprimierte Patienten und können tödlich sein. Die hämatogene und lymphatische Ausbreitung führt zu einer Beteiligung der Lunge und des zentralen Nervensystems.55,57
Diagnose
Die Identifizierung septierter hyaliner Hyphen durch mikroskopische Untersuchung von Hautschuppen, Nagelfragmenten, Sekreten oder Fragmenten liefert eine Verdachtsdiagnose, die dann durch Kultur bestätigt wird (Abb. 5). Die meisten Pilze wachsen auf SDA ohne Antibiotika oder Inhibitoren.47,59 Wie in den oben beschriebenen Fällen ist auch eine molekulare Identifizierung möglich.60
Die Differentialdiagnose sollte andere Dermatomykosen, epidermale Zysten, Aktinomyzetom, Eumyzetom, Histoplasmose und Kryptokokkose einschließen.
Behandlung
Bei immunkompetenten Personen sind die Behandlungen der Wahl Triazole, Terbinafin oder eine Operation.61 Wenn das Immunsystem geschwächt ist, ist die Behandlung der ersten Wahl Amphotericin B in Kombination mit einem Triazol (Itraconazol 200 mg/d für 6 Monate oder Fluconazol 150 mg zweimal wöchentlich für 6 Monate).
Lakaziose (Lobomykose)
Die früher als Lobomykose bezeichnete Akaziose ist eine chronische granulomatöse Pilzinfektion der Haut und des subkutanen Gewebes, die erstmals 1930 von Jorge Lobo in Recife, Brasilien, unter dem Namen keloidale Blastomykose beschrieben wurde.62 Es handelt sich um eine seltene, in Mittel- und Südamerika vorkommende Infektion, die durch Lacazia loboi62,63 verursacht wird, einem Hefepilz, der in Kulturen nicht gezüchtet werden kann. Man nimmt an, dass die Infektionsquelle im Boden und in der Vegetation zu finden ist. Der Pilz dringt wahrscheinlich durch die Haut nach einer penetrierenden Verletzung ein, z. B. durch einen Dornenstich oder einen Insektenstich.
Lakaziose ist durch keloidale Läsionen mit gut definierten lobulären Rändern in exponierten Körperbereichen (häufig im Gesicht, an Armen oder Beinen) gekennzeichnet. Die Läsionen breiten sich auf benachbarte Stellen aus, obwohl eine Übertragung auf entfernte Stellen auch durch Autoinokulation möglich ist.
Diagnose
Die Diagnose wird durch die Identifizierung von reichlich vorhandenen Pilzstrukturen bei der direkten Untersuchung und Ketten von diffusen runden Zellen, die durch kleine röhrenförmige Strukturen verbunden sind, in Biopsieproben erleichtert.62 Die Erreger können im Gewebe auch durch PCR-Analysen identifiziert werden, insbesondere durch Tests, die auf das 18S rDNA-Fragment abzielen.64
Die Differentialdiagnose sollte Keloide, lepromatöse Lepra und anergische Leishmanien einschließen.
Behandlung
Antimykotika sind bei Lakaziose nicht wirksam, und die endgültige Behandlung ist die chirurgische Resektion.62,63
Zygomykose
Die Zygomykose ist eine heterogene Gruppe von Pilzinfektionen, die durch opportunistische Zygomyceten der Ordnungen Mucorales (Rhizopus, Lichtheimia, Mucor und Rhizomucor) und Entomophthorales (Basidiobolus und Conidiobolus) verursacht werden.65 In diesem Abschnitt werden nur die Entomophthorales besprochen, da die Mucorales im zweiten Teil dieser Übersicht behandelt werden, der sich mit systemischen Mykosen befasst.
Die Entomophthoromykose ist durch das Auftreten einer harten, fortschreitenden Masse gekennzeichnet, die das subkutane Gewebe befällt. Es gibt 2 Varianten. Die erste wird durch Basidiobolus ranarum verursacht und tritt häufiger bei Kindern auf.66 Die Läsionen treten in der Regel im Schulter- und Beckengürtel auf und präsentieren sich als sich langsam ausbreitende holzige Zellulitis. Die zweite Variante wird durch Conidiobolus coronatus verursacht und betrifft Erwachsene. Die Primärinfektion beginnt in den unteren Nasenmuscheln und breitet sich dann auf die Mitte des Gesichts aus, was zu schmerzhaften, hämorrhagischen Schwellungen und schweren Verformungen von Nase, Lippen und Wangen führt.6568
Schlussfolgerung
Wir haben die wichtigsten Merkmale der subkutanen Mykosen und die wichtigsten verfügbaren Diagnose- und Behandlungsmethoden zusammengefasst (Tabelle 1).
Zusammenfassung der Merkmale der subkutanen Mykosen.
| Mykose | Hauptauslöser | Diagnose | Behandlung |
|---|---|---|---|
| Sporotrichose | Sporothrix schenckii | Kultivierung von aus Knötchen aspiriertem Eiter; Histologie; PCR | Gesättigte Kaliumjodidlösung für 3 Wochen; Itraconazol 200mg/d für 3-6 Monate; Kombinationen |
| Chromoblastomykose | Fonsecaea pedrosoi | Mikroskopische Untersuchung; Kultur; Histologie | Sehr schwierig. Itraconazol 200mg/d für 6 Monate; Terbinafin für 12 Monate; Amphotericin B; Kombinationen |
| Mycetoma | Filamentöse Aktinomyceten und filamentöse Pilze | Identifizierung von Mycetoma-Granulaten; Kultur; Histologie; PCR | Antibiotika für Aktinomyzetom; Antimykotika+Chirurgie für Eumyzetom |
| Phaeohyphomykose | Exophiala jeanselmei Alternaria spp. |
Mikroskopische Untersuchung und Kultur; Histologie; PCR | Umstritten. Chirurgie+Kombination von Antimykotika |
| Hyalohyphomykose | Opportunistische Aspergillus (fumigatus, niger, flavus), Fusarium spp., Paecilomyces, etc. | Mikroskopische Untersuchung und Kultur; PCR | Immunkompetente Patienten: Triazole; Terbinafin; Ciclopirox olamine; Chirurgie Immunsupprimierte Patienten: Amphotericin B kombiniert mit einem Triazol für 6 Monate |
| Lakaziose (Lobomykose) | Lacazia loboi | Mikroskopische Untersuchung; Histologie; PCR | Chirurgie |
| Entomophthoromykose | Conidiobolus coronatus Basidiobolus ranarum |
Direkte Untersuchung und Kultur | Chirurgie und systemische Antimykotika |
Abkürzungen: PCR, Polymerase-Kettenreaktion.
Interessenkonflikte
Die Autoren erklären, dass sie keine Interessenkonflikte haben.