Organisen kemian alkuaikoina alkeenit kutsuttiin ”tyydyttymättömiksi”, koska toisin kuin ”tyydyttyneiden” alkaanien, niiden havaittiin reagoivan herkästi aineiden, kuten halogeenien, halogeenivetyjen, hapettimien ja niin edelleen, kanssa. Siksi alkeenien ”kemiallista affiniteettia” pidettiin tyydyttämättömänä tai ”tyydyttymättömänä”. (Ks. myös jakso 1-1I.)
Yksi syy siihen, että alkeenit ja alkyynit reagoivat helpommin kuin alkaanit, on se, että moninkertaisen sidoksen hiilen ja hiilen väliset sidokset ovat yksittäin heikompia kuin tavalliset hiilen ja hiilen väliset yksinkertaiset sidokset. Tarkastellaan asiaan liittyviä sidosenergioita. Taulukon 4-3 mukaan hiili-hiili-sinkku-, kaksois- ja kolmoissidosten vahvuudet ovat vastaavasti \(83\), \(146\) ja \(200 \: \text{kcal}\). Näistä arvoista voidaan laskea, että hiili-hiili-kaksoissidoksen puoliskon pilkkominen vaatisi \(63 \: \text{kcal}\) ja hiili-hiili-kolmoissidoksen kolmanneksen pilkkominen vaatisi \(54 \: \text{kcal}\):

Tuloksena voidaan olettaa, että useiden sidoksien additioreaktiot ovat noin \(20 \) – \(30 \: \text{kcal}\) eksotermisempiä kuin vastaavat hiili-hiili yksisidosten pilkkoutumisreaktiot, kuten tässä on arvioitu bromin kanssa tapahtuvalle reaktiolle:
Tärkeä ero etaanin, eteenin ja etyynin reaktiolämpötiloissa bromin kanssa heijastuu etyynin (asetyleenin) käsittelyyn liittyvään erittäin tärkeään käytännön näkökohtaan, nimittäin sen termodynaamiseen stabiilisuuteen suhteessa kiinteään hiileen ja vetykaasuun. Toisin kuin etaani, sekä eteneenin että etyynin voidaan osoittaa sidosenergioiden perusteella olevan epästabiileja kiinteän hiilen ja kaasumaisen vedyn muodostumisen suhteen:
Vaikka tämä ei näytä aiheuttavan erityisiä ongelmia eteneenin kohdalla, etyynin räjähdysmäinen hajoaminen hiileksi ja vedyksi voi tapahtua, jos kaasu puristetaan kokoon \(10 \)- \(20 \: \tekstiä \(kg cm) ^{-2}\). Jopa nestemäistä etyniä (bp \sim 83^\text{o}\)) on käsiteltävä varoen. Etyyniä ei käytetä kaupallisesti paineen alaisena, ellei sitä sekoiteta inerttiin kaasuun ja käsitellä kestävissä laitteissa. Etyyni palaa puhtaan hapen kanssa muodostaen erittäin kuuman liekin, jota käytetään laajalti hitsauksessa. Tätä tarkoitusta varten kaasu liuotetaan noin \(15 \: \text{kg cm}^{-2}\) alla 2-propanoniin (asetoni, 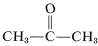 , bp \(56.5^\text{o}\)) ja säilytetään sylintereissä, jotka on pakattu diatomaattimullalla.
, bp \(56.5^\text{o}\)) ja säilytetään sylintereissä, jotka on pakattu diatomaattimullalla.
Miksi etyni on niin paljon vähemmän stabiili kuin eteni tai etaani? Ensinnäkin \(\ce{C-C}\) sidokset eivät ole yhtä vahvoja kuin \(\ce{C-H}\) sidokset. Siksi on yleensä odotettavissa, että stabiilisuus paranee, kun \(\ce{C-H}\)-sidoksia muodostetaan \(\ce{C-C}\)-sidosten kustannuksella; etenillä ja etaanilla on kummallakin enemmän \(\ce{C-H}\)-sidoksia kuin etyynillä. Toiseksi, etyynissä on kuusi elektronia kahden hiilen välissä, ja nämä elektronit kokevat huomattavaa keskinäistä elektronien välistä hylkimistä. Tämä selittää sen, että alkyynin kolmoissidoksen keskimääräinen \(\ce{C-C}\)-sidoksen vahvuus on \(200/3 = 67 \: \text{kcal}\), kun taas alkeenin kaksoissidoksen vahvuus on \(146/2 = 73 \: \text{kcal}\) ja alkaanin tavanomaisen yksinkertaisen sidoksen vahvuus on \(83 \: \text{kcal}\).
- John D. Robert ja Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, toinen painos. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Tämä sisältö on tekijänoikeudellisesti suojattu seuraavin ehdoin: ”Teille myönnetään lupa tämän teoksen yksilölliseen, opetukselliseen, tutkimukselliseen ja ei-kaupalliseen kopiointiin, levittämiseen, näyttämiseen ja esittämiseen missä tahansa muodossa.”