Haihtuminen
Veden lätäkkö, joka jätetään rauhaan, katoaa lopulta. Nestemäiset molekyylit karkaavat kaasufaasiin ja muuttuvat vesihöyryksi. Höyrystyminen on prosessi, jossa neste muuttuu kaasuksi. Haihtuminen on nesteen muuttumista höyryksi nesteen kiehumislämpötilan alapuolella. Jos vettä sen sijaan pidetään suljetussa astiassa, vesihöyrymolekyyleillä ei ole mahdollisuutta karata ympäristöön, joten vedenpinta ei muutu. Kun osa vesimolekyyleistä muuttuu höyryksi, yhtä monta vesihöyrymolekyyliä tiivistyy takaisin nestemäiseen tilaan. Kondensoituminen on olomuodon muutos kaasusta nesteeksi.
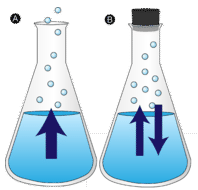
Nesteen molekyylin siirtyminen kaasutilaan edellyttää, että molekyylillä on riittävästi kineettistä energiaa voittaakseen nesteen molekyylien väliset vetovoimat. Muistutetaan, että tietyssä nestenäytteessä on molekyylejä, joiden liike-energiat vaihtelevat suuresti. Nestemäiset molekyylit, joilla on tämä tietty kineettinen kynnysenergia, pakenevat pinnalta ja muuttuvat höyryksi. Tämän seurauksena jäljelle jäävillä nestemolekyyleillä on nyt pienempi liike-energia. Kun haihtuminen tapahtuu, jäljelle jäävän nesteen lämpötila laskee. Olet havainnut haihtumisjäähdytyksen vaikutukset. Kuumana päivänä hikoilusi vesimolekyylit imevät kehon lämpöä ja haihtuvat ihon pinnalta. Haihtumisprosessi jättää jäljelle jäävän hien viileämmäksi, joka puolestaan imee lisää lämpöä kehostasi.
Joku neste haihtuu nopeammin, kun sitä lämmitetään. Tämä johtuu siitä, että kuumennusprosessin seurauksena suuremmalla osalla nesteen molekyyleistä on tarvittava liike-energia poistua nesteen pinnalta. Alla olevassa kuvassa on esitetty nestemolekyylien liike-energian jakautuminen kahdessa lämpötilassa. Niiden molekyylien lukumäärät, joilla on haihtumiseen tarvittava liike-energia, näkyvät oikealla olevan käyrän alla olevalla tummennetulla alueella. Korkeamman lämpötilan nesteessä \(\left( T_2 \right)\) on enemmän molekyylejä, jotka pystyvät karkaamaan höyryfaasiin kuin matalamman lämpötilan nesteessä \(\left( T_1 \right)\).

Kiinan ja Nepalin rajalla Himalajan vuoristossa sijaitseva Mount Everest on maapallon korkein kohta. 29 029 jalkaa \(\left( 8848 \: \text{m} \right)\). Sen korkeus aiheuttaa kiipeilijöille monia käytännön ongelmia. Ilman happipitoisuus on paljon alhaisempi kuin merenpinnan tasolla, joten happisäiliöt on otettava mukaan (tosin muutama kiipeilijä on päässyt huipulle ilman happea). Toinen ongelma on veden keittäminen ruoanvalmistusta varten. Vaikka vesi kiehuu merenpinnan tasolla \(100^\text{o} \text{C}\), Mount Everestin huipulla kiehumispiste on vain noin \(70^\text{o} \text{C}\). Tämä ero tekee kunnollisen teekupin saamisen hyvin vaikeaksi (mikä varmasti turhautti joitakin brittiläisiä kiipeilijöitä).