Todelliset ja ideaaliset kaasut
Ideaalinen kaasu on kaasu, joka noudattaa kaasulakeja kaikissa lämpötila- ja paineolosuhteissa. Tätä varten kaasun täytyisi noudattaa täysin kineettis-molekyyliteoriaa. Kaasuhiukkasten tilavuuden olisi oltava nolla, eikä niillä tarvitsisi olla minkäänlaisia vetovoimia toisiaan kohtaan. Koska kumpikaan näistä ehdoista ei voi pitää paikkansa, ideaalikaasua ei ole olemassa. Todellinen kaasu on kaasu, joka ei käyttäydy kineettis-molekyyliteorian oletusten mukaisesti. Onneksi laboratoriossa tavallisesti esiintyvissä lämpötila- ja paineolosuhteissa todelliset kaasut käyttäytyvät yleensä hyvin pitkälti ideaalikaasujen tavoin.
Missä olosuhteissa kaasut sitten käyttäytyvät vähiten ideaalisesti? Kun kaasu asetetaan korkeaan paineeseen, sen molekyylit pakotetaan lähemmäksi toisiaan, kun hiukkasten välinen tyhjä tila pienenee. Tyhjän tilan pieneneminen tarkoittaa, että oletus siitä, että itse hiukkasten tilavuus on mitätön, on vähemmän pätevä. Kun kaasua jäähdytetään, hiukkasten liike-energian väheneminen saa ne hidastumaan. Jos hiukkaset liikkuvat hitaammin, niiden väliset vetovoimat korostuvat. Toinen tapa tarkastella asiaa on se, että kaasun jatkuva jäähdyttäminen muuttaa sen lopulta nesteeksi, eikä neste todellakaan ole enää ideaalikaasu (ks. nestemäinen typpi alla olevassa kuvassa). Yhteenvetona voidaan todeta, että todellinen kaasu poikkeaa eniten ideaalikaasusta alhaisissa lämpötiloissa ja korkeissa paineissa. Kaasut ovat ihanteellisimpia korkeissa lämpötiloissa ja matalissa paineissa.

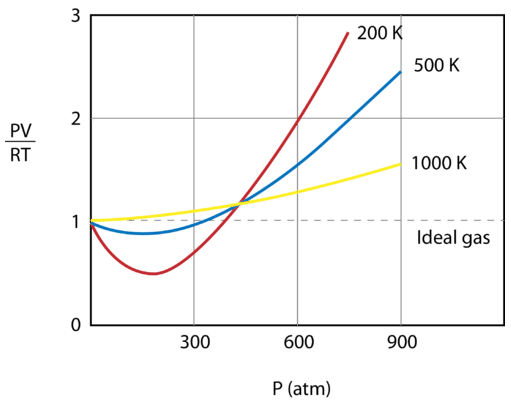
Alla olevassa kuvassa on esitetty \(\frac{PV}{RT}\) kuvaaja, joka on piirretty paineen funktiona \(1 \: \text{mol}\) kaasulle kolmessa eri lämpötilassa – \(200 \: \text{K}\), \(500 \: \text{K}\) ja 1000 \: \text{K}\). Ideaalikaasulla tämän suhteen arvo olisi 1 kaikissa lämpötiloissa ja paineissa, ja kuvaaja olisi yksinkertaisesti vaakasuora viiva. Kuten voidaan nähdä, poikkeamia ideaalikaasusta esiintyy. Kun paine alkaa nousta, vetovoimat aiheuttavat sen, että kaasun tilavuus on odotettua pienempi ja \(\frac{PV}{RT}\) arvo laskee alle 1:n. Jatkuva paineen nousu johtaa siihen, että hiukkasten tilavuus kasvaa merkittäväksi ja \(\frac{PV}{RT}\) arvo nousee suuremmaksi kuin 1. Huomaa, että poikkeamien suuruus ideaalisuudesta on suurinta kaasulla, jonka lämpötila on \(200 \: \text{K}\) ja pienintä kaasulla, jonka lämpötila on \(1000 \: \text{K}\).
Kaasun ideaalisuus riippuu myös hiukkasten välillä vallitsevien molekyylien välisten vetovoimien voimakkuudesta ja tyypistä. Kaasut, joiden vetovoimat ovat heikkoja, ovat ideaalisempia kuin kaasut, joiden vetovoimat ovat voimakkaita. Samassa lämpötilassa ja paineessa neon on ideaalisempi kuin vesihöyry, koska neonin atomeja vetävät puoleensa vain heikot dispersiovoimat, kun taas vesihöyryn molekyylejä vetävät puoleensa suhteellisen voimakkaammat vetysidokset. Helium on ideaalisempi kaasu kuin neon, koska sen pienemmän elektronimäärän vuoksi heliumin dispersiovoimat ovat vielä heikommat kuin neonin.