Sidoksen lujuus: Kovalenttiset sidokset
Vakaita molekyylejä on olemassa, koska kovalenttiset sidokset pitävät atomit yhdessä. Mittaamme kovalenttisen sidoksen lujuutta sen katkaisemiseen tarvittavalla energialla eli sillä energialla, joka tarvitaan sidoksissa olevien atomien erottamiseen toisistaan. Minkä tahansa sitoutuneen atomiparin erottaminen vaatii energiaa; mitä vahvempi sidos on, sitä suurempi on sen katkaisemiseen tarvittava energia. Energiaa, joka tarvitaan tietyn kovalenttisen sidoksen katkaisemiseen yhdessä moolissa kaasumolekyylejä, kutsutaan sidosenergiaksi tai sidoksen dissosiaatioenergiaksi. Kaksiatomisen molekyylin sidosenergia, \(D_X-Y}\), määritellään endotermisen reaktion vakioentalpiamuutoksena:
\
Esimerkiksi puhtaan kovalenttisen H-H-sidoksen sidosenergia, \(\Delta_{H-H}\), on 436 kJ moolia kohti katkaistua H-H-sidosta kohti:
\
Sidoksen katkaiseminen vaatii aina energian lisäämistä molekyyliin. Vastaavasti sidoksen muodostaminen vapauttaa aina energiaa.
Molekyyleissä, joissa on kolme tai useampia atomeja, on kaksi tai useampia sidoksia. Tällaisen molekyylin kaikkien sidosenergioiden summa on yhtä suuri kuin molekyylin kaikki sidokset katkaisevan endotermisen reaktion vakioentalpiamuutos. Esimerkiksi CH4:n neljän C-H-sidoksen energioiden summa, 1660 kJ, on yhtä suuri kuin reaktion vakioentalpiamuutos:
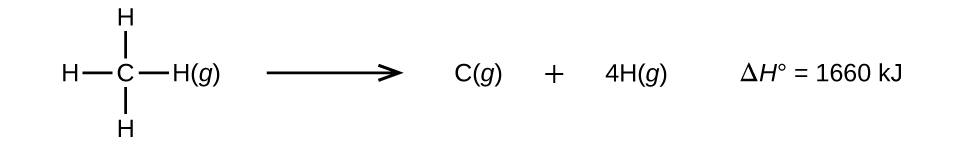
Keskimääräinen C-H-sidoksen energia, \(D_{C-H}\), on 1660/4 = 415 kJ/mol, koska reaktiomoolia kohti katkeaa neljä moolia C-H-sidoksia. Vaikka neljä C-H-sidosta ovat ekvivalentteja alkuperäisessä molekyylissä, ne eivät kaikki vaadi samaa energiaa katkeamiseen; kun ensimmäinen sidos on katkaistu (mikä vaatii 439 kJ/mol), loput sidokset ovat helpompia katkaista. Arvo 415 kJ/mol on keskiarvo, ei tarkka arvo, joka vaaditaan minkään yksittäisen sidoksen katkaisemiseen.
Kahden atomin välisen sidoksen lujuus kasvaa, kun sidoksessa olevien elektroniparien määrä kasvaa. Yleensä sidoksen lujuuden kasvaessa sidoksen pituus pienenee. Näin ollen havaitaan, että kolmoissidokset ovat vahvempia ja lyhyempiä kuin kahden saman kahden atomin väliset kaksoissidokset; samoin kaksoissidokset ovat vahvempia ja lyhyempiä kuin kahden saman atomin väliset yksinkertaiset sidokset. Joidenkin yleisten sidosten keskimääräiset sidosenergiat on esitetty taulukossa \(\PageIndex{2}\), ja joidenkin yleisten sidosten sidospituuksien ja -vahvuuksien vertailu on esitetty taulukossa \(\PageIndex{2}\). Kun yksi atomi sitoutuu ryhmän eri atomeihin, sidoksen vahvuus tyypillisesti pienenee, kun siirrytään ryhmässä alaspäin. Esimerkiksi C-F on 439 kJ/mol, C-Cl on 330 kJ/mol ja C-Br on 275 kJ/mol.
| Sidos | Sidosenergia | Sidos | Sidos | Sidosenergia |
| Liitos |
Liitos |
Liitos |
. |
|
|---|---|---|---|---|---|---|---|---|---|
| H-H | 436 | C-S | 260 | F-Cl | 255 | ||||
| H-C | 415 | C-Cl | 330 | F-Br | 235 | ||||
| H-N | 390 | C-Br | 275 | Si-Si | 230 | ||||
| H-O | 464 | C-I | 240 | Si-P | 215 | ||||
| H-F | 569 | N-N | 160 | Si-S | 225 | ||||
| H-Si | 395 | \(\mathrm{N=N}\) | 418 | Si-Si | 359 | ||||
| H-P | 320 | \(\mathrm{N≡N}\) | 946 | Si-Br | 290 | ||||
| H-P | 320 | 340 | N-O | 200 | Si-I | 215 | |||
| H-Cl | 432 | N-F | 270 | P-P | 215 | ||||
| H-Br | 370 | N-P | 210 | P-S | 230 | ||||
| H-I | 295 | N-Cl | 200 | P-Cl | 330 | ||||
| C-C | 345 | N-Br | 245 | P-Br | 270 | ||||
| \(\mathrm{C=C}\) | 611 | O-O | 140 | P-I | 215 | ||||
| \(\mathrm{C≡C}\) | 837 | \(\mathrm{O=O}\) | 498 | S-S | 215 | ||||
| C-N | 290 | O-F | 160 | S-Cl | 250 | ||||
| \(\mathrm{C=N}\) | 615 | O-Si | 370 | S-Br | 215 | ||||
| \(\mathrm{C≡N}\) | 891 | O-P | 350 | Cl-Cl | 243 | ||||
| C-O | 350 | O-Cl | 205 | Cl-Br | 220 | ||||
| \(\mathrm{C=O}\) | 741 | O-I | 200 | Cl-I | 210 | ||||
| \(\mathrm{C≡O}\) | 1080 | F-F | 160 | Br-Br | 190 | ||||
| C-F | 439 | F-Si | 540 | Br-I | 180 | ||||
| C-Si | 360 | F-P | 489 | I-I | 150 | ||||
| C-P | 265 | F-S | 285 |
| Sidos | Sidospituus (Å) | Sidosenergia (kJ/mol) |
|---|---|---|
| C-C | 1.54 | 345 |
| \(\mathrm{C=C}\) | 1.34 | 611 |
| \(\mathrm{C≡C}\) | 1.20 | 837 |
| C-N | 1.43 | 290 |
| \(\mathrm{C=N}\) | 1.38 | 615 |
| \(\mathrm{C≡N}\) | 1.16 | 891 |
| C-O | 1.43 | 350 |
| \(\mathrm{C=O}\) | 1.23 | 741 |
| \(\mathrm{C≡O}\) | 1.13 | 1080 |
Voimme käyttää sidosenergioita likimääräisten entalpianmuutosten laskemiseen reaktioille, joissa muodostumisen entalpiat eivät ole käytettävissä. Tämäntyyppiset laskelmat kertovat myös, onko reaktio eksoterminen vai endoterminen.
- Eksoterminen reaktio (ΔH negatiivinen, tuotettu lämpö) syntyy, kun tuotteiden sidokset ovat vahvempia kuin reaktanttien sidokset.
- Endoterminen reaktio (ΔH positiivinen, absorboitu lämpö) syntyy, kun tuotteiden sidokset ovat heikompia kuin reaktanttien.
Kemiallisen reaktion entalpiamuutos, ΔH, on suunnilleen yhtä suuri kuin reaktanttien kaikkien sidosten katkaisemiseen tarvittavan energian (energia ”sisään”, positiivinen merkki) ja tuotteiden kaikkien sidosten muodostuessa vapautuvan energian (energia ”ulos”, negatiivinen merkki) summa. Tämä voidaan ilmaista matemaattisesti seuraavalla tavalla:
\
Tässä lausekkeessa symboli \(\Sigma\) tarkoittaa ”summa” ja D edustaa sidosenergiaa kilojouleina moolia kohti, joka on aina positiivinen luku. Sidosenergia saadaan taulukosta, ja se riippuu siitä, onko kyseinen sidos yksi-, kaksois- vai kolmoissidos. Näin ollen entalpioita tällä tavoin laskettaessa on tärkeää ottaa huomioon kaikkien reaktanttien ja tuotteiden sidokset. Koska D-arvot ovat tyypillisesti yhden sidostyypin keskiarvoja monissa eri molekyyleissä, tämä laskutoimitus antaa karkean arvion, ei tarkkaa arvoa, reaktioentalpiasta.
Tarkastellaan seuraavaa reaktiota:
tai
\
Kahden mooli HCl:n muodostamiseksi on katkaistava yksi mooli HH-H-sidoksia ja yksi mooli Cl-Cl-sidoksia. Näiden sidosten katkaisemiseen tarvittava energia on H-H-sidoksen (436 kJ/mol) ja Cl-Cl-sidoksen (243 kJ/mol) sidosenergioiden summa. Reaktion aikana muodostuu kaksi moolia H-Cl-sidoksia (sidosenergia = 432 kJ/mol), jolloin vapautuu 2 × 432 kJ eli 864 kJ. Koska tuotteiden sidokset ovat vahvempia kuin reaktanttien sidokset, reaktio vapauttaa enemmän energiaa kuin se kuluttaa:
\-2D_{H-Cl}}\\\
&=\mathrm{-2(432)=-185\:kJ}
\end {align*}\]
Tämä ylimääräinen energia vapautuu lämpönä, joten reaktio on eksoterminen. Taulukosta T2 saadaan HCl(g):n muodostumisen vakiomolaariselle entalpialle, \(ΔH^\circ_\ce f\), arvo -92,307 kJ/mol. Kaksinkertainen arvo on -184,6 kJ, mikä vastaa hyvin aiemmin saatua vastausta kahden moolin HCl:n muodostumiselle.
Esimerkki \(\PageIndex{1}\):
Metanoli, CH3OH, voi olla erinomainen vaihtoehtoinen polttoaine. Höyryn ja hiilen korkean lämpötilan reaktiossa syntyy hiilimonoksidin, CO, ja vedyn, H2, seos, josta voidaan valmistaa metanolia. Laske taulukon \(\PageIndex{2}\) sidosenergioiden avulla likimääräinen entalpian muutos, ΔH, seuraavassa esitetylle reaktiolle:
\
Liuos
Aluksi on kirjoitettava reaktanttien ja tuotteiden Lewis-rakenteet:
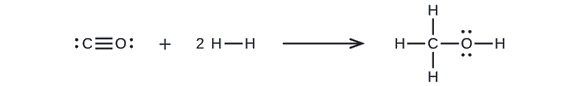
Tästä nähdään, että tämän reaktion ΔH sisältää energian, joka tarvitaan C-O-kolmisidoksen ja kahden H-H-yksisidoksen katkaisemiseen, sekä energian, joka syntyy kolmen C-H-yksisidoksen, C-O-yksisidoksen ja O-H-yksisidoksen muodostumisesta. Voimme ilmaista tämän seuraavasti (yhtälön \ref{EQ3} kautta):
\-}
\end {align*}\]
Taulukon \(\PageIndex{2}\) sidosenergia-arvoja käyttäen saadaan:
&=\ce{-107\:kJ}
\end {align*}\]
Voidaan verrata tätä arvoa arvoon, joka on laskettu liitteen G \(ΔH^\circ_\ce f\) tietojen perusteella:
&=-\\\
&=\mathrm{-90.5\:kJ}
\end {align*}\]
Huomaa, että kahdella eri menetelmällä laskettujen arvojen välillä on melko merkittävä ero. Tämä johtuu siitä, että D-arvot ovat eri sidoslujuuksien keskiarvoja; siksi ne antavat usein vain karkean yhdenmukaisuuden muiden tietojen kanssa.
Harjoitus \(\PageIndex{1}\)
Etyylialkoholi, CH3CH2OH, oli yksi ensimmäisistä orgaanisista kemiallisista aineista, joita ihminen syntetisoi tietoisesti. Sillä on monia käyttötarkoituksia teollisuudessa, ja se on alkoholijuomien sisältämä alkoholi. Sitä voidaan saada fermentoimalla sokeria tai syntetisoida etyleenin hydratoimalla seuraavassa reaktiossa:

Laskekaa taulukon \(\PageIndex{2}\) sidosenergioiden avulla likimääräinen entalpiamuutos ΔH tälle reaktiolle.
Yhteenveto
Video \(\PageIndex{2}\):
Kovalenttiset sidokset muodostuvat, kun atomien välillä jaetaan elektroneja, jotka vetävät puoleensa molempien atomien ytimiä. Puhtaissa kovalenttisissa sidoksissa elektronit jaetaan tasan. Polaarisissa kovalenttisissa sidoksissa elektronit jaetaan epätasaisesti, koska toinen atomi harjoittaa voimakkaampaa vetovoimaa elektroneihin kuin toinen.
Kovalenttisen sidoksen lujuutta mitataan sidoksen dissosiaatioenergialla eli sillä energiamäärällä, joka tarvitaan kyseisen sidoksen katkaisemiseen moolin molekyylissä. Moninkertaiset sidokset ovat vahvempia kuin yksittäiset sidokset samojen atomien välillä. Reaktion entalpia voidaan arvioida sidosten katkeamiseen tarvittavan energian ja uusien sidosten muodostuessa vapautuvan energian perusteella.
Avainyhtälöt
- Diaatomisen molekyylin sidosenergia: \(\ce{XY}(g)⟶\ce{X}(g)+\ce{Y}(g)\hspace{20px}\ce{D_{X–Y}}=ΔH°\)
- Enthalpy change: ΔH = ƩDbonds broken – ƩDbonds formed
Footnotes
- Tämä kysymys on peräisin Chemistry Advanced Placement Examination -tehtävästä ja sitä on käytetty Educational Testing Servicen luvalla.
Sanasto
sidosenergia (myös sidoksen dissosiaatioenergia) energia, joka tarvitaan kovalenttisen sidoksen katkaisemiseen kaasumaisessa aineessa
Tekijät
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) ja Richard Langley (Stephen F. Austinin osavaltionyliopisto), joiden kirjoittajat ovat mukana. OpenStax Collegen tuottama oppikirjan sisältö on lisensoitu Creative Commons Attribution License 4.0 -lisenssillä. Lataa ilmaiseksi osoitteesta http://cnx.org/contents/85abf193-2bd…[email protected]).
- Adelaide Clark, Oregon Institute of Technology
- Fuse School, Avoin opetusresurssi ilmaiseksi Creative Commons -lisenssillä: Attribution-NonCommercial CC BY-NC (View License Deed: https://creativecommons.org/licenses/by-nc/4.0/)
- Crash Course Chemistry: Crash Course is a division of Complexly and videos are free to stream for educational purposes.
Feedback
Have feedback to give feedback about this text? Klikkaa tästä.
Löysitkö kirjoitusvirheen ja haluat lisäpisteitä? Klikkaa tästä.