Bentseenin Kekulé-rakenne
Bentseenin molekyylikaava C6H6 tunnettiin, mutta sen rakennekaavaa ei tunnettu.
Jos bentseeni olisi suoraketjuinen tyydyttymätön hiilivety, sen pitäisi helposti käydä läpi additioreaktioita (kuten muidenkin alkeenien ja alkyynien).
Esimerkiksi bromin, Br2, pitäisi additiota kaksois- tai kolmoissidoksen poikki alla esitetyllä tavalla:
| mahdollinen suoraketjuisen rakenteen additioreaktio: | ||||
| CH3-C≡C-C≡C-CH3 | + Br2 | → | CH3-CBr=CBr-C≡C-CH3 | |
Mutta, kun bromia lisätään bentseeniin 25 °C:ssa ja 1 atm:ssa (101.3 kPa) paineessa, reaktiota ei näytä tapahtuvan.
Siten bentseenin mahdolliset rakenteet, joihin liittyy ketjuun järjestettyjä kaksois- ja/tai kolmoissidoksia, näyttivät epätodennäköisimmiltä, koska näissä pitäisi tapahtua additioreaktioita.
Jos bentseeniin lisätään bromia FeBr3:n läsnäollessa, se käy läpi substituutioreaktion, jossa yksi vetyatomi korvataan bromiatomilla, jolloin syntyy yhdiste, jonka kaava on C6H5Br, kuten alla on esitetty:
| tunnettu substituutioreaktio: | ||||||||
| C6H6 | + Br2 | FeBr3 → |
C6H5Br | + HBr | ||||
Tässä suhteessa, bentseeni käyttäytyi paljon enemmän kuin tyydyttynyt hiilivety (vain yksittäisiä sidoksia hiiliatomien välillä).
Kekulén vuonna 1865 ehdottama ensimmäinen rakenne bentseenille ei siis sisältänyt yhtään kaksoissidosta, mutta 6 hiiliatomia oli järjestetty renkaaksi alla esitetyllä tavalla:
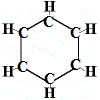
Kekulé oivalsi, että tämä molekyyli rikkoo hiilen tetravalenssisääntöä, eli kukin hiiliatomi muodostaa vain 3 sidosta neljän sijaan.
Kekulé ehdotti siis vuonna 1872 bentseenirakennetta, joka koostuu kolmesta vuorotellen vaihtuvasta yksinkertaisesta ja kaksinkertaisesta sidoksesta alla olevan kuvan mukaisesti:

Huomaa, että vaikka hiiliatomeja ei ole kirjoitettu rakenteen sisälle, ymmärretään aina, että cabon-atomi on olemassa siinä kohdassa, jossa kaksi kuusikulmion viivaa yhtyy, joten ”yhtymäkohtia”, eli kulmia, joita on 6, on 6 ja siten myös 6 hiiliatomia.
Tässä rakenteessa jokainen hiiliatomi on sitoutunut vetyatomiin ja kahteen muuhun hiiliatomiin. Yksi hiili-hiilisidoksista on yksinkertainen sidos, toinen hiili-hiilisidos on kaksoissidos. Jokainen hiiliatomi on tehnyt 4 sidosta.
Vaikka tämä rakenne ei selitä, miksi bentseeni ei käy läpi additioreaktioita, se voisi selittää, miksi bentseeni muodostaa vain yhden rakenneisomeerin, kun bentseeni reagoi bromin kanssa substituutioreaktiossa, kuten alla on esitetty:
 ehdotettu bentseenirakenne |
+ Br2 | → |  vain 1 rakenteellinen isomeeri |
. | + HBr |
Muut bentseenille ehdotetut rengasrakenteet olisivat ennustaneet substituutioreaktion tuotteelle useamman kuin yhden rakenneisomeerin, kuten alla on esitetty:
| muut ehdotetut rengasrakenteet reaktiossa: |  |
Br2 → |
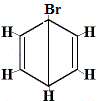 rakenneisomeeri 1 |
+ | 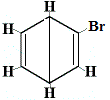 rakenneisomeeri 2 |
Mitä tapahtuisi, jos toinen vetyatomi korvattaisiin (substituoitaisiin) bromiatomilla?
| C6H5Br | + Br2 | FeBr3 → |
C6H4Br2 | + HBr |
Kuinka monta rakenneisomeeria C6H4Br2:sta syntyisi?
 |
Br2 → FeBr3 |
 rakenneisomeeri 1 |
+ | 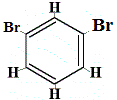 rakenneisomeeri 2 |
+ | . 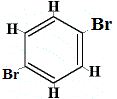 rakenneisomeeri 3 |
+ |  rakenneisomeeri 4 |
Rakenneisomeerit 1 ja 4 eroavat toisistaan, koska isomeeri 1:ssä kaksi Br-atomia on sitoutunut hiiliatomiin C-C-sidokseen, kun taas isomeerissa 4 kaksi Br-atomia on sitoutunut hiiliatomeihin C=C-sidoksella.
Mutta kun bentseenistä valmistettu C6H5Br reagoi bromin kanssa substituutioreaktiossa, syntyy vain 3 rakenneisomeeria C6H4Br2!
Tämän ongelman ratkaisemiseksi Kekulé ehdotti, että bentseenirengas on nopeassa tasapainossa sellaisten rakenteiden välillä, joissa kaksoissidokset ovat vaihtoehtoisissa asennoissa, kuten alla on esitetty:
 |
⇋ | 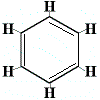 |
Kun siis bromi reagoi C6H5Br:n kanssa substituutioreaktiossa muodostaen C6H4Br2:n, C6H4Br2:n rakenneisomeeriparit ovat tasapainossa keskenään.
Tämä tarkoittaa, että edellä esitetyt rakenneisomeerit 1 ja 4, jotka eroavat toisistaan vain siten, että Br-atomit ovat sitoutuneet yksinkertaisen sidoksen tai kaksoissidoksen yli, ovat nyt nopeassa tasapainossa keskenään, kuten alla on esitetty:
| Br-atomit vierekkäisten C-atomien päällä, rakenneisomeeri 1:llä on Br-atomit C-C:n poikki rakenneisomeeri 4:llä on Br-atomit C=C:n poikki |
 rakenneisomeeri 1:llä |
⇋ |  rakenneisomeeri 4:llä |
Mukaan lukien Kekulé, nämä kaksi C6H4Br2:n rakenneisomeeria ovat niin nopeassa tasapainossa, että niitä ei voida erottaa toisistaan kahtena erillisenä molekyylinä, joten näyttää siltä, että isomeerejä on vain 3 eikä 4.
Vaikka tämä bentseenin nopean tasapainon rakenne, joka tunnetaan nimellä Kekulé-rakenne, osoittautui käyttökelpoiseksi, se ei selitä bentseenirenkaan ainutlaatuista stabiilisuutta (reaktiivisuuden puutetta), se ei selitä sitä, miksi bentseeni ei helposti käy läpi additioreaktioita, mutta se voidaan saada käymään läpi additioreaktioita.
Ymmärrätkö tämän?
Liity AUS-e-TUTEen!
Tee testi nyt!