Päätoimittaja: C. Michael Gibson, M.S., M.D. ; Associate Editor(s)-in-Chief: Aparna Vuppala, M.B.B.B.S.
Disclaimer
WikiDoc ei anna mitään takuuta pätevyydestä. WikiDoc ei ole ammattimainen terveydenhuollon tarjoaja, eikä se ole sopiva korvike laillistetulle terveydenhuollon tarjoajalle. WikiDoc on tarkoitettu koulutusvälineeksi, ei minkään terveydenhuollon tarjoamisen välineeksi. WikiDocin lääkesivujen opetussisältö perustuu FDA:n pakkausselosteeseen, National Library of Medicinen sisältöön ja käytännön ohjeisiin / konsensuslausuntoihin. WikiDoc ei suosittele minkään sellaisen lääkkeen tai laitteen antamista, joka ei ole merkintöjen mukainen. Lue koko vastuuvapauslausekkeemme täältä.
Yleiskatsaus
Butalbitaali on yhdistelmä, joka on FDA:n hyväksymä yhdistelmä jännityspäänsäryn (tai lihassupistuspäänsäryn) oireyhtymän lievittämiseen. Yleisiä haittavaikutuksia ovat huimaus ja ruoansulatuskanavan häiriöt, kuten pahoinvointi, oksentelu ja ilmavaivat, toksinen epidermaalinen nekrolyysi ja erythema multiforme.
Aikuisten käyttöaiheet ja annostus
FDA-merkityt käyttöaiheet ja annostus (aikuiset)
Päänsärky
- Butalbitaali-, aspiriini- ja kofeiinitabletit on tarkoitettu jännityspäänsäryn (tai lihassupistuspäänsäryn) oireyhtymän lievittämiseen.
- Butalbitaalin, aspiriinin ja kofeiinin tehoa ja turvallisuutta tukevaa näyttöä useiden toistuvien päänsärkyjen hoidossa ei ole saatavilla. Varovaisuus on tältä osin tarpeen, koska butalbitaali muodostaa tottumuksia ja on mahdollisesti väärinkäytettävissä.
Off-Label-käyttö ja annostelu (aikuiset)
Ohjeistettu käyttö
Ohjeistettu käyttö
Ohjeistetun käytön ulkopuolisesta käytöstä butalbitaalilla aikuispotilailla on vain vähän tietoa.
Muu kuin ohjeistolla tuettu käyttö
Aikuispotilailla on vain vähän tietoa Butalbitalin muusta kuin ohjeistolla tuetusta käytöstä.
Pediatriset käyttöaiheet ja annostelu
FDA:n merkitsemät käyttöaiheet ja annostelu (pediatriset)
Butalbitalin FDA:n lääkemerkinnällä varustetusta käytöstä lapsipotilailla on vain vähän tietoa.
Muualla kuin myyntiluvassa oleva käyttö ja annostus (Pediatriset potilaat)
Lääketieteellisesti tuettu käyttö
Tietoa Butalbitalin muualla kuin myyntiluvassa olevasta, lääketieteellisesti tuetusta käytöstä lapsipotilailla on vain vähän.
Ei-ohjeistettu käyttö
Butalbitalin ohjeistamattomasta, ei-ohjeistetusta käytöstä lapsipotilailla on rajoitetusti tietoa.
Vasta-aiheet
- Yliherkkyys aspiriinille, kofeiinille tai barbituraateille. Potilaat, joilla on porfyria.
Varoitukset
Lääkeriippuvuus:
- Barbituraattien pitkäaikainen käyttö voi aiheuttaa lääkeriippuvuutta, jolle on ominaista psyykkinen riippuvuus ja harvemmin fyysinen riippuvuus ja toleranssi. Butalbitaalin, aspiriinin ja kofeiinin väärinkäytettävyys on samanlainen kuin muiden barbituraatteja sisältävien lääkeyhdistelmien. Varovaisuutta on noudatettava määrättäessä lääkitystä potilaille, joilla on tunnettu taipumus ottaa liiallisia määriä lääkkeitä, mikä ei ole harvinaista kroonista jännityspäänsärkyä sairastavilla potilailla.
Käyttö ambulatorisesti hoidettavilla potilailla:
- Butalbitaali, aspiriini ja kofeiini voivat heikentää henkisiä ja/tai fyysisiä kykyjä, joita tarvitaan mahdollisesti vaarallisten tehtävien suorittamiseen, kuten auton ajamiseen tai koneiden käyttämiseen. Potilasta on varoitettava vastaavasti. Butalbitaalin keskushermostoa lamaavat vaikutukset voivat olla additiivisia muiden keskushermostoa lamaavien aineiden vaikutusten kanssa. Samanaikaista käyttöä muiden rauhoittavien-hypnoosilääkkeiden tai alkoholin kanssa on vältettävä. Jos tällainen yhdistelmähoito on tarpeen, yhden tai useamman aineen annosta voidaan joutua pienentämään.
Varotoimet
- Salisylaatteja on käytettävä erittäin varovaisesti mahahaavan tai hyytymishäiriöiden yhteydessä.
Haittavaikutukset
Kliinisistä tutkimuksista saatu kokemus
- Yleisimmät haittavaikutukset ovat uneliaisuus ja huimaus. Harvinaisempia haittavaikutuksia ovat huimaus ja ruoansulatuskanavan häiriöt, kuten pahoinvointi, oksentelu ja ilmavaivat. Butalbitaalin, aspiriinin ja kofeiinin käytön yhteydessä on raportoitu yksittäistä luuydinsuppressiota. Useita ihoreaktiotapauksia, mukaan lukien toksinen epidermaalinen nekrolyysi ja erythema multiforme, on raportoitu.
Kokemukset markkinoille tulon jälkeen
Lääkemerkinnöissä on rajoitetusti tietoa butalbitaalin markkinoille tulon jälkeisistä kokemuksista.
Lääkevalmisteen yhteisvaikutukset
Lääkkeen etiketissä on rajoitetusti tietoa Butalbitalin lääkevalmisteen yhteisvaikutuksista.
Käyttö erityisryhmissä
Raskaus
Raskausluokka (FDA): C
- Eläimillä ei ole tehty riittäviä tutkimuksia sen määrittämiseksi, vaikuttaako tämä lääke urosten tai naaraiden hedelmällisyyteen, onko sillä teratogeeninen potentiaali tai onko sillä muita haittavaikutuksia sikiöön. Vaikka raskaana olevilla naisilla ei ole hyvin kontrolloituja tutkimuksia, yli kahdenkymmenen vuoden markkinointi- ja kliininen kokemus ei sisällä positiivista näyttöä sikiöön kohdistuvista haittavaikutuksista. Vaikka selvästi määriteltyä riskiä ei olekaan, kokemuksen perusteella ei voida sulkea pois mahdollisuutta, että sikiölle voi aiheutua harvinaisia tai hienovaraisia vaurioita. Butalbitaalia, aspiriinia ja kofeiinia tulisi käyttää raskaana oleville naisille vain silloin, kun se on selvästi tarpeen.
Raskauskategoria (AUS): Australian lääkevalmistekomitean (ADEC) ohjeita Butalbitalin käytöstä raskaana oleville naisille ei ole.
Synnytys ja synnytys
Butalbitalin käytöstä synnytyksen ja synnytyksen aikana ei ole FDA:n ohjeistusta.
Imettävät äidit
- Butalbitalin, aspiriinin ja kofeiinin vaikutuksia imettävien äitien imeväisiin ei tunneta. Salisylaatit ja barbituraatit erittyvät imettävien äitien rintamaitoon. Seerumipitoisuuksien imeväisillä uskotaan olevan merkityksettömiä terapeuttisilla annoksilla.
Pediatrinen käyttö
- Turvallisuutta ja tehoa alle 12-vuotiailla lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
Ei ole olemassa FDA:n ohjeita Butalbitalin käytöstä vanhuspotilaiden osalta.
Sukupuoli
Ei ole olemassa FDA:n ohjeita Butalbitalin käytöstä tiettyjen sukupuoliryhmien osalta.
Rotu
Ei ole olemassa FDA:n ohjeita Butalbitalin käytöstä tiettyjen rotupopulaatioiden osalta.
Munuaisten vajaatoiminta
Ei ole olemassa FDA:n ohjeita Butalbitalin käytöstä potilaille, joilla on munuaisten vajaatoiminta.
Maksan vajaatoiminta
Ei ole olemassa FDA:n ohjeita Butalbitalin käytöstä potilaille, joilla on maksan vajaatoiminta.
Reproduktiokykyiset naiset ja miehet
Ei ole olemassa FDA:n ohjeita Butalbitalin käytöstä hedelmällisyyspotentiaalissa oleville naisille ja miehille.
Immunokompromisoituneet potilaat
Ei ole olemassa FDA:n ohjeistusta Butalbitalin käytöstä potilailla, joilla on immuunipuutos.
Antotapa ja seuranta
Antotapa
- Oraalinen
Monitorointi
Lääkemerkinnöissä on rajoitetusti tietoa Butalbitalin seurannasta.
Yhteensopivuus
Lääkemerkinnöissä on rajoitetusti tietoa butalbitaalin IV-yhteensopivuudesta.
Yliannostus
- Butalbitaalin, aspiriinin ja kofeiinin akuutin yliannostuksen myrkylliset vaikutukset johtuvat pääosin butalbitaalin barbituraattikomponentista ja vähäisemmässä määrin aspiriinista. Koska kofeiinin toksisia vaikutuksia esiintyy vain hyvin suurina annoksina, on epätodennäköistä, että butalbitaalin, aspiriinin ja kofeiinin yliannostus aiheuttaisi merkittävää kofeiinitoksisuutta. Akuuttiin barbituraattimyrkytykseen liittyviä oireita ovat uneliaisuus, sekavuus ja kooma, hengityslama, hypotensio ja sokki. Akuutista aspiriinimyrkytyksestä johtuvia oireita ovat hyperpnea, happo-emästasapainohäiriöt, joihin liittyy metabolinen asidoosi, oksentelu ja vatsakipu, tinnitus, hypertermia, hypoprothrombinemia, levottomuus, delirium, kouristukset. Akuutti kofeiinimyrkytys voi aiheuttaa unettomuutta, levottomuutta, vapinaa ja deliriumia; takykardiaa ja ekstrasystoleja. Hoito koostuu ensisijaisesti barbituraattimyrkytyksen hoidosta ja salisylimyrkytyksestä johtuvan happo-emästasapainon korjaamisesta. Oksentelu on saatava aikaan mekaanisesti tai oksentelua aiheuttavalla lääkkeellä tajuissaan olevalla potilaalla. Mahahuuhtelua voidaan käyttää, jos nielu- ja kurkunpäärefleksit ovat olemassa ja jos nauttimisesta on kulunut alle 4 tuntia. Ennen tajuttoman potilaan mahahuuhtelua ja tarvittaessa avustetun hengityksen aikaansaamiseksi on asetettava mansetilla varustettu endotrakeaaliputki. Diureesi, virtsan alkalisointi ja elektrolyyttihäiriöiden korjaaminen on toteutettava antamalla suonensisäisesti nesteitä, kuten 1 % natriumbikarbonaattia 5 %:n dekstroosipitoisessa vedessä. Riittävän keuhkotuuletuksen ylläpitämiseen on kiinnitettävä huolellista huomiota. Hypotension korjaaminen voi edellyttää levartherenolibitartraatin tai fenylefriinihydrokloridin antamista laskimonsisäisenä infuusiona. Vaikeissa myrkytystapauksissa peritoneaalidialyysi, hemodialyysi tai verensiirto voi olla hengenpelastavaa. Hypoprothrombinemiaa on hoidettava K-vitamiinilla, laskimonsisäisesti.
Lääkemerkinnöissä on rajoitetusti tietoa Butalbitalin kroonisesta yliannostuksesta.
Farmakologia
Lääkemerkinnöissä on rajoitetusti tietoa Butalbitalin farmakologiasta.
Toimintamekanismi
- Farmakologisesti butalbitaalissa, aspiriinissa ja kofeiinissa yhdistyvät aspiriinin analgeettiset ominaisuudet butalbitaalin anksiolyyttisiin ja lihasrelaksoiviin ominaisuuksiin.
Butalbitaalin, aspiriinin ja kofeiinin kliininen teho jännityspäänsärkyyn on todettu kaksoissokkoutetuissa, plasebokontrolloiduissa moniklinikkatutkimuksissa. Faktoriaalirakenteisessa tutkimuksessa verrattiin butalbitaalia, aspiriinia ja kofeiinia kunkin pääkomponentin kanssa. Tutkimus osoitti, että kukin komponentti vaikuttaa osaltaan butalbitaalin, aspiriinin ja kofeiinin tehoon jännityspäänsäryn kohdeoireiden (päänsärkykipu, psyykkinen jännittyneisyys ja lihassupistukset pään, niskan ja hartioiden alueella) hoidossa. Kunkin oireen ja koko oirekokonaisuuden osalta butalbitaalilla, aspiriinilla ja kofeiinilla osoitettiin olevan merkittävästi paremmat kliiniset vaikutukset kuin jommallakummalla komponentilla yksinään.
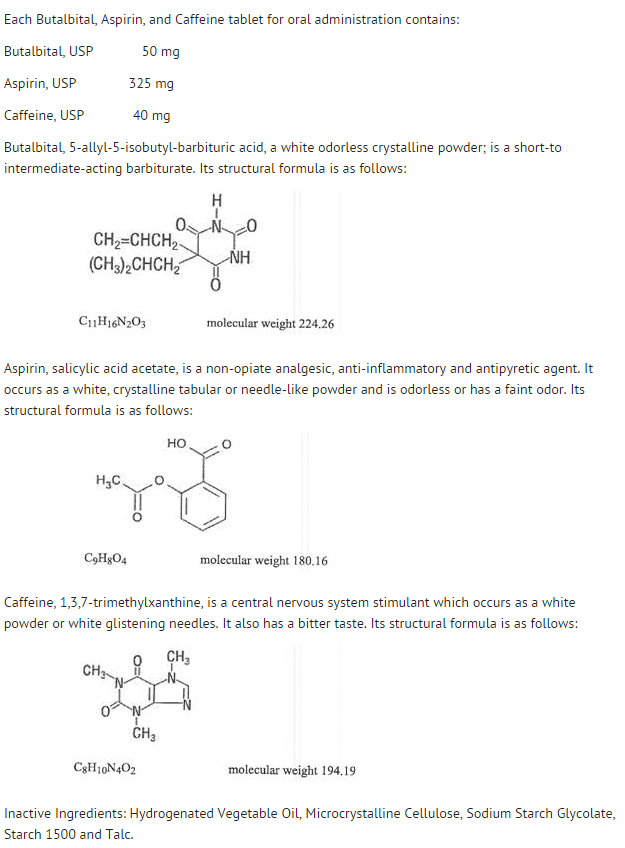
Rakenne
- Yksittäisten ainesosien käyttäytymistä kuvataan alla.
- Aspiriinin systeeminen saatavuus oraalisen annoksen jälkeen riippuu suuresti annostelumuodosta, ruoan läsnäolosta, mahalaukun tyhjenemisaikataulusta, mahalaukun pH-arvosta, antasideista, puskuriaineista ja hiukkaskoosta. Nämä tekijät eivät välttämättä vaikuta kokonaissalisylaattien imeytymisen laajuuteen vaan pikemminkin aspiriinin stabiilisuuteen ennen imeytymistä.
- Imeytymisprosessin aikana ja imeytymisen jälkeen aspiriini hydrolysoituu pääasiassa salisyylihapoksi ja jakautuu kaikkiin elimistön kudoksiin ja nesteisiin, mukaan lukien sikiön kudokset, rintamaito ja keskushermosto (CNS). Suurimmat pitoisuudet ovat plasmassa, maksassa, munuaiskuoressa, sydämessä ja keuhkoissa. Plasmassa noin 50-80 % salisyylihaposta ja sen metaboliiteista on löyhästi sitoutuneena plasman proteiineihin.
- Kokonaissalisylaattien puhdistuma on kyllästymiskinetiikan alainen; ensimmäisen kertaluvun eliminaatiokinetiikka on kuitenkin edelleen hyvä approksimaatio 650 mg:n annoksiin asti. Aspiriinin puoliintumisaika plasmassa on noin 12 minuuttia ja salisyylihapon ja/tai kokonaissalisylaattien noin 3,0 tuntia.
- Terapeuttisten annosten eliminaatio tapahtuu munuaisten kautta joko salisyylihappona tai muina biotransformaatiotuotteina. Munuaispuhdistumaa lisää huomattavasti emäksinen virtsa, jollainen syntyy annettaessa samanaikaisesti natriumbikarbonaattia tai kaliumsitraattia.
- Aspiriinin biotransformaatio tapahtuu pääasiassa hepatosyyteissä. Tärkeimmät metaboliitit ovat salisyyliuriinihappo (75 %), salisylaatin fenoli- ja asyyliglukuronidit (15 %) sekä gentisyyli- ja gentisuriinihappo (1 %). Aspiriinikomponentin butalbitaalin, aspiriinin ja kofeiinin biologinen hyötyosuus vastaa liuoksen hyötyosuutta lukuun ottamatta hitaampaa imeytymisnopeutta. Huippupitoisuus 8,80 mcg/ml saatiin 40 minuutin kuluttua 650 mg:n annoksesta.
- Butalbitaali imeytyy hyvin ruoansulatuskanavasta, ja sen odotetaan jakautuvan useimpiin elimistön kudoksiin. Barbituraatteja voi yleensä esiintyä äidinmaidossa ja ne läpäisevät helposti istukan esteen. Ne sitoutuvat vaihtelevassa määrin plasman ja kudosten proteiineihin, ja sitoutuminen lisääntyy suoraan lipidiliukoisuuden funktiona.
- Butalbitaalin poistuminen tapahtuu pääasiassa munuaisten kautta (59-88 % annoksesta) muuttumattomana lääkeaineena tai metaboliitteina. Plasman puoliintumisaika on noin 35 tuntia. Virtsaan erittyviin tuotteisiin kuuluivat kantalääke (noin 3,6 % annoksesta), 5-isobutyyli-5-(2,3-dihydroksipropyyli)barbituurihappo (noin 24 % annoksesta), 5-allyyli-5-(3-hydroksi-2-metyyli-1-propyyli)barbituurihappo (noin 4,8 % annoksesta), tuotteet, joiden barbituurihapporengas hydrolysoituu urean erittymisen myötä (noin 14 % annoksesta), sekä tunnistamattomat aineet. Virtsaan erittyneestä aineesta 32 % oli konjugoitunutta.
- Butalbitaalin, aspiriinin ja kofeiinin butalbitaalikomponentin biologinen hyötyosuus vastaa liuoksen biologista hyötyosuutta lukuun ottamatta imeytymisnopeuden pienenemistä. Huippupitoisuus 2020 ng/ml saavutetaan noin 1,5 tunnin kuluttua 100 mg:n annoksesta.
- Butalbitaalin in vitro-plasman proteiineihin sitoutuminen on 45 % pitoisuusalueella 0,5-20 mcg/ml. Tämä kuuluu muille barbituraateille, kuten fenobarbitaalille, pentobarbitaalille ja sekobarbitaalinatriumille, raportoitujen plasman proteiineihin sitoutumisen vaihteluväliin (20-45 %). Plasman ja veren pitoisuussuhde oli lähes yhtä suuri, mikä osoittaa, että butalbitaali ei jakaudu ensisijaisesti plasmaan eikä verisoluihin. (ks. toksisuustiedot kohdasta YLIANNOSTUS).
- Kuten useimmat ksantiinit, kofeiini imeytyy nopeasti ja jakautuu kaikkiin elimistön kudoksiin ja nesteisiin, mukaan lukien keskushermostoon, sikiön kudoksiin ja äidinmaitoon.
- Kofeiini poistuu nopeasti aineenvaihdunnan kautta ja erittyy virtsaan. Plasman puoliintumisaika on noin 3,0 tuntia. Hepaattinen biotransformaatio ennen erittymistä johtaa suunnilleen yhtä suuriin määriin 1-metyyli-ksantiinia ja 1-metyyliuriinihappoa. Virtsasta talteen saadusta 70 % annoksesta vain 3 % oli muuttumatonta lääkettä.
- Butalbitaalin, aspiriinin ja kofeiinin kofeiinikomponentin biologinen hyötyosuus vastaa liuoksen hyötyosuutta lukuun ottamatta hieman pidempää aikaa huipun saavuttamiseen. Huippupitoisuus 1660 ng/ml saavutettiin alle tunnissa 80 mg:n annoksella
- Butalbitaali-, aspiriini- ja kofeiinitabletit, USP 50 mg/325 mg/40 mg ovat valkoisia, pyöreitä, jakamattomia, pakattuja tabletteja, joissa on painatusmerkintä ”West-ward 785”.
- Varastoidaan 20-25oC (68-77oF) . Suojattava valolta ja kosteudelta.
- Annosteltava USP:n määritelmän mukaisessa tiiviissä, valonkestävässä pakkauksessa, jossa on lapsiturvallinen suljin.
- Alkoholin ja Butalbitalin yhteisvaikutusta ei ole todettu. Keskustele lääkärisi kanssa alkoholin käytön vaikutuksista tämän lääkkeen kanssa.
Farmakodynamiikka
Lääkkeen etiketissä on rajoitetusti tietoa Butalbitalin farmakodynamiikasta.
Farmakokinetiikka
Aspiriini:
Butalbitaali:
Kofeiini:
Ei-kliininen toksikologia
Lääkemerkinnöissä on rajoitetusti tietoa butalbitaalin ei-kliinisestä toksikologiasta.
Kliiniset tutkimukset
Lääkemerkinnöissä on rajoitetusti tietoa butalbitaalin kliinisistä tutkimuksista.
Valmistustapa
Pullot 30 tablettiaPullot 50 tablettiaPullot 100 tablettiaPullot 500 tablettiaPullot 500 tablettiaPullot 1000 tablettiaYksikköannosrasiat 100 tablettia
Varastointi
Lääkemerkinnöissä on rajoitetusti tietoa butalbitaalin säilytyksestä.
Kuvat
Lääkekuvat
Lääkkeen nimi: Butalbitaali, parasetamoli ja kofeiini
Ainesosa(t): Butalbitaali, parasetamoli ja kofeiini
Ainesosa(t): BUTALBITAALI, ASETAMINOPFEENI, KAFFEIINI
Imprint: West;ward;787
Ilmakuva: 50 mg
Väri(t): Sininen
Muoto: Pyöreä
Koko (mm): 11
Pistemäärä: 1
NDC:01431787
Lääkemerkinnän kirjoittaja: West-Ward Pharmaceutical Corp
Tämän pillerikuvan tarjoaa National Library of Medicine’s PillBox.

Lääkkeen nimi: Butalbitaali, aspiriini ja kofeiini
Ainesosa(t): BUTALBITAALI, ASPIRIINI, KAFFEIINI
Imprint: Westward;785
Ilmakuva: 50 mg
Väri(t): Valkoinen
Muoto: Pyöreä
Koko (mm): 11
Pistemäärä: 1
NDC:01431785
Lääkemerkinnän tekijä: West-ward Pharmaceutical Corp
Tämän pillerikuvan tarjoaa National Library of Medicine’s PillBox.

Lääkkeen nimi: Butalbitaali, aspiriini ja kofeiini
Ainesosa(t): BUTALBITAALI, ASPIRIINI, KAFFEIINI
Imprint: WATSON;3219
Dosage: 50 mg
Väri(t): Kapseli
Koko (mm): 22
Pistemäärä: 1
NDC:05913219
Lääkemerkinnän laatija: Watson Laboratories, Inc.
Tämän pillerikuvan on toimittanut National Library of Medicine’s PillBox.
Lääkkeen nimi: Butalbitaali-, aspiriini- ja kofeiinitabletit
Ainesosa(t): ASPIRIINI, BUTALBITAALI, KAFFEIINI
Imprint: West;ward;785
Ilmakuva: 50 mg
Väri(t): Valkoinen
Muoto: Pyöreä
Koko (mm): 7
Pistemäärä: 1
NDC:06032548
Lääkemerkinnän tekijä: Qualitest
Tämän pillerikuvan on toimittanut National Library of Medicine’s PillBox.
Pakkauksen ja etiketin näyttöpaneeli
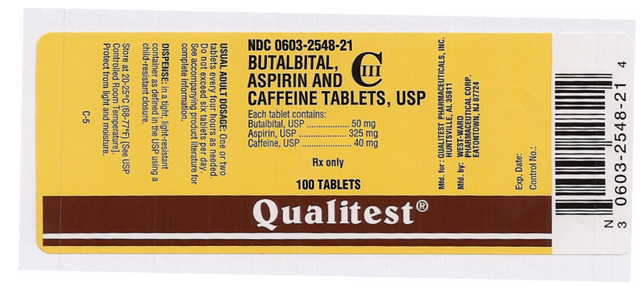
Tämän kuvan FDA:n pakkausmerkinnästä on toimittanut National Library of Medicine.

Tämän kuvan FDA:n etiketistä on toimittanut National Library of Medicine.
Potilaan neuvontaa koskevat tiedot
Lääkkeen etiketissä on rajoitetusti tietoa Butalbitalin potilaan neuvontaa koskevista tiedoista.
Varotoimet alkoholin kanssa
Merkkien nimet
Lääkevalmisteen etiketissä on rajoitetusti tietoa Butalbitalin tuotenimistä.
Look-Alike-lääkenimet
Lääkevalmisteen etiketissä on rajoitetusti tietoa Butalbitalin Look-Alike-lääkenimistä.