Introduction
Meningioomat ovat yleisin primaarinen keskushermoston (CNS) kasvain, ja niiden osuus kaikista primaarisista aivokasvaimista on yli 37 % (1). Meningeoomien hoitovaihtoehtoja ovat tarkkailu, leikkaus ja sädehoito (2, 3). Vaikka vähemmistö meningeoomista on aggressiivisia, mukaan lukien Maailman terveysjärjestön (WHO) asteet II ja III, yli 80 prosenttia on WHO:n asteen I kasvaimia, joita kutsutaan usein ”hyvänlaatuisiksi” (4). Jopa WHO-luokan I meningeoomat voivat kuitenkin uusiutua, ja aiemmissa tutkimuksissa on todettu, että pitkäaikaisseurannassa uusiutumisaste on jopa 47 prosenttia (4, 5). Meningeooman uusiutuminen edellyttää usein lisäkirurgista hoitoa tai pelastavaa sädehoitoa, mikä saattaa aiheuttaa sairastuvuutta (6, 7). Tämän vuoksi kyky ennustaa uusiutuminen on olennainen osa WHO-luokan I meningeooman hoitoa, jotta voidaan antaa suosituksia seurantakuvantamisen tiheydestä tai adjuvanttisen sädehoidon käytöstä.
Resektiossa saavutetun Simpson-luokan lisäksi useita kasvaimen ominaisuuksia on arvioitu mahdollisina uusiutumisen ennustajina, ja pääpaino on ollut histopatologisissa löydöksissä (8). Näihin kuuluvat MIB-1-indeksi (solujen proliferaation merkkiaine), aivoinvaasio ja epätyypillisten histologisten piirteiden esiintyminen, mukaan lukien lisääntynyt soluväli, levymäisyys, spontaanin nekroosin pesäkkeet ja ydinatypia (9-13). Vuoden 2016 WHO-luokituksissa käytetäänkin yksinomaan patologisia löydöksiä kasvaimen asteen määrittämiseksi, ja aste II määritellään aivoinvaasiolla ja lisääntyneellä mitoosilla yli 4/10 suurtehokentässä (HPF) (4). Lisäksi kolme epätyypillistä piirrettä johtaa yhdessä kasvaimen korkeampaan asteeseen (4). Tulevaisuutta ajatellen meningeooman molekulaariset ominaisuudet on äskettäin yhdistetty uusiutumisriskiin, ja niitä todennäköisesti käytetään tulevaisuudessa meningeooman luokittelussa (14-16).
Vaikka WHO:n luokitukset syntetisoivat käytettävissä olevan kirjallisuuden luodakseen selkeät rajaukset kasvainluokkien välille, WHO:n I-luokan meningeooman uusiutumiseen liittyvä kirjallisuus on edelleen sekalaista. Vaikka esimerkiksi pelkkä aivoinvaasio voi johtaa kasvaimen luokan nousuun WHO-luokista I-II, useissa myöhemmissä tutkimuksissa ei ole havaittu yhteyttä aivoinvaasion ja uusiutumisen välillä, mikä korostaa tarvetta lisätutkimuksiin uusiutumisen ennustetekijöistä (10, 17, 18). MIB-1-indeksin hyödyllisyys meningeooman uusiutumisen ennustamisessa on myös kiistanalainen; eräässä WHO-luokan I meningeoomia käsittelevässä tutkimuksessa viitattiin korkeampaan uusiutumisriskiin vain MIB-1-indeksin ollessa >3 %, mutta muussa kirjallisuudessa, johon on sisällytetty kaikki WHO-luokat, on todettu, että uusiutumisen ilmaantuvuus on korkeampi, jos indeksin arvo on >5 % tai >10 % (9-11). Aiemmissa tutkimuksissa on myös ehdotettu MIB-1:n raja-arvoksi >3 % vain potilailla, joilla on Simpson II tai III -resektio, mikä osoittaa edelleen MIB-1:n raja-arvojen ja niiden käytön moninaisuutta (13). Sen sijaan epätyypillisten piirteiden vaikutusta WHO-luokan I meningeooman uusiutumiseen on tutkittu vain harvoissa tutkimuksissa; tosin niissä on ehdotettu suurempaa uusiutumisriskiä WHO-luokan I kasvaimissa, joissa on epätyypillisiä piirteitä patologisessa analyysissä (9).
Tämän tutkimuksen tavoitteena oli siis tutkia WHO-luokan I meningeoomien uusiutumisen kliinisiä, radiografisia ja patologisia ennustetekijöitä. Koska MIB-1-indeksin käytöstä WHO-luokan I meningeoomissa ei ole yksimielisyyttä, hyödynnämme myös rekursiivista partitioanalyysia määrittääksemme kliinisesti merkityksellisen raja-arvon MIB-1-indeksille. Tämän jälkeen tunnistamme WHO:n I-luokan kasvainten varhaisen ja jälkikäteen tapahtuvan uusiutumisen ennustetekijät.
Menetelmät
Potilasjoukko
Potilaat, joille tehtiin WHO:n I-luokan meningeooman hoito vuosina 2007-2017, tunnistettiin retrospektiivisesti laitoksen tietokannan avulla. Tämä tutkimus hyväksyttiin virallisesti Kalifornian yliopiston San Franciscon institutionaalisessa tarkastuslautakunnassa (IRB#13-12587). Potilaat, joiden MIB-1-indeksiarvot eivät olleet saatavilla sähköisessä sairauskertomuksessa, jätettiin tutkimuksen ulkopuolelle. Tutkimusjakson alkupuolella MIB-1 saatiin hoitavan neuropatologin harkinnan mukaan, mutta ajan kuluessa MIB-1 saatiin kaikilta WHO-luokan I meningeoomapotilailta.
Kliiniset tiedot
Potilaiden demografiset, kliiniset ja hoito-ominaisuudet, histopatologiset tiedot ja kliiniset tulokset tarkasteltiin ja kerättiin takautuvasti. Kerätyt kliiniset tiedot sisälsivät potilaan iän, sukupuolen, Karnofskyn suorituskyvyn tilan (KPS) hoidon aikana, kliinisen esityksen ja aikaisemman meningeooman hoidon. Histopatologisiin tietoihin kuuluivat MIB-1-indeksi, arkkitehtuurin levittyminen/menettäminen, lisääntynyt soluväli, nekroosi, ydinatypia ja luustoinvaasion esiintyminen. Progesteronireseptorin (PR), epiteelikalvoantigeenin (EMA), CD34:n, S100:n, gliafibrillaarisen ja happaman proteiinin (GFAP) värjäystulokset kerättiin, jos ne olivat saatavilla. Patologiset tiedot poimittiin kirurgisen toimenpiteen yhteydessä laaditusta patologisesta raportista. Kasvaimen sijainti, koko ja preoperatiivisen peritumoraalisen turvotuksen esiintyminen määritettiin preoperatiivisen magneettikuvauksen avulla. Anterior-posterior (AP), superior-inferior (SI) ja transversaali (TV) halkaisijat kerättiin. Preoperatiivinen kasvaimen tilavuus laskettiin käyttämällä epäsfäärisen kasvaimen tilavuuden yhtälöä. Hoitotyyppi kerättiin samalla tavoin. Simpsonin aste määritettiin operatiivisen raportin perusteella. Bruttototaalinen (GTR) ja subtotaalinen resektio (STR) määritettiin leikkauksen jälkeisten magneettikuvausten (MRI) avulla.
Ensisijaiset kiinnostavat tulokset olivat kasvaimen uusiutuminen ja aika uusiutumiseen. Uusiutuminen määritettiin leikkauksen jälkeisessä radiografiassa paikallisena uusiutumisena tai jäännöskasvaimen etenemisenä. Aika uusiutumiseen määritettiin potilaan hoitopäivämäärästä. Seuranta-aika laskettiin hoitopäivästä viimeiseen käyntiin neurokirurgian klinikalla. Toissijaisiin tuloksiin kuuluivat varhaisvaiheen ja välivaiheen jälkeinen uusiutuminen. Varhainen uusiutuminen määriteltiin 2 vuoden kuluessa alkuperäisestä hoidosta (19). Keskihoidon jälkeinen uusiutuminen määriteltiin tapahtuneeksi >2 vuotta ensimmäisen hoidon jälkeen.
Statistinen analyysi
Chi-neliö- ja Studentin t-testiä käytettiin kategoristen ja jatkuvien muuttujien vertailuun. Monimuuttujainen taaksepäin suuntautuvan todennäköisyyden Cox-regressiomalli uusiutumista varten muodostettiin käyttäen muuttujia, joiden p < 0,200 yksimuuttuja-analyysissä. Vastaavasti monimuuttujaiset taaksepäin suuntautuvan todennäköisyyden binääriset logistiset mallit rakennettiin ennustamaan varhaista ja keskivaiheen jälkeistä uusiutumista käyttäen muuttujia, joiden p < 0,200 yksimuuttuja-analyysissä. Rekursiivista partitioanalyysia (RPA) käytettiin edelleen tunnistamaan yleisten, varhaisten ja keskivaiheen jälkeisten meningeooman uusiutumisen keskeisiä riskitekijöitä. Tilastollisen merkitsevyyden kynnysarvona käytettiin p < 0,050. Kaikki tilastolliset analyysit tehtiin SPSS 26 -ohjelmalla.
Tulokset
Potilaiden demografiset tiedot ja kliiniset tulokset
Potilaiden demografiset tiedot, histopatologiset piirteet ja kliiniset tulokset näkyvät taulukossa 1. Tutkimukseen otettiin mukaan yhteensä 239 potilasta, joilla oli WHO-luokan I meningeooma. Keski-ikä oli 60,0 vuotta, ja 69,5 % potilaista oli naisia. Yleisin oire oli päänsärky (30,5 %), jota seurasi fokaalinen neurologinen vajaatoiminta (27,6 %). Suurimmalle osalle potilaista tehtiin pelkkä leikkaus (98,3 %), ja kaksi potilasta sai kumpikin liitännäissädehoitoa (0,8 %) tai gammaveitsihoitoa (0,8 %). Leikkausta edeltävässä magneettikuvauksessa oli peritumoraalista turvotusta 38,1 prosentilla potilaista. Keskimääräinen laskettu kasvaimen tilavuus oli 30,6 cm3 (vaihteluväli = 0,23-215,73 cm3), ja kasvaimen suurin ulottuvuus oli keskimäärin 3,8 cm (vaihteluväli = 0,6-11,3 cm). Kaiken kaikkiaan 91 (38,1 %) kasvainta sijaitsi kallonpohjassa, 57 (23,8 %) oli kuperia kasvaimia, 43 (18,0 %) sijaitsi falxissa/parasagittaalisesti ja 55 (23,0 %) sijaitsi muualla. Useimmille potilaille tehtiin kokonaisresektio (63,6 %). Simpson I-, II-, III- ja IV-resektioiden esiintyvyys oli 31,4, 29,7, 2,5 ja 35,6 %. Epätyypillisiä piirteitä esiintyi useilla potilailla; yleisimmät epätyypilliset piirteet olivat luun invaasio (18,0 %) ja arkkitehtuurin peittyminen/menetys (8,4 %). Keskimääräinen seuranta-aika oli 41,1 kuukautta (vaihteluväli: 0-147 kuukautta).
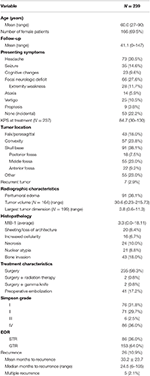
Taulukko 1. Potilaiden ominaisuudet, histopatologiset piirteet, röntgenkuvaus ja lopputulokset.
Predictors of WHO Grade I Meningioma Recurrence
Kokonaisuudessaan 26 potilasta sai uusintarevidenssin, jonka mediaaniaika uusintarevidenssiin oli 24,5 kuukautta (taulukko 1). Taulukossa 2 on vertailu niiden potilaiden välillä, joilla oli uusiutuma, ja niiden välillä, joilla ei ollut uusiutumaa. Iän (60,2 vs. 58,8, p = 0,582) tai naissukupuolen (61,5 vs. 70,4 %, p = 0,353) suhteen ei ollut eroa niiden potilaiden välillä, joiden kasvain uusiutui, ja niiden potilaiden välillä, joiden kasvain ei uusiutunut. Hoito-ominaisuudet olivat ryhmien välillä samanlaiset, ja suurin osa potilaista kummassakin ryhmässä sai pelkän leikkauksen (100,0 vs. 98,1 %, p = 1,000). Potilailla, joiden kasvaimet olivat uusiutuneet, oli kuitenkin suurempi STR-esiintyvyys (61,5 vs. 32,7 %, p = 0,004) ja pienempi Simpsonin asteen I resektion esiintyvyys (11,5 vs. 34,1 %, p = 0,019). Peritumoraalisen turvotuksen, kasvaimen koon ja kasvaimen tilavuuden esiintyvyys oli samanlainen ryhmien välillä. Histopatologisessa analyysissä potilailla, joilla oli uusiutunut kasvain, ydinatypia lisääntyi (19,2 vs. 7,5 %, p = 0,061). Potilailla, joilla oli uusiutuma, oli myös pidempi keskimääräinen seuranta-aika (68,9 vs. 37,7 kuukautta, p = 0,001).
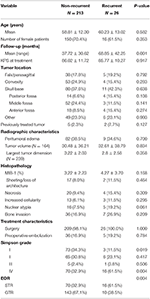
TAULUKKO 2. Vertailu potilaiden välillä, joilla oli uusiutuva meningeooma vs. ei-toistuva meningeooma.
Seuraava backward likelihood cox-regressioanalyysi toi esiin riippumattoman yhteyden uusiutumisen ja posterior fossa kasvaimen sijainnin välillä (HR = 5.25, CI 1,71-16,17, p = 0,004), MIB-1-indeksin (HR = 1,18, CI 1,05-1,34, p = 0,008), ydinatypian (HR = 5,24, CI 1,73-15,92, p = 0,003) ja STR:n (HR = 5,66, CI 1,30-13,92, p < 0,001; taulukko 3) välillä. Kaplan-Meierin käyrät, jotka korostavat uusiutumisvapaata eloonjäämistä posterior fossan sijainnin (p = 0,007), ydinatypian (p = 0,137), resektion laajuuden (p = 0,001) ja MIB-1 >4,5 %:n (p = 0,001) osalta, on esitetty kuvissa 1A-D.
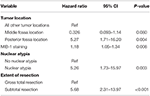
TAULUKKO 3. Coxin regressioanalyysi uusiutumista varten.

Kuvio 1. WHO-asteen I meningeooman uusiutumisen riskitekijöiden Kaplan Meierin käyrät. (A) Ydinatypia (sininen viiva) vs. ei ydinatypiaa (punainen viiva) (X2 = 2,21, p = 0,137). (B) Posterior-fossan kasvaimen sijainti (sininen viiva) vs. muut sijainnit (punainen viiva) (X2 = 10,36, p = 0,001). (C) MIB-1-indeksi >4,5 % (sininen viiva) vs. ≤4,5 % (punainen viiva) (X2 = 6,17, p = 0,013). (D) STR (sininen viiva) vs. GTR (punainen viiva) (X2 = 10.46, p = 0.001).
Predictors of Early vs. Post-median WHO Grade I Meningioma Recurrence
Taulukossa 4 on vertailtu potilaita, jotka eivät ole uusiutuneet, ja potilaita, joiden kasvaimet ovat uusiutuneet varhain tai post-median. Potilailla, joilla oli varhainen uusiutuminen, oli suurempi osittaisresektion esiintyvyys (76,9 vs. 32,7 %, p = 0,001). Heillä oli myös suuntaus siihen, että histopatologisessa tutkimuksessa esiintyi useammin ydinatypiaa (23,1 vs. 7,5 %, p = 0,084) (taulukko 4). Potilailla, joilla uusiutuminen tapahtui keskivaiheen jälkeen, kasvaimen sijainti posterior fossa (23,1 vs. 6,6 %, p = 0,063) ja luun invaasio (38,5 vs. 16,9 %, p = 0,064) sekä MIB-1-indeksi (5,55 vs. 3,22 %, p = 0,098) olivat yleistyneet. Simpsonin luokituksen tai GTR-asteiden välillä ei ollut merkittävää eroa potilailla, joilla oli postmediaalinen uusiutuminen vs. potilaat, joilla ei ollut uusiutumista (taulukko 4).
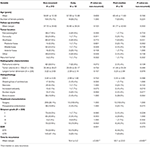
TAULUKKO 4. Varhainen vs. mediaanin jälkeinen uusiutuminen.
Kahdella monimuuttujaisella taaksepäin suuntautuvalla todennäköisyysbinäärilogistisella mallilla tunnistettiin varhaisen vs. mediaanin jälkeisen uusiutumisen ennustetekijät (taulukko 5). Kasvaimen varhaisen uusiutumisen riippumattomiin ennustetekijöihin kuuluivat ydinatypia histopatologiassa (OR = 6,45, CI 1,34-31,07, p = 0,020) ja STR (OR = 8,92, CI 2,18-36,46, p = 0,002). Ainoa itsenäinen uusiutumisen jälkeisen uusiutumisen ennustaja oli MIB-1-indeksi (OR = 1,24, CI 1,05-1,45, p = 0,010), vaikka posterior fossa -sijainti lähestyi merkitsevyyttä (OR = 4,42, CI 0,954-20,49, p = 0,058; taulukko 5).

TAULUKKO 5. Binäärinen logistinen malli kasvaimen uusiutumisen jälkeistä ja varhaista uusiutumista varten.
Recursive Partitioning Analysis of Recurrence
RPA suoritettiin meningeooman uusiutumisen keskeisten riskitekijöiden tunnistamiseksi (kuva 2). Yhdenmukaisesti cox-regressioanalyysin kanssa STR oli ensimmäinen osio ennustettaessa yleistä uusiutumista: STR-resektion läpikäyneistä potilaista 18,6 %:lla uusiutui, kun taas GTR-resektion läpikäyneistä potilaista 6,5 %:lla uusiutui. Seuraava päätöksentekosolmu vain GTR-potilaiden sisällä koski 4,5 %:n MIB-1-rajaa, sillä 18,8 % potilaista, joiden MIB-1 >4,5 %, uusiutui verrattuna 3,3 %:iin potilaista, joiden MIB-1 ≤4,5 % (kuva 2A). Erityisesti mediaanin jälkeisen uusiutumisen osalta RPA tunnisti ensimmäisen päätöksentekosolmun MIB-1-raja-arvoksi 5,83 %: 22,2 %:lla potilaista, joiden MIB-1 >5,83 %, esiintyi uusiutumista, kun taas 3,3 %:lla potilaista, joiden MIB-1 ≤5,83 %. Seuraavassa päätöksentekosolmukkeessa käytettiin posterior fossa -kasvaimen sijaintia: 13,3 % potilaista, joilla oli posterior fossa -kasvain, uusiutui vs. 2,5 % muista kasvainpaikoista (kuva 2B). Varhaisen uusiutumisen RPA:n mukaan ensisijaisena päätöksentekosolmuna oli resektion laajuus: STR-potilaista 11,6 % uusiutui ja GTR-potilaista 2,0 %. Seuraavassa päätöksentekosolmukkeessa käytettiin falx- tai parasagittaalista sijaintia: 36,4 % falx- tai parasagittaalikasvaimista uusiutui vs. 8,1 % muista kasvainsijainneista (kuva 2C) (kuva 2C).
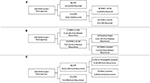
Kuva 2. Taudin uusiutuminen. Rekursiivinen partitioanalyysi, jossa korostuvat keskeiset riskitekijät (A) kokonaisuus uusiutumiselle, (B) postmediaaliselle uusiutumiselle ja (C) varhaiselle uusiutumiselle.
Keskustelu
Keskeiset tulokset
WHO:n I-luokan meningeooman uusiutuminen liittyy itsenäisesti MIB-1-indeksiin, posterior fossa -alueen kasvaimen sijaintiin, ydinaikaisen atypian läsnäoloon ja STR:ään. Tarkemmin sanottuna MIB-1-indeksi 4,5 % todettiin kliinisesti merkitykselliseksi raja-arvoksi WHO-luokan I meningeoomapotilaiden riskistratifioinnissa GTR:n jälkeen. Potilailla, joiden MIB-1-indeksi oli >4,5 % ja joiden WHO-luokan I meningeooman GTR oli samanlainen uusiutumisriski kuin potilailla, joilla oli STR. Lisäanalyysi toi esiin MIB-1:n kriittisenä tekijänä, joka oli yhteydessä välivuoden jälkeiseen uusiutumiseen, kun taas resektion laajuus oli tärkein varhaisen uusiutumisen aiheuttaja.
Predictors of WHO Grade I Meningioma Recurrence
Edellisissä tutkimuksissa on arvioitu samalla tavalla histopatologisten piirteiden, kliinisten ominaisuuksien ja uusiutumisen välistä suhdetta kaikissa meningeooman WHO-asteissa. Tutkimuksessa, johon osallistui 901 potilasta (716 WHO-asteen I, 174 asteen II ja 11 asteen III potilasta), Gousias ym. osoittavat suurempaa uusiutumisriskiä meningeoomissa, joiden MIB-1-indeksi on >10 %, korkeampi WHO-luokka, kasvaimen koko >6 cm, petroklivaalinen tai ontelosinuksen sijainti ja monilukuisuus (11). Gousias ym. eivät kuitenkaan arvioineet histologian epätyypillisten piirteiden esiintymisen ja kasvaimen uusiutumisen välistä yhteyttä. Erityisesti WHO-luokan I meningeoomien osalta Marciscano ym. käyttivät 148 WHO-luokan I meningeoomapotilaan kohorttia, joilla oli täydellinen patologinen analyysi, yksilöidäkseen muuttujia, jotka liittyvät uusiutumiseen, ja keskittyivät epätyypillisten patologisten piirteiden vaikutukseen uusiutumisriskiin (9). Mielenkiintoista on, että he tunnistavat epätyypillisten piirteiden esiintymisen riippumattomaksi riskitekijäksi MIB-1-indeksin >3 % ja Simpsonin resektion lisäksi. Tutkimuksessamme korostetaan samalla tavoin kirurgista GTR:ää ja atyyppistä piirrettä, ydinatypiaa, itsenäisinä uusiutumista ennustavina tekijöinä (taulukko 3), vaikka arvioimme kutakin atyyppistä piirrettä itsenäisesti. Otimme myös huomioon kasvaimen sijainnin cox-regressiomallissamme, ja tunnistimme edelleen kasvaimen sijainnin posterior fossa -osassa uusiutumisen riippumattomaksi riskitekijäksi. Marciscano ym. eivät ottaneet kasvaimen sijaintia mukaan etenemistä ennustavien tekijöiden analyysiinsa, mutta Gousias ym. osoittivat samalla tavoin, että kasvaimen petroklivaalinen sijainti on uusiutumisen riskitekijä, joskin tarkasteltaessa kaikkia WHO:n meningeooma-asteita (9, 11). Takakuopan sijaintiin liittyvä suurempi uusiutumisriski saattaa johtua NF2-mutaatioiden suuremmasta esiintyvyydestä takakuopassa (14, 15, 20), mutta emme pysty tutkimaan tätä täysin, koska emme rutiininomaisesti tee geneettisiä testejä meningeoomille omassa laitoksessamme. Siitä huolimatta tarvitaan lisätutkimuksia suuremmilla WHO-luokan I meningeooman potilaskohorteilla tämän suhteen selvittämiseksi.
MIB-1-indeksi ja WHO-luokan I meningeooman uusiutuminen
Samankaltaisesti kuin aiemmissa tutkimuksissa (9, 11, 13, 21) arvioimme tämän jälkeen myös kasvaimen MIB-1-indeksin ja uusiutumisriskin välistä yhteyttä. Arvioimme ensin MIB-1-indeksiä cox-regressiomallissa yleistä uusiutumista varten, kuten aiemmin käsiteltiin. Aiempien tutkimusten mukaisesti havaitsimme, että korkeampi MIB-1-indeksi liittyi itsenäisesti lisääntyneeseen kokonaisriskiin uusiutua. Koska MIB-1:n raja-arvoissa on kirjallisuudessa eroja ja koska laboratorioiden välillä on vaihtelua, arvioimme MIB-1:n aluksi jatkuvana muuttujana. Seuraavaksi pyrimme määrittämään MIB-1-indeksin raja-arvon potilaspopulaatiossamme käyttämällä RPA:ta yleisen uusiutumisen mallintamiseen, jolloin MIB-1:n raja-arvoksi määritettiin 4,5 % GTR-potilailla (kuva 2A). Mielenkiintoista oli, että näillä potilailla oli samanlainen uusiutumisriski kuin potilailla, joilla oli STR, mikä osoittaa MIB-1:n käyttökelpoisuuden GTR:n jälkeisillä potilailla. Perry et al. tunnistavat samalla tavalla MIB-1-indeksin 4,2 %:n olevan yhteydessä GTR:n jälkeiseen uusiutumiseen univariaattisessa analyysissä, vaikkakin tarkasteltaessa kaikkia meningeooma-asteita (22).
Potilaiden, joilla oli GTR ja MIB-1 >4,5 %, uusiutumisprosentti, joka oli 18,8 %, korostaa näiden potilaiden tiiviin seurannan tai jopa adjuvanttisen sädehoidon harkitsemisen tarvetta potilaan mieltymysten mukaan. WHO-luokan I meningeooman resektion jälkeisen adjuvanttisen sädehoidon on osoitettu vähentävän uusiutumista erityisesti STR:n jälkeen (23-25), vaikka STR:n jälkeinen tarkkailu onkin edelleen vakiokäytäntö (8). Tutkimuksessa, johon osallistui 92 WHO-luokan I meningeoomaa, Soyuer ym. osoittivat 91 prosentin etenemisvapaan eloonjäämisajan (PFS) potilailla, jotka saivat adjuvanttia sädehoitoa STR:n jälkeen, mikä oli huomattavasti korkeampi kuin 38 prosentin eloonjäämisaika potilailla, jotka eivät olleet saaneet adjuvanttia sädehoitoa (24). Koska tutkimuksessamme potilailla, joilla oli STR, oli samanlainen uusiutumisriski kuin potilailla, joilla oli GTR ja MIB-1 >4,5 %, adjuvanttinen sädehoito voi olla järkevää molemmissa ryhmissä. Tarvitaan kuitenkin laajempia tutkimuksia MIB-1-raja-arvomme ja siihen liittyvien kliinisten vaikutusten validoimiseksi edelleen. Tarvitaan myös prospektiivisia tutkimuksia, joissa tutkitaan adjuvanttisen sädehoidon käyttöä WHO-luokan I meningeoomissa.
Predictors of Early and Post-median WHO Grade I Meningioma Recurrence
Given the trend towards a later recurrence in patients with a elevated MIB >4.5 % (kuva 1C), pyrimme tämän jälkeen tutkimaan eroja ennustetekijöissä niiden potilaiden välillä, jotka uusiutuivat varhain (määriteltynä 2 vuoden kuluessa hoidosta) tai keskihoidon jälkeen (ne, jotka uusiutuivat >2 vuotta hoidon jälkeen). Kirjallisuudessa on vain vähän tutkimuksia, joissa on tutkittu meningeoomien varhaisen uusiutumisen ennustetekijöitä. Budohoskin ym. tutkimuksessa 220 epätyypillisestä meningeoomasta koostuvassa kohortissa (26) parafalcine-sijainti, STR ja peritumoraalinen ödeema röntgenkuvauksessa ovat varhaisen uusiutumisen ennusmerkkejä. Samankaltaisessa Maillon ym. tutkimuksessa, joka koski WHO:n I-luokan meningeoomia, hyödynnettiin interfaasifluoresenssi-in-situ-hybridisaatiota (FISH) ja patologisia piirteitä varhaisen uusiutumisen riskitekijöiden tunnistamiseksi (määriteltynä 2,5 vuotta hoidon jälkeen), ja siinä todettiin, että suurempi kasvaimen koko, karyotyyppipoikkeavuudet, potilaan ikä ja kromosomin 10 poikkeavuudet liittyivät lisääntyneeseen uusiutumisriskiin (19). Kirjoittajat eivät kuitenkaan ottaneet huomioon atypian esiintymistä patologiassa tai MIB-1-indeksiä. Käyttämällä WHO-luokan I meningeoomapotilaiden kohorttia, jolla oli rakeisempia patologisia ja kliinisiä tietoja, tunnistimme resektion laajuuden ja ydinatypian patologiassa riippumattomiksi varhaisen uusiutumisen ennustajiksi binäärisen logistisen regressiomallinnuksen avulla (taulukko 5). RPA paljasti samalla tavoin resektion laajuuden merkityksen potilaiden riskiluokittelussa varhaisen uusiutumisen suhteen (kuva 2C). Mielenkiintoista oli myös, että se korosti falx/parasagittaaliseen kasvaimen sijaintiin liittyvää lisääntynyttä riskiä, mikä vastaa Budohoskin ja muiden (26) havaintoja. Ainoa merkitsevä kasvaimen postmediaalisen uusiutumisen ennustaja binäärisessä logistisessa regressiomallinnuksessa oli MIB-1-indeksi, vaikka kasvaimen sijainti posterior fossa lähestyi merkitsevyyttä. Tämä osoitettiin edelleen RPA:lla (kuva 2B). Yllättäen resektion laajuus ei ollut riippumaton ennustaja keskialueen jälkeiselle uusiutumiselle, koska suurimmalle osalle keskialueen jälkeisistä uusiutumisista oli tehty GTR. Keskialueen jälkeiset uusiutumiset saattavat korostaa WHO:n I-luokan meningeoomien luokkaa, joka on molekyylisesti aggressiivisempi ja uusiutuu GTR:stä huolimatta, kun otetaan huomioon niiden kohonnut MIB-1-indeksi ja posterior fossa -sijainti. Varhaisiin uusiutumiin vaikuttaa huomattavasti enemmän resektion laajuus, ja näin ollen ne edustavat todennäköisesti jäännöskasvaimen jatkuvaa kasvua eikä edellisen kokonaan resektoidun kasvaimen uusiutumista, kuten keskikohdan jälkeisissä uusiutumissa. Näin ollen tuloksemme edustavat mahdollisesti kahta erilaista molekyylitason WHO:n I asteen meningeooman alatyyppiä. Tulevia tutkimuksia, joissa käytetään suurempia potilaskohortteja ja molekulaarisia kasvaintietoja, tarvitaan kuitenkin, jotta voidaan tutkia tarkemmin molekulaaristen muutosten taustalla olevia eroja varhaisten ja mediaanin jälkeisten uusiutumien välillä.
Perusteiden rajoitukset
Tutkimuksemme rajoituksiin kuuluvat sen retrospektiivinen luonne ja uusiutumien alhainen esiintyvyys. Tutkimuksemme käsittää myös potilaita vuodesta 2007 alkaen ja kattaa näin ollen sekä vuoden 2007 että 2016 WHO:n CNS-luokitusjärjestelmät. Ainoa merkittävä muutos näiden kahden luokituksen välillä oli kuitenkin aivoinvaasion lisääminen WHO-luokan II-statuksen yksinäiseksi kriteeriksi. Vain kahdella kohorttiimme kuuluneella potilaalla todettiin patologisessa analyysissä aivoinvaasio, eikä kummallakaan potilaalla uusiutunut tauti. Näin ollen emme usko, että vuoden 2007 luokitusjärjestelmän mukaisesti luokiteltujen potilaiden mukaan ottamisella oli merkittävää vaikutusta tuloksiimme. Lisäksi tutkimuksemme perustuu alkuperäisen resektion jälkeisiin patologisiin raportteihin ilman patologisten diojen keskitettyä uudelleentarkastelua. Tämä saattaa lisätä vaihtelua patologisissa muuttujissa, kuten ydinatypiassa ja muissa samankaltaisissa patologisissa löydöksissä, joissa voi olla havaitsijoiden välistä vaihtelua (27, 28). MIB-1 on kuitenkin suhteellisen objektiivinen mittausmenetelmä, jonka havaitsijoiden välinen vaihtelu on vähäisempää samaa menetelmää käyttävien patologien välillä patologian laboratoriossa (29). MIB-1-testauskäytännöt muuttuivat myös tutkimusjakson aikana yksittäisen patologin mieltymyksistä, jotka vaihtelivat patologin mukaan, kaikkien potilaiden testaamiseen. Tekijät, jotka patologit ottivat huomioon päättäessään MIB-1-testauksesta, sisälsivät tutkimuksessamme mukana olleet epätyypilliset piirteet, mikä minimoi niiden mahdollisen vaikutuksen tuloksiimme. Lisäksi kaikki tutkimukseemme sisällytetyt meningeoomat ovat WHO:n luokkaa I. Näin ollen uskomme, että näiden käytäntöjen muutosten aiheuttama harha on minimaalinen. Lopuksi, vaikka sisällytämme yksityiskohtaiset kliiniset ja patologiset ominaisuudet, potilaskohortistamme puuttuu tietoa kasvaimen geneettisistä ja molekulaarisista muutoksista, joilla on osoitettu olevan merkittävä vaikutus kasvaimen lopputulokseen (15, 30-32). Näin ollen WHO:n I-luokan meningeoomien yleistä uusiutumista ennustettaessa tarvitaan perinteisten patologisten ja kliinisten muuttujien lisäksi lisää laajoja moni-instituutiotutkimuksia, joissa on molekyyligeneettisiä tietoja. Tähän sisältyy molekyyligeneettisten ennustetekijöiden, kuten genomin laajuisten metylaatiomallien (33, 34), TERT-promoottorimutaatioiden (35) ja muiden kasvaimen molekyylitietojen huomioon ottaminen. Tulostemme perusteella on perusteltua tutkia tulevaisuudessa myös varhaisen ja myöhemmän uusiutumisen ainutlaatuisia geneettisiä/molekyyligeneettisiä, kliinisiä ja patologisia ennustetekijöitä, kun otetaan huomioon niiden mahdollinen vaikutus lääkäreiden terapeuttiseen päätöksentekoon.
Tutkimuksemme tarjoaa kuitenkin yksityiskohtaista tietoa uusiutumisen kliinisistä ja histopatologisista ennustetekijöistä erityisesti WHO-luokan I meningeoomissa. Lisäksi tunnistamme potilaat, joiden MIB-1 >4,5 % on suuri uusiutumisriski GTR:n jälkeen. Hyödynnämme tietojamme myös saadaksemme tietoa WHO:n I-luokan meningeooman varhaisen ja myöhemmän uusiutumisen välisistä eroista ja mahdollisesti erilaisten WHO:n I-luokan meningeooman molekulaaristen alaryhmien tunnistamiseksi. Tuloksemme viittaavat siihen, että potilailla, joilla on kohonnut MIB-1-indeksi ja ydinatypia patologisessa analyysissä, kasvaimen sijainti posterior fossa ja STR, on suurempi uusiutumisriski, ja heitä olisi harkittava tiiviimpää seurantaa tai jopa adjuvantti sädehoitoa. Lisäksi potilailla, joiden MIB-1-indeksi on yli 4,5 %, on samanlainen uusiutumisriski kuin niillä potilailla, joille on tehty kasvaimensa STR, ja myös heillä olisi mahdollisesti harkittava adjuvanttia sädehoitoa.
Johtopäätös
Kirjallisuutta WHO:n I-luokan meningeoomien spesifisistä uusiutumisen ennusmerkeistä on edelleen niukasti. Tämän tutkimuksen tulokset korostavat posterior fossa -kasvaimen sijaintia, MIB-1-indeksiä, ydinatypiaa ja resektion laajuutta, jotka ovat itsenäisesti yhteydessä luokan I meningeoomien uusiutumiseen. Osoitamme myös, että potilailla, joilla on MIB-1 >4,5 % ja GTR, on samanlainen uusiutumisriski kuin potilailla, joilla on STR. Lopuksi varhaisten ja postmediaalisten uusiutumien erilainen analyysi paljasti MIB-1-indeksin ja posterior fossan sijainnin yhteyden postmediaalisissa uusiutumissa, kun taas varhaisiin uusiutumiin vaikutti merkittävämmin resektion laajuus. Tarvitaan lisätutkimuksia, jotka validoivat havaintomme ja sisältävät molekyyligeneettisiä tietoja, jotta WHO:n I-luokan meningeoomien uusiutumista ennustavat tekijät voidaan tunnistaa. Tällaiset tutkimukset voisivat tarjota tarkemmat puitteet potilaiden riskiluokittelulle ja auttaa terapeuttisessa päätöksenteossa, mukaan lukien mahdollinen adjuvantti sädehoito.
Data Availability Statement
Tekijät antavat tämän artikkelin johtopäätöksiä tukevat raakadatat saataville ilman aiheettomia varauksia.
Ethics Statement
Tutkimukset, joissa oli mukana ihmisosallistujia, tarkistettiin ja hyväksyttiin UCSF:n institutionaalisessa arviointilautakunnassa. Kirjallista tietoista suostumusta osallistumiseen ei vaadittu tässä tutkimuksessa kansallisen lainsäädännön ja laitoksen vaatimusten mukaisesti.
Tekijöiden panos
AH: käsitteellistäminen, metodologia, muodollinen analyysi, tutkimus, kirjoittaminen-alkuperäinen luonnos, kirjoittaminen-katselmus ja muokkaus sekä visualisointi. JY: käsitteellistäminen, metodologia ja kirjoittaminen-katselmus ja muokkaus. IK ja SS: tutkimus. J-SC: visualisointi ja muodollinen analyysi. DR ja MM: kirjoittaminen, tarkistaminen ja muokkaaminen. SM: kirjoittaminen, tarkistaminen ja muokkaaminen, käsitteellistäminen ja metodologia. MA: kirjoittaminen, tarkistaminen ja muokkaaminen sekä valvonta. Kaikki kirjoittajat osallistuivat artikkelin laatimiseen ja hyväksyivät toimitetun version.
Esintressiristiriita
Tekijät ilmoittavat, että tutkimus suoritettiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Katselmoija BB ilmoitti käsittelystä vastaavalle päätoimittajalle, että hänellä on ollut aiempia yhteistoiminta-ajankohtia yhdessä kirjoittajien DR:n, MM:n ja SM:n kanssa.
1. Ostrom QT, Cioffi G, Gittleman H, Patil N, Waite K, Kruchko C, et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2012-2016. Neuro Oncol. (2019) 21:v1-100. doi: 10.1093/neuonc/noz150
PubMed Abstract | CrossRef Full Text | Google Scholar
2. TUTKIMUKSEN TULOKSET. Karsy M, Guan J, Cohen A, Colman H, Jensen RL. Meningeoomien lääketieteellinen hoito. Nykytila, epäonnistuneet hoidot ja lupaavat näköalat. Neurosurg Clin N Am. (2016) 27:249-60. doi: 10.1016/j.nec.2015.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Brastianos PK, Galanis E, Butowski N, Chan JW, Dunn IF, Goldbrunner R, ym. Meningeoomien monitieteisen hoidon edistyminen. Neuro Oncol. (2019) 21:I18-31. doi: 10.1093/neuonc/noy136
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Fysioterapia. Pettersson-Segerlind J, Orrego A, Lönn S, Mathiesen T. Kirurgisesti hoidettujen parasagittaalisten meningeoomien pitkäaikainen 25 vuoden seuranta. World Neurosurg. (2011) 76:564-71. doi: 10.1016/j.wneu.2011.05.015
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Meneagneurologia. Van Alkemade H, De Leau M, Dieleman EMT, Kardaun JWPF, Van Os R, Vandertop WP, et al. Impaired survival and long-term neurological problems in benign meningioma. Neuro Oncol. (2012) 14:658-66. doi: 10.1093/neuonc/nos013
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Buerki RA, Horbinski CM, Kruser T, Horowitz PM, James CD, Lukas RV. Yleiskatsaus meningeoomiin. Futur Oncol. (2018) 14:2161-77. doi: 10.2217/fon-2018-0006
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Rogers L, Barani I, Chamberlain M, Kaley TJ, McDermott M, Raizer J, et al. Meningeomas: tietopohja, hoitotulokset ja epävarmuudet. RANO-katsaus. J Neurosurg. (2015) 122:4-23. doi: 10.3171/2014.7.JNS131644
PubMed Abstract | CrossRef Full Text | Google Scholar
9. JNS131644. Marciscano AE, Stemmer-Rachamimov AO, Niemierko A, Larvie M, Curry WT, Barker FG, et al. Benignit meningeoomat (WHO-luokka I), joilla on epätyypillisiä histologisia piirteitä: histopatologisten piirteiden korrelaatio kliinisten tulosten kanssa. J Neurosurg. (2016) 124:106-14. doi: 10.3171/2015.1.JNS142228
PubMed Abstract | CrossRef Full Text | Google Scholar
10. JNS142228. Baumgarten P, Gessler F, Schittenhelm J, Skardelly M, Tews DS, Senft C, et al. Brain invasion in otherwise benign meningiomas does not predict tumor recurrence. Acta Neuropathol. (2016) 132:479-81. doi: 10.1007/s00401-016-1598-1
PubMed Abstract | CrossRef Full Text | Google Scholar
11. TUTKIMUKSET JA TUTKIMUKSET (2016) 132:479-81. Gousias K, Schramm J, Simon M. The simpson grading revisited: aggressiivinen leikkaus ja sen paikka nykyaikaisessa meningeooman hoidossa. J Neurosurg. (2016) 125:551-60. doi: 10.3171/2015.9.JNS15754
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Matsuno A, Fujimaki T, Sasaki T, Nagashima T, Ide T, Asai A, et al. Kliininen ja histopatologinen analyysi uusiutuvien ja ei-toistuvien meningeoomien proliferatiivisesta potentiaalista. Acta Neuropathol. (1996) 91:504-10. doi: 10.1007/s004010050458
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Oya S, Kawai K, Nakatomi H, Saito N. Simpsonin luokitusjärjestelmän merkitys nykyaikaisessa meningeoomakirurgiassa: luokan integrointi MIB-1-merkintäindeksin kanssa avaimena WHO:n I-luokan meningeoomien uusiutumisen ennustamiseen – kliininen artikkeli. J Neurosurg. (2012) 117:121-8. doi: 10.3171/2012.3.JNS111945
PubMed Abstract | CrossRef Full Text | Google Scholar
14. JNS111945. Yuzawa S, Nishihara H, Tanaka S. Meningeooman geneettinen maisema. Brain Tumor Pathol. (2016) 33:237-47. doi: 10.1007/s100714-016-0271-7
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Minkälainen se on? Karsy M, Azab MA, Abou-Al-Shaar H, Guan J, Eli I, Jensen RL, et al. Clinical potential of meningioma genomic insights: a practical review for neurosurgeons. Neurosurg Focus. (2018) 44:E10. doi: 10.3171/2018.2.FOCUS1849
PubMed Abstract | CrossRef Full Text | Google Scholar
16. MSG. Patel AJ, Wan YW, Al-Ouran R, Revelli JP, Cardenas MF, Oneissi M, et al. Molecular profiling predicts meningioma recurrence and reveals loss of DREAM complex repression in aggressive tumors. Proc Natl Acad Sci USA. (2019) 116:21715-26. doi: 10.1073/pnas.1912858116
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Menninkoliomat. Spille DC, Heß K, Sauerland C, Sanai N, Stummer W, Paulus W, et al. Brain invasion in meningiomas: incidence and correlations with clinical variables and prognosis. World Neurosurg. (2016) 93:346-54. doi: 10.1016/j.wneu.2016.06.055
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Myrkkykeuhkot. PiŽem J, Velnar T, Prestor B, Mlakar J, Popović M. Aivoinvaasion arvioitavuus meningeoomissa on yhteydessä meningeooman kokoon ja asteeseen, ja sitä voidaan parantaa ottamalla laaja näytteenotto kirurgisesti poistetusta meningeoomanäytteestä. Clin Neuropathol. (2014) 33:354-63. doi: 10.5414/NP300750
PubMed Abstrakti | CrossRef Full Text | Google Scholar
19. Maillo A, Orfao A, Espinosa AB, Sayagués JM, Merino M, Sousa P, et al. Early recurrences in histologically benign/grade I meningiomas are associated with large tumors and coexistence of monosomy 14 and del(1p36) in ancestral tumor cell clone. Neuro Oncol. (2007) 9:438-46. doi: 10.1215/15228517-2007-026
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Youngblood MW, Duran D, Montejo JD, Li C, Omay SB, Özduman K, Sheth AH, et al. Correlations between genomic subgroup and clinical features in a cohort of more than 3000 meningiomas. J Neurosurg. (2019). doi: 10.3171/2019.8.jns191266. .
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Chen WC, Magill ST, Wu A, Vasudevan HN, Morin O, Aghi MK, et al. Histopatologiset piirteet, jotka ennustavat epätyypillisen meningeooman paikalliskontrollia leikkauksen ja liitännäissädehoidon jälkeen. J Neurosurg. (2019) 130:443-50. doi: 10.3171/2017.9.JNS171609
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Perry A, Stafford SL, Scheithauer BW, Suman VJ, Lohse CM. MIB-1:n, p53:n ja DNA:n virtaussytometrian prognostinen merkitys täysin resektoiduissa primaarisissa meningeoomissa. Cancer. (1998) 82:2262-9. doi: 10.1002/(SICI)1097-0142(19980601)82:11<2262::AID-CNCR23>3.0.CO;2-R
PubMed Abstract | CrossRef Full Text | Google Scholar
23. TUTKIMUKSEN TULOKSET. Ohba S, Kobayashi M, Horiguchi T, Onozuka S, Yoshida K, Ohira T, et al. Long-term surgical outcome and biological prognostic factors in patients with skull base meningiomas: clinical article. J Neurosurg. (2011) 114:1278-87. doi: 10.3171/2010.11.JNS10701
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Soyuer S, Chang EL, Selek U, Shi W, Maor MH, DeMonte F. Sädehoito hyvänlaatuisen aivojen meningeooman leikkauksen jälkeen. Radiother Oncol. (2004) 71:85-90. doi: 10.1016/j.radonc.2004.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Minkälainen se on? Park S, Cha YJ, Suh SH, Lee IJ, Lee KS, Hong CK, et al. Riskiryhmään mukautettu adjuvantti sädehoito WHO-luokan I ja II kallonpohjan meningeoomassa. J Cancer Res Clin Oncol. (2019) 145:1351-60. doi: 10.1007/s00432-019-02891-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Budohoski KP, Clerkin J, Millward CP, O’Halloran PJ, Waqar M, Looby S, et al. Predictors of early progression of surgical treated atypical meningiomas. Acta Neurochir. (2018) 160:1813-22. doi: 10.1007/s00701-018-3593-x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. De La Monte SM, Flickinger J, Linggood RM. Histopatologiset piirteet, jotka ennustavat meningeoomien uusiutumista subtotaalisen resektion jälkeen. Am J Surg Pathol. (1986) 10:836-43. doi: 10.1097/00000478-198612000-00002
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Backer-Grøndahl T, Moen BH, Torp SH. Ihmisen meningeoomien histopatologinen kirjo. Int J Clin Exp Pathol. (2012) 5:231-42.
PubMed Abstract | Google Scholar
29. Rezanko T, Akkalp AK, Tunakan M, Sari AA. MIB-1:n laskentamenetelmät meningeoomissa ja patologien välinen yksimielisyys. Anal Quant Cytol Histol. (2008) 30:47-52.
PubMed Abstract | Google Scholar
30. Fysiologiset tutkimukset (2008). Pérez-Magán E, Campos-Martín Y, Mur P, Fiaño C, Ribalta T, García JF, et al. Genetic alterations associated with progression and recurrence in meningiomas. J Neuropathol Exp Neurol. (2012) 71:882-93. doi: 10.1097/NEN.0b013e31826bf704
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Linsler S, Kraemer D, Driess C, Oertel J, Kammers K, Rahnenführer J, et al. Meningeooman etenemisen ja uusiutumisen molekyylibiologiset määritykset. PLoS ONE. (2014) 9:e94987. doi: 10.1371/journal.pone.0094987
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Barbera S, Miguel TS, Gil-Benso R, Muñoz-Hidalgo L, Roldan P, Gonzalez-Darder J, et al. Genetic changes with prognostic value in histologically benign meningiomas. Clin Neuropathol. (2013) 32:311-7. doi: 10.5414/NP300580
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Menninkäiset aivotulehdukset. Gao F, Shi L, Russin J, Zeng L, Chang X, He S, et al. DNA-metylaatio meningeoomien pahanlaatuisessa transformaatiossa. PLoS ONE. (2013) 8:e54114. doi: 10.1371/journal.pone.0054114
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Ks. esim. Vengoechea J, Sloan AE, Chen Y, Guan X, Ostrom QT, Kerstetter A, et al. Methylation markers of malignant potential in meningiomas. J Neurosurg. (2013) 119:899-906. doi: 10.3171/2013.7.JNS13311
PubMed Abstract | CrossRef Full Text | Google Scholar
35. JNS13311. Lu VM, Goyal A, Lee A, Jentoft M, Quinones-Hinojosa A, Chaichana KL. TERT-promoottorimutaatioiden prognostinen merkitys meningeoomassa: systemaattinen katsaus ja meta-analyysi. J Neurooncol. (2019) 142:1-10. doi: 10.1007/s11060-018-03067-x
PubMed Abstract | CrossRef Full Text | Google Scholar