Introduction
Rice has a complex root architecture with a mix of embryonic and post-embryonic roots. Sädekehä syntyy ensimmäisenä itämisen aikana, ja pian sen jälkeen alkion sepelvaltimojuuret (Rebouillat et al., 2009; Coudert et al., 2010). Ensimmäiset verson apikaalisen meristemin toiminnan tuloksena syntyneet alkion jälkeiset juuret ilmestyvät muutama päivä taimien itämisen jälkeen. Adventitiivisia juuria kutsutaan myös sepelvaltimojuureksi tai kruunujuuriksi, ja niitä syntyy koko kasvin eliniän ajan.
Riisin juurten sisäinen anatomia on hyvin kuvattu erityisesti taimivaiheessa (Rebouillat et al., 2009). Epidermiksen ja verisuonikudosten välissä sijaitsee useita keskittyneitä kudoksia (periferiasta steleen) (kuva 1). Näihin kudoksiin, joita kutsutaan yhdessä ”pohjakudokseksi”, viitataan toisinaan myös nimellä ”kuori” (Lux et al., 2004). Tässä yhteydessä säilytämme yleistermin, eli pohjakudoksen, kuvaamaan eksodermaalisia, sklerenkymaattisia, kortikaalisia ja endodermaalisia kudoksia. ”Korteksilla” tarkoitamme endodermiksen ja sklerenkyymin välissä sijaitsevaa kudosta.
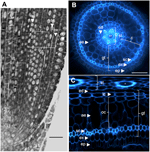
KUVA 1. Korteksikudos. Kuuden päivän ikäisen Nipponbare-juurakkeen anatomia. (A) Pitkittäisleikkaus kiinnitetystä ja paraplastiin upotetusta sädekehästä. Palkki = 100 μm. (B) Tuoreen sädekehän poikkileikkaus UV-valossa tarkasteltuna. Palkki = 50 μm. (C) Polaarinen muunnoskuva B:stä. Kudoskerrokset on merkitty seuraavasti: stele (st), pohjakudos (gt), joka koostuu useista solukerroksista: yhdestä endodermiksen kerroksesta (ed), useista kuorikerroksista (c), yhdestä sklerenkyymikerroksesta (sc) ja yhdestä eksodermiksen kerroksesta (ex). Endodermiksen (ed) ja eksodermiksen (ex) kerrokset ovat helposti tunnistettavissa fluoresenssin puuttumisen/vähenemisen perusteella näiden solujen soluseinäkeskuksissa. Sädekehää suojaa yksi kerros epidermistä (ep). Kaksi erilaista kuorikerrosta voidaan tunnistaa: sisempi kuori (ic), joka on endodermiksen (ed) vieressä, ja ulompi kuori (oc), joka muodostaa lopulta aerenkyylin (ae). Huomaa, että stelessä on suuri keskimmäinen metaksylem (cx), jota ympäröi 6 metaksylemin (x) verisuonta.
Pohjakudos koostuu useista kudoskerroksista, joilla on sama parenkymaattinen alkuperä mutta erilaiset erityispiirteet ja joilla on erilaisia ja tärkeitä rakenteellisia ja toiminnallisia tehtäviä juurissa. Esimerkiksi eksodermis ja endodermis ovat apoplastisia esteitä, jotka säätelevät veden ja ravinteiden säteittäistä kulkeutumista maaperästä fotosynteettisiin elimiin, ja tämä ominaisuus saadaan aikaan lähinnä suberiinilamellien kerrostumisen ja sekundaarisen soluseinän erilaistumisen avulla (Gregory 2006). Sclerenchyma on lignifioitunut solukko, joka muodostaa kriittisen esteen joillekin metalleille ja jolla on mahdollisesti mekaaninen tukitehtävä (Huang et al., 2012). Toisin kuin nämä kolme yksikerroksista kudosta, riisin sädekehän kortikaalikudos koostuu neljästä tai viidestä kerroksesta. Tälle kudokselle, jota kutsutaan myös keskikorteksiksi tai mesodermikseksi, on ominaista tilojen skitsogeeninen muodostuminen, mikä johtaa aerenkyymin muodostumiseen riisissä (Justin ja Armstrong, 1991; Kawai et al., 1998). Aerenkymalla on suuri merkitys tulvien sietokyvyssä, ja se varmistaa jatkuvan hapen virtauksen versosta juureen, mikä mahdollistaa juuren kasvun hapettomissa olosuhteissa. Korteksilla on tärkeä mutta vaihteleva tehtävä lukuisten lajien juurifysiologiassa, ja se osallistuu varastointiin, tulvien sietoon tai symbioottisiin vuorovaikutuksiin (Lux ym., 2004).
Tähti- ja latvajuuret tuottavat kolmentyyppisiä sivujuuria: pieniä sivujuuria (small lateral roots, SLR) ja kahta erilaista isoa sivujuurityyppiä (Kawata ja Shibayama, 1965; Kono ym., 1972; Rebouillat ym., 2009). Tämä jako perustuu i) juuren halkaisijaan: SLR-juuret ovat pienimpiä (50-60 μm) ja L-LLR-juuret suurimpia (120-150 μm), (ii) haarautumat, joita havaitaan vain LLR-juurissa, (iii) keskimmäisen metaksylema-astian esiintyminen vain LLR-juurissa ja (iv) sklerenkyymikerroksen esiintyminen vain L-LLR-juurissa (Kono ym., 1972; Kawata ym., 1977; Rebouillat ym., 2009). Tästä luokittelusta huolimatta sivujuurten, erityisesti SLR:ien, sisäisten juurikudosten identiteetti on edelleen epävarma. Rebouillat ym. (2009) ja Kawata ym. (1977) väittivät molemmat, että SLR:n pohjakudos koostui endodermiksestä, sklerenkyymistä ja eksodermiksestä (sisältä ulospäin), kun taas Kono ym. (1972) kuvailivat, että SLR:ssä ja T-LLR:ssä ei ole sisäkorteksin skerenkymaalista solukerrosta.
Tämän dilemman ratkaisemiseksi ja yleensä tiettyjen kudosten kehityksen ja toiminnan tutkimiseksi tarvitaan identiteettimerkkiaineiden käyttöä. Suurin osa tähän asti käytetyistä kudosmarkkereista on morfologisia markkereita tai histokemiallisia värjäyksiä, jotka ovat tarjonneet käyttökelpoisen tavan luonnehtia solujen identiteettiä. Berberiini paljastaa suberiinin läsnäolon soluseinissä, jota esiintyy lähes yksinomaan kutakin yksittäistä endodermisolua ympäröivissä kasparikaistaleissa, ja se on siten hyvä epäsuora endodermi-identiteetin merkkiaine (Brundett ym., 1988). A. thalianassa kudospesifisiä merkkiaineita kehitettiin myös käyttämällä kudospesifisiä promoottoreita, jotka oli fuusioitu raportointigeeneihin (GUS ja/tai GFP) geneettisesti muunnetuissa kasveissa. Esimerkiksi SCARECROW-promoottoria käytetään endodermi-identiteetin merkkiaineena (Sugimoto et al., 2010). Myös QC25- ja QC46- tehostinloukku-GUS-linjat (Sabatini ym., 2003) ja QHB-linja riisissä (Kamiya ym., 2003) tunnistettiin niiden QC-spesifisen ilmentymisen perusteella hiljaisen keskuksen (QC) merkkiaineiksi. Vaikka näitä merkkiaineita kohtaan tunnetaankin kiinnostusta, niitä on saatavilla vain muutamia ja lähes yksinomaan A. thalianassa. Niillä on myös haittoja. Esimerkiksi SCARECROW-promoottorin (SCR) soveltuvuus ”endodermiksen” merkkiaineeksi on kyseenalainen, kun käsitellään erityisiä kysymyksiä SCR:n ja LYHYEN JUUREN (SHR) roolista pohjakudoksen erilaistumisessa. SCR- ja SHR-geenit osallistuvat nimittäin sinänsä endodermiksen/kuoren muodostumiseen (Wu ja Gallagher, 2014). A. thalianassa ainoat saatavilla olevat juurikuoren merkkiaineet ovat Co2- ja Co3-promoottorit (Heidstra ym., 2004; Ten Hove ym., 2010). Riisissä näitä aivokuoren merkkiaineita ei vielä käytetä, koska Co2- ja Co3-geeneille ei ole selkeitä ortologeja. Riisissä on tähän mennessä käytetty vain epäsuoria morfologisia markkereita, kuten aerenkyylin muodostumista kortikaalisen identiteetin osoittamiseksi (Rebouillat et al., 2009).
Toinen markkerien luokka ovat kaupallisesti saatavilla olevat kasvien soluseiniin kohdistuvat vasta-aineet (http://www.plantprobes.net/index.php). Näitä markkereita on aiemmin käytetty vähän, mutta niiden tehokkuus on osoitettu. Esimerkiksi CCRC-M2- ja JIM13-soluseinävasta-aineita käytettiin A. thalianassa osoittamaan, että shr-mutantissa esiintyvällä yhdellä sisäkudoskerroksella oli kortikaalinen identiteetti, kun taas scr-mutantin pohjakudoskerroksella oli useita identiteettejä (Di Laurenzio ym., 1996; Helariutta ym., 2000). Näillä merkkiaineilla on monia etuja: niiden yksinkertaisuus ja mahdollisuus yhdistää eri fluorokromeihin kytkettyjä sekundäärivasta-aineita, jotta voidaan rajoittaa päällekkäisyyttä autofluoresenssin kanssa, ne eivät vaadi geneettistä transformaatiota ja niitä voidaan käyttää täydentämään muita merkkiaineluokkia.
Tässä artikkelissa kuvaamme aluksi yksinkertaisen, keskinkertaisen läpimenon mahdollistavan protokollan, jolla voidaan tehdä immunomerkintöjä tuoreista vibratomikudosleikkeistä. Tätä protokollaa käyttäen seuloimme riisin sädekehien radiaalipoikkileikkauksia suurella 174 soluseinän vasta-aineen kirjastolla. Näistä tunnistimme kahdeksan kuori-spesifistä merkkiainetta ja osoitimme, että riisillä on kahdenlaisia kuorikudoksia, joilla on erilainen identiteetti. Kutsuimme näitä kerroksia sisä- ja ulkokuoreksi niiden anatomisen sijainnin perusteella juuren poikkileikkauksissa. Osoittaaksemme näiden aivokuori-spesifisten merkkiaineiden hyödyllisyyden selvitimme sivujuurten pohjakudosidentiteetit käyttämällä kolmea näistä vasta-aineista. Erityisesti SLR-juurissa osoitamme, että sisäisellä kudoskerroksella on ulkokortikaalinen identiteetti. Protokollamme on riittävän yleinen, jotta sitä voidaan käyttää kudosmerkkien kehittämiseen missä tahansa lajissa ilman tarvetta tuottaa siirtogeenisiä kasveja. Tätä protokollaa voidaan helposti mukauttaa muiden kasvien tuoreilla versoilla, lehdillä, juurilla tai millä tahansa kudoksilla, ja se on yksinkertainen ja helppo tapa tunnistaa kudosspesifisiä merkkiaineita. Lisäksi näitä merkkiaineita voidaan käyttää yhdessä muiden molekyylimarkkereiden kanssa.
Tulokset
Soluseinän vasta-aineiden immunoprofilointi riisin juuren radiaalileikkeissä paljastaa spesifisiä vasta-aineita kuorikerroksille
Tarkoituksenamme tunnistaa vasta-ainepohjaisia merkkiaineita kuorikerroksen soluille laadimme aluksi protokollan tuoreiden riisin juuren radiaalileikkeistä keskitehon kautta tapahtuvaan immunovärjäämiseen (ks. tarkemmat yksityiskohdat kohdasta Materiaalit ja menetelmät ja Täydentävästä kuvasta 1). Sitten suoritimme seulan monoklonaalisilla vasta-aineilla, jotka oli kasvatettu soluseinän komponentteja vastaan (Complex Carbohydrate Research Center (CarboSource Services, Athens Georgia, Yhdysvallat) ja Paul Knox Cell Wall lab (Leedsin yliopisto, Yhdistynyt kuningaskunta), ks. tarkemmat tiedot Materiaalit ja menetelmät)) aivokuoren merkkiaineiden tunnistamiseksi. Testatuista 174 vasta-aineesta vain 12 todettiin oletettavasti kuorikerroksen spesifisiksi. Testasimme niiden toistettavuutta tekemällä kaksi lisäkoetta ja totesimme, että kahdeksalla vasta-aineella oli samanlaiset ja vahvat profiilit kolmessa toistossa (kuva 2). Viisi vasta-ainetta (JIM7, M14, M38, M130 ja M131) antoivat saman immunomerkintäkuvion aivokuoressa. Vain muut kuin vierekkäiset soluseinät leimattiin, mikä johti kaikkien aivokuoren solujen ainutlaatuiseen ”timantin muotoiseen” leimautumiseen. Kolmella muulla vasta-aineella (LM5, M133 ja M107) leimaus havaittiin aivokuoressa ja joskus sklerenkyymisoluissa, erityisesti LM5- ja M107-vasta-aineilla. Signaali oli homogeeninen aivokuoren soluseinämässä, mutta se oli paljon heikompi aivokuoren sisemmissä kerroksissa (endodermikerroksen viereinen aivokuoren kerros) kuin aivokuoren ulommissa kerroksissa. Näin ollen kaikki nämä vasta-aineet, joiden profiilit täydentävät kortikaalisia kudoksia, ovat spesifisiä merkkiaineita, joita voidaan käyttää kortikaalisten solujen identiteetin analysointiin. Lisäksi kaksi erilaista kortikaalista merkkiä, jotka määrittelevät kaksi subkortikaalista aluetta, viittaavat siihen, että ulommilla ja sisemmillä kerroksilla on erillinen molekulaarinen identiteetti, joka paljastui näiden vasta-aineiden avulla.
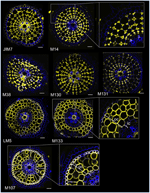
Kuva 2. Kahdeksan spesifisen kuorikerroksen vasta-aineen (JIM7, M14, M38, M130, M131, LM5, M133 ja M107) tunnistaminen monoklonaalisesta soluseinän vasta-ainekirjastosta seulotuista 174:stä. Kunkin vasta-aineen osalta saatiin yhdistetyt kuvat poikkileikkauksista konfokaalimikroskoopilla immunohistologisen leimauksen jälkeen: keltaisena vasta-ainekuvio 561 nm:ssä ja sinisenä soluseinän autofluoresenssi UV-valossa. Viidellä vasta-aineella (JIM7, M14, M38, M130 ja M131) on samanlainen profiili kaikissa värjätyissä kortikaalisissa solukerroksissa (timanttimuodot). Kolme vasta-ainetta (LM5, M133 ja M107) merkitsivät homogeenisesti kortikaaliset soluseinät. Huomaa, että näiden vasta-aineiden osalta sisäiset kortikaalikerrokset (ic) eivät ole värjäytyneet verrattuna ulkoisiin kortikaalikerroksiin (oc). Sisäkuvat ovat lähikuvia vastaavista kuvista. Palkit = 20 μm.
Joitakin näiden kahden subkortikaalisen kerroksen erityispiirteitä korostui, kun ImageJ-ohjelmiston (http://imagej.nih.gov/ij/) ”polar transformer” -lisäosaa käytettiin juurileikkeiden kuvien tarkasteluun (kuvat 1B,C; Schneider ym., 2012; Lartaud ym., 2014). Sisemmille soluille oli ominaista paksu soluseinämä verrattuna uloimpiin soluihin, joissa oli erilaisia soluseinän sulautumisesta johtuvia ilmaa sisältäviä onkaloita. Sisemmissä kuorisoluissa oli myös endodermisoluja muistuttava litteä muoto, toisin kuin ulommissa soluissa, jotka olivat pyöreämpiä. Tässä muunnetussa kuvassa säteittäinen soluseinämä, joka on solun sisäpuolelta ulkosivulle kulkeva seinämä, endodermisolujen ja eksodermisolujen autofluoresenssi ei ole näkyvissä, mikä johtuu oletettavasti Casparin nauhojen läsnäolosta. Vastaavasti, mutta vähäisemmässä määrin, autofluoresenssista vapautettuja pieniä reikiä näkyi myös sisäisten kortikaalisten solujen säteittäisissä soluseinissä.
Kaikki sivujuurityypit omaavat vain ulkokortikaalista kudosta
Todistaaksemme kuorimerkkiaineiden käyttökelpoisuuden ja luonnehtidaksemme solujen identiteettejä merkitsimme kolme riisin sivujuurityyppiä (L-LLR, T-LLR ja SLR) kolmella näistä vasta-aineista (M107, M133 ja M14). Koska L-LLR:t eivät useinkaan kehity Petrimaljoilla, tätä koetta varten sivujuuret kerättiin riisin taimista, joita kasvatettiin vesiviljelyolosuhteissa 2 viikon ajan. Analysoimme ensin kunkin sivujuurityypin pohjakudosorganisaatiota havainnoimalla soluseinien autofluoresenssia juurileikkeiden poikki- ja polaarikuvissa (kuva 3). Tämä ensimmäinen analyysi paljasti kolmen sivujuurityypin hieman erilaisen sisäisen säteittäisen anatomian. Samoin kuin UV-valossa tarkasteltujen sädekehäleikkeiden kohdalla endodermi- ja eksodermikudokset voidaan tunnistaa sädekehän soluseinien keskellä olevan fluoresenssin sammumisen perusteella. Näitä kahta kudosta oli kaikissa sivujuurissa. Endodermiksen ja eksodermiksen välissä L-LLR- ja T-LLR-juurissa oli useita kudoskerroksia, kun taas SLR-juurissa oli vain yksi (tunnistamaton) solukerros. L-LLR:ien anatomia muistutti siemenjuuria, ja endodermiksen ulkopuolella oli helposti tunnistettavissa useita kortikaalisia kudoskerroksia, kun aerenkyymejä oli muodostunut. Lisäksi havaittiin sklerenkymaalikerros, joka muodostui tiiviisti pakkautuneista soluista, joilla oli leveät soluseinät. Kokeesta riippuen tämä solukerros ei aina ollut täysin kehittynyt. T-LLR-leikkauksissa ulkoinen kerros muistutti kortikaalista kudosta ja sisäinen kerros muistutti yksittäistä (tunnistamatonta) SLR-kerrosta.
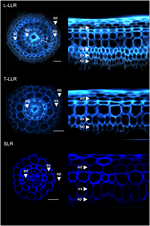
KUVA 3. T-LLR-leikkaukset. Suurten sivujuurityyppien (Large-LLR ja Thin-LLR) ja pienten sivujuurien (SLR) kudoskoostumus. Taimia kasvatettiin vesiviljelyolosuhteissa 2 viikon ajan. Soluseinän autofluoresenssi poikkileikkauksissa ja polaarinen muunnettu näkymä UV-valossa. Kudokset on merkitty seuraavasti: epidermis (ep), eksodermis (ex), cortex (c), endodermis (ed). Huomaa, että epidermis (ep) oli usein pirstoutunut kokeen aikana. Palkit = 20 μm.
Tunnistaaksemme SLR:n ja T-LLR:n pohjakudoksissa esiintyvät solukerrokset ja vahvistaaksemme L-LLR:n korteksi-identiteetin, immunovärjäsimme lateraalijuuren poikkileikkaukset kolmella korteksille spesifisellä vasta-aineella (M107, M133 ja M14; kuva 4). M107- ja M133-vasta-aineet merkitsivät kaikki endodermiksen ja eksodermiksen välissä sijaitsevat solukerrokset kaikissa sivujuurissa. Näiden vasta-aineiden radicle-värjäytymisen perusteella tämä havainto osoitti, että näillä solukerroksilla voi olla sklerenkyma- tai kortikaalinen identiteetti. Kuitenkin se, että M14 myös immunomerkitsi näitä kerroksia, erityisesti SLR-leikkauksissa, osoittaa selvästi, että näillä kerroksilla oli ulkokortikaalinen identiteetti.

Kuva 4. Yhdistetyt kuvat suurten sivujuurityyppien (Large-LLR ja Thin-LLR) ja pienten sivujuurten (SLR) leikkauksista, jotka on immunovärjätty M107:llä, M133:lla ja M14:llä. Taimia kasvatettiin vesiviljelyolosuhteissa 2 viikon ajan. Keltaisella vasta-ainemerkintä 561 nm:ssä ja sinisellä autofluoresenssi UV-valossa. Kudokset on merkitty seuraavasti: epidermis (ep), eksodermis (ex), cortex (c), endodermis (ed). Huomaa, että epidermis (ep) oli usein pirstoutunut kokeen aikana. Palkit = 20 μm.
Vaihtelut uloimpien kortikaalisten solukerrosten määrässä (yksi SLR:ssä, kaksi T-LLR:ssä, kolme L-LLR:ssä ja neljästä viiteen radikulaarissa) ovat tärkeässä roolissa riisin juuren läpimittaan (kuva 5).
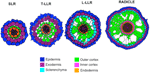
Kuva 5. Riisin juuren läpimitta. Sivujuuren ja sädekehän kudosten kaavamainen esitys.
Johtopäätökset
Kasvien subkortikaalisten alueiden määrittelyyn on jo käytetty erilaisia termejä. Esimerkiksi tässä tutkittuun verrattavan ”sisäisen” lignifioituneen kuorikerroksen esiintyminen on jo kuvattu luonnonvaraisessa riisissä (Yang ym., 2014). Maississa kaksi kortikaalista aluetta on määritelty eri tavalla (Baluška ym., 1993). ”Sisempi” domain muodostaa aerenkymää, joka vastaa tässä ulompaa kuorta, ja ”keski-ulompi” kuori on lignifioitunutta tukikudosta, joka voisi olla sklerenkyymiä. Arabidopsiksessa on kuvattu myös ”keskimmäinen cortex”-solukerros, joka sijaitsee kortikaalisen monokerroksen ja endodermiksen välissä (Baum et al., 2002; Paquette ja Benfey, 2005). Viimeaikaiset tulokset viittaavat siihen, että tällä kuorikerroksella, jonka muodostumista säätelevät muun muassa GA, oksidatiivinen stressi sekä SHR ja SCR, on rooli abioottisessa sietokyvyssä (Paquette ja Benfey, 2005; Cui ja Benfey, 2009; Pauluzzi ym., 2012; Wu ja Gallagher, 2014). Mielenkiintoista on, että tämä kerros on kuvattu myös spiraalimaiseksi kerrokseksi, jolla on tyypillinen muoto (Baum ym., 2002). Voisiko tämä Arabidopsiksen ”keskimmäinen kuorikerros” olla toiminnallisesti ja rakenteellisesti samanlainen kuin riisin sädekehän sisempi kuorikerros? Riisin pitkittäis- ja poikittaisleikkauksissa myös sisempi kuorikerros muodostaa yleensä kierteen, mikä viittaa siihen, että nämä kaksi kudoskerrosta voisivat olla vertailukelpoisia. Arabidopsiksessa ”keskimmäinen kuorikerros” on peräisin endodermiksen perikliinisestä jakautumisesta, joka ilmestyy poispäin QC:stä 7-14 päivän kuluttua itämisestä (Paquette ja Benfey, 2005). Uusia välineitä tarvitaan näiden tärkeiden parametrien todentamiseksi riisissä. Tähän mennessä ei esimerkiksi ole kuvattu yhtään mutanttia, joka vaikuttaisi tämän kerroksen muodostumisajankohtaan. Lisäksi tarvitaan teknistä edistystä riisin QC:n kuvantamisessa. Kuori-spesifiset merkkiaineemme tarjoavat kuitenkin uuden välineen, jonka avulla voidaan vertailla sisäisen kuoren (riisi) ja ”keskimmäisen kuoren” (Arabidopsis) muodostumiseen liittyvää toimintaa ja molekyyliverkostoa. Laboratoriossamme tehdään parhaillaan työtä sisäisen ja ulomman kuoren muodostumisen molekyylitekijöiden tunnistamiseksi, ja SCR- ja SHR-riisin ortologit ovat ensimmäisiä ehdokkaita kuoren muodostumisen säätelyyn riisin juurissa (Pauluzzi et al., 2012).
Materiaalit ja menetelmät
Kasviaineisto
Kuuden päivän ikäiset taimet
Oryza sativa L. ssp. japonica Nipponbare -lajikkeen siemeniä kasvatettiin pystysuoraan steriileissä Petri-maljoissa (Corning, 431301; 20 × 20 cm) kontrolloiduissa olosuhteissa (vuorokausirytmi: 12/12 h, 28/25 °C, valon voimakkuus: 500 μE m-2 s-1). Siemenet steriloitiin ensin huuhtelemalla 70-prosenttisessa etanolissa ~ 1 minuutin ajan. Tämän jälkeen etanoli korvattiin liuoksella, joka koostui 40-prosenttisesta valkaisuaineesta tislatussa vedessä, joka sisälsi kolme tippaa tween 80:tä (Sigma-Aldrich P4780-500 ml). Siemeniä liotettiin tässä liuoksessa 30 minuutin ajan kevyesti sekoittaen, minkä jälkeen ne huuhdeltiin vähintään neljä kertaa steriilillä tislatulla vedellä. Kuuma (~50 °C) autoklaavissa steriloitu puolivahva Murashige ja Skoog (MS/2) -alusta (250 ml) kaadetaan Petri-maljoihin ja annetaan jähmettyä ~45 minuuttia. Kiinteä MS/2-alusta koostuu 2,15 g.L-1 MS-alustan perussuolaseoksesta (Duchefa Biochemie, M0221), 75 mg.L-1 MS-vitamiiniseoksesta (Duchefa Biochemie, M0409) ja 8 g.L-1 agaroosia tyyppi II (Sigma-Aldrich, A6877). Steriilit siemenet työnnetään jähmettyneeseen MS/2-alustaan siten, että sädekehä on suunnattu alaspäin. Juuret kerättiin 6 päivän kasvun jälkeen.
Neljän viikon ikäiset kasvit
Kolmen päivän itämisen jälkeen vedessä taimet siirrettiin hydroponiseen järjestelmään kontrolloiduissa olosuhteissa (päivä/yö-rytmi: 12/12 h, 28/25 °C, valon voimakkuus: 500 μE m-2 s-1, suhteellinen kosteus: 55 %). Vesiviljelyjärjestelmä koostuu 50 litran muovilaatikosta, joka sisältää 30 litraa vesiviljelyliuosta ja jonka päälle on asetettu 1 cm:n paksuinen vaahtomuovipatja. Vaahtomuovipatjassa on aukkoja, jotta taimien varren tyvi säilyy. Hydroponinen väliaine koostuu seuraavista aineista: (NH4)2SO4 (0,5 mM), MgSO4.7H2O (1,6 mM), Ca(NO3)2.4H2O (1,2 mM), KNO3 (0,7 mM), FeSO4 (0,1 mM), Na2EDTA (0,1 mM), MnSO4. H2O (1,7 μM), (NH4)6Mo7O24.4H2O (0,2 μM), ZnSO4.7H2O (0,2 μM), CuSO4.5H2O (0,2 μM), H3BO3 (1,4 μM) ja KH2PO4 (0,6 mM). Liuosta ilmastetaan muovilaatikon pohjalle sijoitetulla pumpulla, ja se vaihdetaan 10 päivän välein. pH säädettiin ja pidettiin 5,4 ± 0,2:ssa.
Tuoreiden juurten leikkaaminen
Kasvavien radikaalien tai sivujuurten kärjet (2 cm) leikattiin terävällä terällä ja asetettiin samansuuntaisesti toistensa kanssa juurten kärkien kohdistamiseksi (täydentävät kuvat 1A,B). Ne upotettiin yhteen pisaraan 3-prosenttista sulatettua agaroosia (50 °C; täydentävä kuva 1C). Juurenkärkiä sisältävät laastarit asetettiin 3 × 1 × 1 cm:n kuoppaan, joka oli täytetty 3-prosenttisella sulatetulla agaroosilla (täydentävä kuva 1D). Jähmettymisen jälkeen lohkojen kokoa muutettiin ja ne liimattiin vibratomilevylle viipalointia varten. Vibratomin (Hm650v (Thermo Scientific Microm)) parametrit olivat nopeus 30, taajuus 70, amplitudi 0,8 ja paksuus 60 μm (täydentävä kuva 1E). Leikkeet siirrettiin joko kammioliuskoille (Lab-teak 177402) immunovärjäystä varten (Täydentävä kuva 1F) tai 1X-alkalifosfaattipuskurilla (PBS, Sigma-Aldrich P3813) kostutetuille liuskoille havainnointia varten.
Immunolokalisaatio
Kammioliuskoille asetettuja leikkeitä (kolme kammiota kohti) huuhdeltiin ensin 0,1 M glysiinillä, jota täydennettiin 1X PBS:llä, ja sitten kahdesti 1X PBS:llä, kumpikin 10 min ajan. Tämän jälkeen kudokset upotettiin PBS-liuokseen, joka sisälsi 5 % naudan sikiöseerumia (estoliuos, Thermo Fisher 37520), 4 °C:ssa yön yli sekoittaen. Ensisijaisia vasta-aineita, jotka oli laimennettu 1/10 tähän estoliuokseen, käytettiin yön yli 4 °C:ssa sekoittaen. Tämän jälkeen leikkeet huuhdeltiin 3 kertaa 1X PBS:ssä 10 minuutin ajan. Juurileikkeitä inkuboitiin 2 tuntia 500-kertaisesti estoliuokseen laimennetun sekundäärivasta-aineen kanssa sekoittaen. Nämä vasta-aineet oli kytketty fluoroforiin, Alexa 546 anti-rotan vasta-aineeseen (Invitrogen A11081) tai Alexa 546 antihiiren vasta-aineeseen (Invitrogen A11060). Tämän jälkeen leikkeet huuhdeltiin uudelleen kolme kertaa 1X PBS:ssä 10 minuutin ajan sekoittaen. Kammiot poistettiin ja lisättiin muutama tippa mowiol-kiinnitysainetta (Sigma-Aldrich 81381). Juurileikkeiden päälle asetettiin peitinlippa, jonka annettiin kuivua 36 tuntia 4 °C:ssa pimeässä.
Paraplastifiksaatio
Petrimaljoilla 6 päivän ajan kasvatetut juuret kiinnitettiin 4 %:ssa paraformaldehydissä (PBS 1X:ssä) yön yli 4 °C:ssa ja huuhdeltiin kahdesti PBS 1X:llä (Jackson, 1991). Kiinnitetyt kudokset dehydratoitiin etanolissa, puhdistettiin Histochoice Clearing Agentilla (HistoClear, Sigma Aldrich) ja upotettiin Paraplastiin (Fisher). Kudokset leikattiin (6 μm:n paksuudelta) Leica RM2255 -mikrotomilla ja kiinnitettiin SuperfrostPlus-levyille (Fisher).
Mikroskooppi
Kirkkauskenttä- ja autofluoresenssihavainnot tehtiin Leica DM4500 -mikroskoopilla. Autofluoresenssia varten kuvat otettiin A-suodatinkuutiolla (herätealue: UV; herätefiltteri: BP 340-380; suppressiosuodatin: LP 425). Immunovärjättyjä leikkeitä tarkasteltiin konfokaalimikroskoopilla: Zeiss LSM 510 tai Leica SP8. Soluseinät visualisoitiin ensin autofluoresenssilla . Toissijainen vasta-aine visualisoitiin käyttämällä Helium/Neon-laseria 543 tai 561 nm:ssä. Kuvat otettiin värikameralla Retiga 2000R (QIMAGING, Kanada), jossa käytettiin Volocity-kuvankeruuohjelmistoa (Improvision, Iso-Britannia).
Author Contributions
SH, FD, MB, CB: aineiston hankinta; SH, CP, AD aineiston analyysi; SH, EG, CP, AD: käsikirjoituksen laatiminen.
Erittely eturistiriidoista
Tekijät ilmoittavat, että tutkimus suoritettiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Kiitokset
Kiitämme MRI:tä (Montpellier RIO Imaging plateform), PHIV:tä ja La Gaillarde -levyjä teknisestä tuesta immunolokalisoinnissa ja / tai konfokaali- ja multifotonikuvantamisessa. SH:tä on tuettu CIRADin tohtorintutkintostipendillä.
Lisäaineisto
Tämän artikkelin lisäaineisto löytyy verkosta osoitteesta: https://www.frontiersin.org/article/10.3389/fpls.2015.01139
Lyhenteet
ae, aerenchyma; c, aivokuori; ed, endodermis; ep, epidermis; ex, exodermis; gt, pohjakudos; ic, sisempi aivokuori; L-LLR, Large-type Large Lateral Root; oc, outer cortex; sc, sclerenchyma; SLR, Small Lateral Root; st, stele; T-LLR, Thin-type Large Lateral Root; x, xylem.
Baluška, F., Brailsford, R. W., Hauskrecht, M., Jackson, M. B. ja Barlow, P. W. (1993). Soludimorfismi maissin juuren kuoressa: mikrotubulusten, etyleenin ja gibberelliinin osallistuminen solujen käyttäytymisen erilaistumiseen postmitoottisilla kasvuvyöhykkeillä. Bot. Acta 106, 394-403. doi: 10.1111/j.1438-8677.1993.tb00766.x
CrossRef Full Text | Google Scholar
Baum, S. F., Dubrovsky, J. G., and Rost, T. L. (2002). Kuoren ja verisuonisylinterin apikaalinen järjestäytyminen ja kypsyminen Arabidopsis thalianan (Brassicaceae) juurissa. Am. J. Bot. 89, 908-920. doi: 10.3732/ajb.89.6.908
PubMed Abstract | CrossRef Full Text | Google Scholar
Brundett, M. C., Enstone, D. E., and Peterson, C. A. (1988). Berberiini-aniliinisininen fluoresoiva värjäysmenetelmä kasvikudoksen suberiinille, ligniinille ja kalloosille. Protoplasma 146, 133-142. doi: 10.1007/BF01405922
CrossRef Full Text | Google Scholar
Coudert, Y., Périn, C., Courtois, B., Khong, N. G., and Gantet, P. (2010). Juurten kehityksen geneettinen ohjaus riisillä, malliviljalla. Trends Plant Sci. 15, 219-226. doi: 10.1016/j.tplants.2010.01.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., and Benfey, P. N. (2009). SCARECROWin, GA:n ja LIKE HETEROCHROMATIN PROTEIN 1:n välinen vuorovaikutus pohjakudoksen kuvioinnissa Arabidopsiksen juuressa. Plant J. 58, 1016-1027. doi: 10.1111/j.1365-313X.2009.03839.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Laurenzio, L., Wysocka-Diller, J., Malamy, J. E., Pysh, L., Helariutta, Y., Freshour, G., et al. (1996). SCARECROW-geeni säätelee epäsymmetristä solunjakautumista, joka on välttämätön Arabidopsis-juuren säteittäisen organisaation syntymiselle. Cell 86, 423-433. doi: 10.1016/S0092-8674(00)80115-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Gregory, P. J. (2006). Kasvien juuret: Growth, Activity, and Interaction with Soils. Oxford; Ames, IA: Blackwell Pub.
Google Scholar
Heidstra, R., Welch, D., and Scheres, B. (2004). Mosaiikkianalyysit, joissa käytetään merkittyjä aktivointi- ja deleetio-klooneja, erittelevät Arabidopsis SCARECROWin toimintaa epäsymmetrisessä solunjakautumisessa. Genes Dev. 18, 1964-1969. doi: 10.1101/gad.305504
PubMed Abstract | CrossRef Full Text | Google Scholar
Helariutta, Y., Fukaki, H., Wysocka-Diller, J., Nakajima, K., Jung, J., Sena, G., et al. (2000). SHORT-ROOT-geeni kontrolloi Arabidopsis-juuren radiaalista kuviointia radiaalisen signaloinnin kautta. Cell 101, 555-567. doi: 10.1016/S0092-8674(00)80865-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, C. F., Yamaji, N., Ono, K., and Ma, J. F. (2012). Leusiinirikkaan toiston reseptorin kaltainen kinaasigeeni osallistuu uloimpien solukerrosten spesifikaatioon riisin juurissa. Plant J. 69, 565-576. doi: 10.1111/j.1365-313X.2011.04824.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Jackson, D. (1991). ”In-situ-hybridisaatio kasveissa” in Molecular Plant Pathology: A Practical Approach, eds D. J. Bowles, M. McPherson, and S. J. Gurr (Totowa, NJ: Humana Press), 163-174.
Google Scholar
Justin, S. H. F. W., and Armstrong, W. (1991). Todisteet etyleenin osallistumisesta aerenkyymin muodostumiseen riisin (Oryza sativa L.) satunnaisjuurissa. New Phytol. 118, 49-62. doi: 10.1111/j.1469-8137.1991.tb00564.x
CrossRef Full Text | Google Scholar
Kamiya, N., Nagasaki, H., Morikami, A., Sato, Y. ja Matsuoka, M. (2003). Sellaisen riisin WUSCHEL-tyyppisen homeobox-geenin eristäminen ja karakterisointi, joka ilmentyy spesifisesti juuren apikaalisen meristemin hiljaisen keskuksen keskussoluissa. Plant J. 35, 429-441. doi: 10.1046/j.1365-313X.2003.01816.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kawai, M., Samarajeewa, P. K., Barrero, R. A., Nishiguchi, M. ja Uchimiya, H. (1998). Kortikaalisen solukuoleman hajoamismallin solututkimus riisijuurten aerenkyylin muodostumisen aikana. Planta 204, 277-287. doi: 10.1007/s004250050257
CrossRef Full Text | Google Scholar
Kawata, S., Sasaki, O., ja Yamazaki, K. (1977). Riisikasvien kruunujuuren ja sivujuuren rakenteesta ja niiden välisestä verisuoniyhteydestä. Jpn. J. Crop. Sci. 46, 569-579. doi: 10.1626/jcs.46.569
CrossRef Full Text | Google Scholar
Kawata, S., ja Shibayama, B. (1965). Sivujuuren alkuosien muodostumisesta riisikasvin latvajuurissa. Proc. Crop Sci. Soc. Jpn. 33, 423-431. doi: 10.1626/jcs.33.423
CrossRef Full Text | Google Scholar
Kono, Y., Igeta, M., ja Yamada, N. (1972). Tutkimuksia riisin siemenjuurten sivujuurten kehitysfysiologiasta. Jpn. J. Crop. Sci. 41, 192-204. doi: 10.1626/jcs.41.192
CrossRef Full Text
Lartaud, M., Perin, C., Courtois, B., Thomas, E., Henry, S., Bettembourg, M., et al. (2014). PHIV-RootCell: valvottu kuva-analyysityökalu riisin juuren anatomisten parametrien kvantifiointiin. Front. Plant Sci. 5:790. doi: 10.3389/fpls.2014.00790
PubMed Abstract | CrossRef Full Text | Google Scholar
Lux, A., Luxova, M., Abe, J., and Morita, S. (2004). Juurikuori: rakenteellinen ja toiminnallinen vaihtelu ja vasteet ympäristöstressiin. Root Res. 13, 117-131. doi: 10.3117/rootres.13.117
CrossRef Full Text | Google Scholar
Paquette, A. J., and Benfey, P. N. (2005). Juuren pohjakudoksen kypsymistä säätelevät gibberelliini ja SCARECROW ja se edellyttää SHORT-ROOT. Plant Physiol. 138, 636-640. doi: 10.1104/pp.104.058362
PubMed Abstract | CrossRef Full Text | Google Scholar
Pauluzzi, G., Divol, F., Puig, J., Guiderdoni, E., Dievart, A., and Périn, C. (2012). Surffailu pitkin juuren maakudoksen geeniverkostoa. Dev. Biol. 365, 14-22. doi: 10.1016/j.ydbio.2012.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Rebouillat, J., Dievart, A., Verdeil, J., Escoute, J., Giese, G., Breitler, J., et al. (2009). Riisin juurten kehityksen molekyyligenetiikka. Rice 2, 15-34. doi: 10.1007/s12284-008-9016-5
CrossRef Full Text | Google Scholar
Sabatini, S., Heidstra, R., Wildwater, M., and Scheres, B. (2003). SCARECROW osallistuu kantasolunicheen asemointiin Arabidopsiksen juuren meristemissä. Genes Dev. 17, 354-358. doi: 10.1101/gad.252503
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, C. A., Rasband, W. S., ja Eliceiri, K. W. (2012). NIH Image to ImageJ: 25 vuotta kuva-analyysia. Nat. Methods 9, 671-675. doi: 10.1038/nmeth.2089
PubMed Abstract | CrossRef Full Text | Google Scholar
Sugimoto, K., Jiao, Y., ja Meyerowitz, E. M. (2010). Arabidopsiksen uudistuminen useista kudoksista tapahtuu juuren kehityspolun kautta. Dev. Cell 18, 463-471. doi: 10.1016/j.devcel.2010.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Ten Hove, C. A., Willemsen, V., de Vries, W. J., Van Dijken, A., Scheres, B. ja Heidstra, R. (2010). SCHIZORIZA koodaa ydintekijää, joka säätelee kantasolujen jakautumisen epäsymmetriaa Arabidopsis-juuressa. Curr. Biol. 20, 452-457. doi: 10.1016/j.cub.2010.01.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., ja Gallagher, K. L. (2014). Ei-soluautonomisen transkriptiotekijän, SHORT-ROOTin, liikkuminen perustuu endomembraanijärjestelmään. Plant J. 80, 396-409. doi: 10.1111/tpj.12640
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, C., Zhang, X., Li, J., Bao, M., Ni, D. ja Seago, J. L. (2014). Villiriisin (Zizania latifolia Griseb.) juurten ja versojen anatomia ja histokemia. J. Bot. 2014, 9. doi: 10.1155/2014/181727
CrossRef Full Text | Google Scholar