Jokainen atomin elektroni voidaan yksilöidä yksiselitteisesti neljän kvanttiluvun avulla.

Vaikka niiden löytäminen vaati kehittynyttä matematiikkaa, ne ovat kaikki tavanomaisia lukuja:kolme niistä voi ottaa vain yksinkertaisia kokonaislukuarvoja; neljäs on yksinkertainen murtoluku.
Kolme ensimmäistä kvanttilukua syntyvät aaltofunktiosta Ψ, joka saadaan ratkaisemalla Schrödingerin yhtälö.
Neljäs kvanttiluku, elektronin spin, syntyy, kun havaittiin, että elektroneilla on kaksi mahdollista suuntaa.
Luvut ja niiden määritelmät ovat seuraavat:
Kvanttiluvut
| Kvanttiluku | Nimi | Mahdolliset arvot | Tieto |
|---|---|---|---|
| n | Pääkvanttiluku | 1, 2, 3,…, n | määrittelee elektronin miehittämän energiakuoren. Ydintä lähimpänä olevilla kuorilla on pienin n:n arvo ja pienin potentiaalienergia.n on ensimmäinen luku, joka kirjoitetaan elektronikonfiguraatioissa, kuten magnesiumin: 1s2 2s2 2p6 3s2 |
| l | orbitaalien kiertomomenttikvanttiluku (kutsutaan myös atsimutaaliseksi kvanttiluvuksi) |
0, 1, 2,…, (n-1) | määrittää energian alakuoren – systeemeissä, joissa on useampi kuin yksi elektroni, alakuorilla on eri energiat. l määrittelee alakuoren kirjaimen elektronikonfiguraatioissa. Esim: 1s2 2s2 2p6 3s2 l = 0 antaa s-alakuoren. l = 1 antaa p-alakuoren. l = 2 antaa d-alakuoren jne. |
| ml | magneettinen kvanttiluku | -l, (l+1), …, 0,…. , (l+1), l | Määrittää alakuoren orbitaalin suunnan. P-alakuorella, jossa l = 1, on kolme ml-arvoa: Nämä osoittavat, että p-orbitaaleja on olemassa kolme, eli orbitaalit px, py ja pz. D-alakuorella, jossa l = 2, on viisi ml-arvoa: -2, -1, 0, 1, 2.Nämä osoittavat, että d-orbitaaleja on olemassa viisi. |
| ms | Elektronin spin-kvanttiluku | -½ tai +½ | Elektroneilla on kaksi mahdollista spin-suuntaa. |
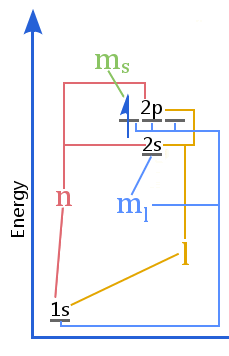
Energiatasokaavio osoittaa kvanttilukujen ja kuorien, alikuorien, orbitaalien ja elektronin spinin välisen suhteen atomissa.
Yksikään atomissa esiintyvistä elektroneista ei jaa samoja kvanttilukuja kaikilla neljällä.Jokainen elektroni voidaan yksilöidä yksiselitteisesti kvanttiluvullaan – ks. Paulin poissulkemisperiaate.
Orbitaalien muotoja eivät anna kvanttiluvut, vaan ne ovat todennäköisyystiheyksiä – kolmiulotteisia karttoja ytimen ympärillä olevasta tilasta, jossa elektroni 99 prosenttia ajasta on.Orbitaalien muodot saadaan aaltofunktion neliöstä Ψ2.Minkään elektronin tarkkaa sijaintia ja impulssia ei voida koskaan tietää – katso Heisenbergin epävarmuusperiaate.
