Exeleadissa lähestymme sopimusvalmistusta keskittymällä liposomaalisiin ja PEGyloituihin formulaatioihin harvinaisten sairauksien ja pienten tai heikossa asemassa olevien väestöryhmien hoitoon. Olemme erikoistuneet lipidipohjaisten, parenteraalisten lääkevalmisteiden kehittämiseen ja valmistukseen, ja tiimillämme on yli 20 vuoden kokemus työskentelystä monenlaisten prekliinisten, kliinisten ja kaupallisten sopimusvalmistusasiakkaiden kanssa.
Mitä liposomit ovat ja miten niitä käytetään lääkeaineiden annostelussa?
Liposomit ovat erikoistuneita annosteluvälineitä, jotka palvelevat useissa eri rooleissa vaikuttavien farmaseuttisten ainesosien ominaisuuksien parantamisessa. Ensinnäkin ne voivat suojata lääkeaineen elimistön immuunijärjestelmän havaitsemiselta jäljittelemällä biologisia kalvoja ja antamalla lääkkeelle enemmän aikaa saavuttaa aiottu määränpää. Toiseksi ne auttavat liuottamaan erittäin lipofiilisiä lääkemolekyylejä tai muokkaamaan lääkeaineen farmakokinetiikkaa ja biodistribuutiota, mikä auttaa minimoimaan sivuvaikutuksia ja parantamaan tuotteen turvallisuusprofiilia.
Liposomeilla on ainutlaatuinen vesikkelirakenne. Nämä vesikkelit koostuvat lipidikaksoiskerroksesta, joka muodostuu onton pallon muotoiseksi ja ympäröi vesifaasin. Sinänsä mikä tahansa kiinnostava lasti voidaan kapseloida liposomien sisään joko vesikomponenttiin (jos se on vesiliukoinen/hydrofiilinen) tai lipidikaksoiskerrokseen (jos se on rasvaliukoinen/lipofiilinen).
Joitakin ensisijaisia lipidejä, joita käytetään liposomien valmistukseen, ovat fosfolipidit ja sfingolipidit. Nämä kaksi lipidien ryhmää ovat ainutlaatuisia sen suhteen, että niillä on vettä rakastava/hydrofiilinen otsaryhmä ja vettä vihaava/lipofiilinen häntäryhmä. Amfifiilisen luonteensa vuoksi nämä molekyylit muodostavat spontaanisti itsestään liposomeja ja muita ainutlaatuisia 3D-rakenteita, kun ne lisätään vesiliuoksiin. 3D-rakenteiden muoto tai morfologia riippuu monista eri tekijöistä – esimerkiksi lipidien koostumuksesta, lämpötilasta, pH:sta tai muiden puskurien, suolojen ja sokerien läsnäolosta vedessä.

Kuvan lähde: Chem Libre Texts
Miten lääkeaine vuorovaikuttaa elimistön kanssa ja muuttuu käyttökelpoiseksi, kun se on muotoiltu liposomaaliseksi lääkevalmisteeksi?
Liposomit ovat viime vuosina herättäneet merkittävää huomiota luotettuna lääkeainejakeluvälineiden luokkana. Niiden itsestään suljetut rakenteet voivat kapseloida useita lääkeaineita kerralla ja suojata suljettua lastia hydrolyysiltä ja hajoamiselta. Lisäksi kohdentamalla proteiineja ja pinnan funktionaalisia ligandeja lipidikaksoiskerroksen ulkokuoreen voidaan lisätä uusia toimintoja, jotka mahdollistavat liposomien kohdennetun pääsyn soluihin joko vasta-aineiden tai reseptoriin kohdennettujen ligandien avulla. Nämä ligandit kiinnittyvät solureseptoreihin, joita yli-ilmentyy tietyissä sairaissa soluissa, jolloin lääkeaine pääsee solukalvon läpi.
”Liposomit suojaavat ladattuja lääkeainemolekyylejä ulkoiselta hajoamiselta, ja niiden samankaltaisuus biologisten kalvojen kanssa tarjoaa ainutlaatuisia mahdollisuuksia lääkeainemolekyylien kuljettamiseen soluihin tai solunsisäisiin osastoihin …”. Lisäksi liposomien erilaisia fysikaalis-kemiallisia ominaisuuksia – mukaan lukien niiden kokoa, varausta ja pinnan funktionaalisia ligandeja – voidaan muuttaa, mikä johtaa toiminnallisuuksiin, jotka suosivat tiettyjä lääkkeenjakelutehtäviä. Nämä edut ovat tehneet liposomeista johtavan lääkeannostelualustan, jolla on monenlaisia käyttötarkoituksia kliinisessä käytössä.”
– Liposomien kaltaiset nanorakenteet lääkeaineiden annosteluun | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Tyypillisesti liposomit valmistetaan steriileinä ruiskeina verenkiertoon annosteltaviksi, ja lääkeaine vapautuu, kun lipidikuoret hajoavat – mikä voi tapahtua solunulkoisessa tai solunsisäisessä ympäristössä.
Erilaisia strategioita on käytetty suunnittelemaan tavanomaisia liposomeja, joilla on laukaisevia vapautumisominaisuuksia ja jotka parantavat terapeuttista tehoa saamalla liposomit vapauttamaan kapseloidun vaikuttavan aineen tai ”lastin” ärsykevasteen perusteella. Vapautuminen tapahtuu joko liposomien tavanomaisen hajoamisen tai aktiivisten ärsykkeiden ja ympäristövihjeiden, kuten lämpöenergian, pH-gradientin ja leikkausjännityksen, vaikutuksesta.1
Solunsisäisessä ympäristössä tapahtuvaan vapautumiseen tarkoitetut formulaatiot voivat sisältää pH-herkkiä lipidejä, jotka muuttavat liposomaalirakennetta tai hajoavat happamissa lokeroissa, mikä mahdollistaa kapseloidun lääkeaineen vapautumisen. Vaihtoehtoisesti voidaan joskus sisällyttää lämpöherkkiä tai valoherkkiä komponentteja, jotka mahdollistavat hajoamisen ja rakenteen muokkaamisen lämpötilan muutosten tai tiettyjen aallonpituuksien valon vaikutuksesta.
Liposomien kaltaisia lääkeaineen kantajia voi olla monia eri lajikkeita, joilla on monenlaisia biokemiallisia ja biofysikaalisia ominaisuuksia. Vaikka tämä on edullista ja mahdollistaa näiden lipidipohjaisten hiukkasten käyttökelpoiset sovellukset sadoissa eri ympäristöissä, mahdollisten variaatioiden määrä tekee tiukan valmistuksen valvonnan välttämättömäksi.2
Exelead on valmistanut lipidipohjaisia lääkeaineita 1990-luvun alkupuolelta lähtien, aloittaen Abelcetilla. Abelcetin vaikuttava aine amfoterisiini B on pidetty lipidikompleksissa, ja se sulautuu valikoivasti sienikalvojen kanssa kohdistaen tautisolut.
Liposomit vs. lipidinanopartikkelit
Liposomit ja lipidinanopartikkelit (LNP:t) ovat rakenteeltaan samankaltaisia, mutta koostumukseltaan ja toiminnaltaan hieman erilaisia. Molemmat ovat lipidien nanoformulaatioita ja erinomaisia lääkkeenjakeluvälineitä, jotka kuljettavat kiinnostavaa lastia suojaavan, ulomman lipidikerroksen sisällä. Sovelluksessa LNP:t voivat kuitenkin olla monenlaisia.
LNP:t ovat liposomien kaltaisia rakenteita, jotka on erityisesti suunnattu kapseloimaan monenlaisia nukleiinihappoja (RNA ja DNA); ja sellaisenaan ne ovatkin suosituin ei-viraalinen geeninjakelujärjestelmä. Exelead kehittää ja valmistaa LNP:itä erilaisten geneettisten hyötykuormien, kuten siRNA:n, mRNA:n ja saRNA:n, kapseloimiseksi.
Traditionaalisiin liposomeihin kuuluu yksi tai useampi lipidikaksoiskerroksen rengas, joka ympäröi vesitaskua, mutta kaikilla LNP:illä ei ole yhtenäistä kaksoiskerrosta, joka luokittelisi ne lipidivesikooleiksi tai liposomeiksi. Jotkin LNP:t omaksuvat mikkelin kaltaisen rakenteen, joka kapseloi lääkeainemolekyylit muuhun kuin vesipitoiseen ytimeen.
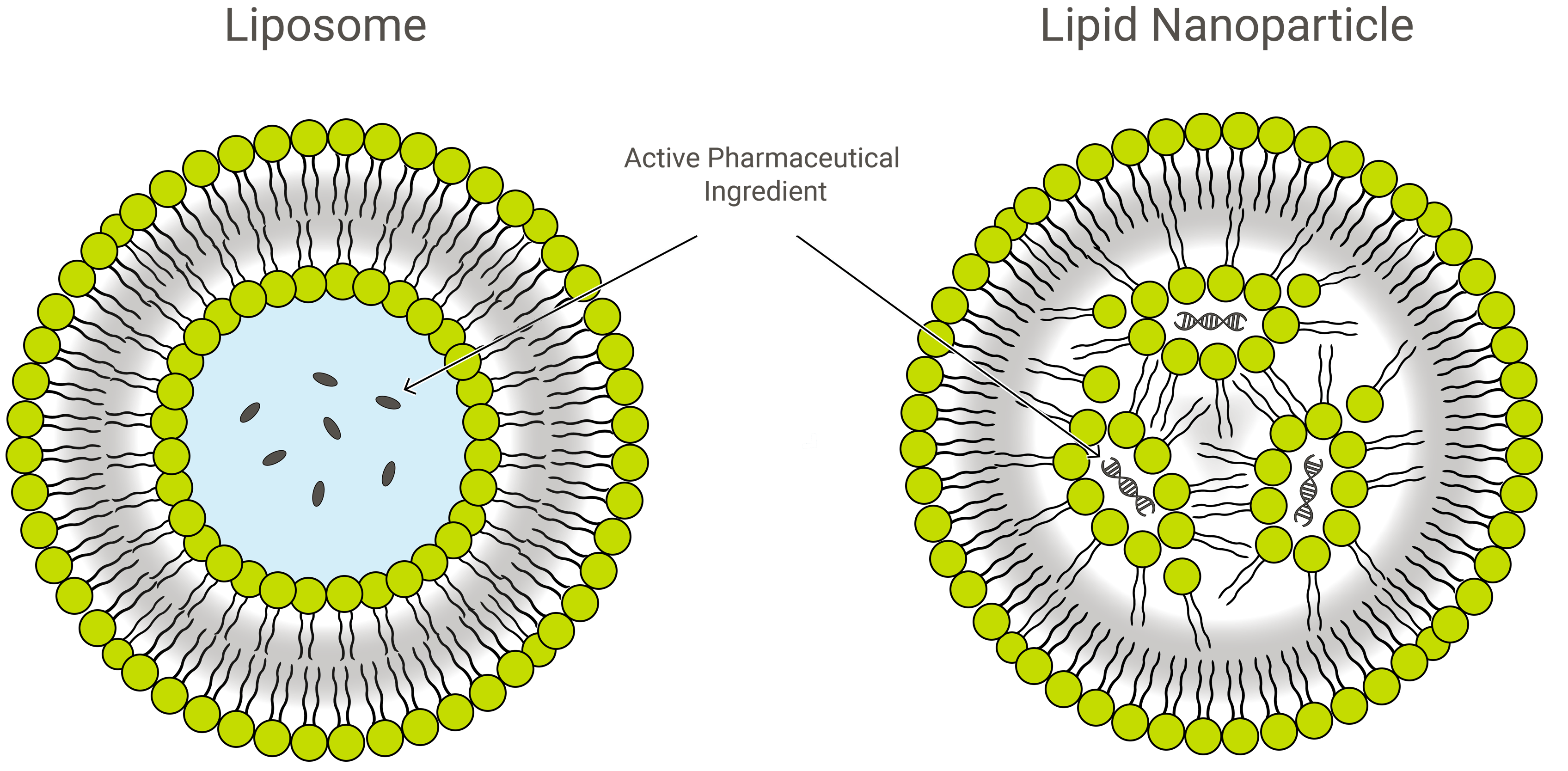
LNP:iden ja liposomien kaltaisten lääkeaineannostelurakenteidenPEGylointi
LNP:t koostuvat pääasiassa kationisista lipideistä (ks. geeniterapia jäljempänä) yhdessä muiden lipidien kanssa. Näihin kuuluvat tyypillisesti neutraalit fosfolipidimolekyylit, jotka kuuluvat fosfatidyylikoliinin (PC) luokkaan, ja sterolit, kuten kolesteroli. Toinen yleinen lipidien ainesosa on niin sanottu PEGyloitu fosfolipidi- polyetyleeniglykoli (PEG) polymeeri, joka on kovalenttisesti kiinnittynyt fosfolipidin pääryhmään.

PEGyloituja fosfolipidejä käytetään monissa lipidipohjaisissa lääkeaineenkantajissa ensisijaisesti sen vuoksi, että ne tarjoavat niin sanotun häivytystehon lääkevalmisteen kiertäessä elimistössä. Ihmisen immuunijärjestelmä pyrkii suojaamaan elimistöä kaikilta vierailta esineiltä, eivätkä lääkkeelliset nanohiukkaset ole poikkeus. Jotta lääkeainetta voitaisiin toimittaa tehokkaammin ja jotta rahtimolekyylit pääsisivät pidemmän ajan kuluessa kiertoon aiottuihin sairauspaikkoihin, PEG lisätään suojaamaan näitä nanohiukkasia estämällä veriplasman proteiineja imeytymästä liposomin pintaan, mikä pidentää verenkierron kestoa.1
PEGyloinnin toinen hyöty on liposomin kaltaisten nanorakenteiden vakauden lisääminen. Tavanomaiset liposomit, erityisesti alle 200 nm:n kokoiset liposomit, voivat olla itsessään epävakaita ja niillä on taipumus sulautua toisiinsa pintajännityksen vähentämiseksi. Tämä voi johtaa kapseloidun lääkeaineen häviämiseen tai eri vesikkelien lastin epäsuotuisaan sekoittumiseen. Yksi tapa, jolla lääkevalmistajat ovat oppineet ratkaisemaan tämän ongelman, on liposomien ulkopinnan peittäminen polymeereillä, kuten PEG:llä.
Näillä häivähdyksillä varustetuilla nanohiukkasilla on saatu aikaan uuden sukupolven liposomaalisia formulaatioita ja useita kliinisesti hyväksyttyjä tuotteita. PEG-yloidut liposomit ja LNP:t ovat tällä hetkellä useimpien syöpähoitojen uusi paradigma.
LNP:t geeniterapiassa
Pitkän aikaa tehokkain tapa toimittaa geenipohjaisia terapeuttisia aineita ihmissoluihin oli käyttää virusta, joka oli muunnettu kuljettamaan lääkkeellistä lastia haitallisten, itseään monistavien geenien sijasta. Tätä menetelmää käytetään satunnaisesti vielä nykyäänkin, ja siitä käytetään nimitystä virusgeenien toimittaminen. Muiden kuin virusperäisten geenien toimittamisesta on kuitenkin tullut suosittua viimeisten 20 vuoden aikana paremman turvallisuusprofiilin, vähäisempien immunogeenisten haittavaikutusten ja valmistuksen helppouden vuoksi. Yksi tämän liikkeen tärkeimmistä vetureista on ollut lipidi- ja polymeeripohjaisten kantajien kehittäminen, joista LNP:t ovat suosituimpia.
Geenien levittämiseen käytettävät LNP:t syntetisoidaan ensisijaisesti käyttämällä kationisia eli positiivisesti varattuja lipidejä, jotka assosioituvat anionisten eli negatiivisesti varattujen nukleiinihappojen kanssa. Myös muita lipidipohjaisia komponentteja voidaan lisätä geneettisen lastin toimitustehokkuuden ja vapautumispaikan muokkaamiseksi. LNP:t tarjoavat myös mekaanista vakautta, hallittua morfologiaa ja kapeaa kokojakaumaa.1
Epäorgaanisia materiaaleja, orgaanisia materiaaleja ja hydrogeelejä on tutkittu liposomaalisten nanohiukkasten ytimiksi, jotka on kapseloitu vaihtelevan määrän kuoren muodostavien lipidikerrosten sisään. Yksi näiden hybridi-nanohiukkasten onnistuneimmista variaatioista sisältää PLA- tai PGLA-polymeerejä lipidimonokerroksen sisällä. Nämä kaksi keskeistä biopolymeeriä ovat erityisen käyttökelpoisia lääkeainejakelussa, koska ne helpottavat hallittua lääkeaineen vapautumista.1

Yllä esitetty nanohiukkasformulaatio on lipidipolymeerihybridi, jossa on hydrofobinen PGLA-ydin ja hydrofiilinen lipidipEG-kuori.
Laajeneva ala
”Liposomit ovat kulkeneet pitkän matkan tullakseen validoitujen lääkeaineen kuljettajien luokaksi … Kehitteillä on yhä enemmän erilaisia liposomin kaltaisia nanorakenteita, joilla kullakin on ainutlaatuiset vahvuudet, jotka soveltuvat tiettyihin lääkeaineen kuljetustehtäviin. Samalla näiden nanorakenteiden ja biologisten järjestelmien välisten vuorovaikutusten ymmärtäminen edistyy nopeasti. Niiden kiertoajasta, kudoksiin kertymisestä ja mahdollisesta myrkyllisyydestä on saatu huomattava määrä tietoa. Nämä rakenteet tarjoavat ainutlaatuisen, luonnostaan vakaan, solun kaltaisen morfologian nanolääkkeille, ja ne ovat valmiita etenemään kohti kehittyneempiä terapeuttisia strategioita. Exelead tarttuu tällaisiin haasteisiin, mukaan lukien sellaisten nanogeelien kehittäminen, jotka sisältävät joukon biologisia aineita ja pieniä molekyylejä.
Siinä aikana, kun liposomeja ehdotettiin ensimmäisen kerran lääkeaineiden jakelujärjestelmäksi 1960-luvun lopulla, on syntynyt rakenteen ja toiminnallisuuden variaatioita, jotka ovat tarjonneet arvokkaita edistysaskeleita tautien kohdentamisessa. LNP-lääkkeitä on ilmestynyt koko lääketeollisuuteen terapioina, jotka on suunniteltu syöpälääkkeiden, antibioottien, geenilääkkeiden, anestesia-aineiden ja tulehduskipulääkkeiden toimittamiseen.3
”Kliinisissä sovelluksissa liposomaaliset lääkeaineet ovat osoittautuneet käyttökelpoisimmiksi, koska ne kykenevät ”passiivisesti” kertymään kohtiin, joissa verisuonten läpäisevyys on lisääntynyt, kun niiden keskimääräinen halkaisija on ultrasuodatettavalla alueella (halkaisijaltaan <200 nm), ja koska ne kykenevät vähentämään kapseloitujen lääkeaineiden sivuvaikutuksia suhteessa vapaisiin lääkeaineisiin. Tämä on johtanut terapeuttisen indeksin yleiseen kasvuun, joka mittaa tehoa toksisuuden sijaan.”
– Liposomaaliset lääkeannostelujärjestelmät: konseptista kliinisiin sovelluksiin | Allen TM, Cullis PR 3
Sovellukset yksilöllistettyyn lääketiede – terapeuttisten strategioiden uusi aikakausi
Kontrastissa perinteisiin, suurten lääketehtaiden lähestymistapoihin sairauksien hoidossa yksilöllistetyssä lääketiede-käsittelyssä otetaan huomioon yksilölliset erot elintavoissa, ympäristössä ja biologiassa – mukaan lukien potilaan genetiikka.
Tämä on erittäin käyttökelpoinen syövän kaltaisissa sairauksissa. Jopa saman syöpätyypin sisällä kasvaintyypit eroavat toisistaan eri potilailla, ja ymmärtämällä potilaan kehittämä erityinen geneettinen mutaatio lääkärit voivat käyttää tarkempia ja täsmällisempiä hoitoja.4
Personalisoitujen geneettisten hoitojen myötä lääkärit ja tiedemiehet voivat tehokkaasti räätälöidä vaikuttavan lääkeaineen – usein RNA:n tai DNA:n – tietyn potilaan tai pienen potilasryhmän sairausprofiilin mukaiseksi. Tämä lähestymistapa hyperspesifiseen sairauden kohdentamiseen lisää tehoa ja vähentää ei-toivottuja sivuvaikutuksia samankaltaisten potilasryhmien kohdalla.
LNP:t oligonukleotidien levityskanavina
Koska niin suuri osa kasvavasta yksilöllistetyn lääketieteen alasta keskittyy geneettisiin hoitomuotoihin, LNP:t ovat tulleet erityisen hyödyllisiksi lääkkeiden levitysalustoina. Mikä tahansa oligonukleotidi voitaisiin teoriassa kapseloida liposomin tai LNP:n sisään, mutta siRNA on tällä hetkellä yleisin lasti tämäntyyppisissä lääkevalmisteissa.
Teoriassa siRNA:n segmentit voidaan suunnitella vaimentamaan mikä tahansa geeni, mikä on jännittävä käsite sekä lääkäreille että tutkijoille. Valitettavasti vapaan, kapseloimattoman RNA:n toimittaminen ihmissoluihin on vaikeaa, koska ne ovat suuria, epävakaita seerumissa ja alttiita nukleaasien hajoamiselle.5
Tutkijat ovat yrittäneet vakauttaa siRNA:ta seerumissa lisäämällä siihen fosforotiolaattisidoksia, mutta geenien tehokkaaseen vaimentamiseen ihmisessä tarvitaan suuria annoksia. LNP:t ovat tarjonneet ratkaisun tähän ongelmaan tarjoamalla joustavan ja helpon kapselointikeinon, joka suojaa siRNA-segmenttejä, kunnes ne saavuttavat aiotun määränpäänsä, ja helpottaa niiden kuljettamista kohdesoluihin.5
”Ionisoituvia kationisia lipidejä sisältävillä LNP:illä on useita ominaisuuksia, jotka ovat välttämättömiä polynukleiinihappojen systeemisessä kuljettamisessa, mukaan luettuina pienet koot, seerumin stabiilisuus, alhaiset pinnan zeta-potentiaalit fysiologisessa pH-arvossa ja kationinen lataus happamissa pH:n arvoissakaan (esim. endosomeissa). Lisäksi hyödyntämällä ”endogeenisia” kohdentumisprosesseja, jotka johtuvat assosiaatiosta ApoE:hen annostelun jälkeen, voidaan saavuttaa erittäin tehokas imeytyminen hepatosyytteihin i.v.-annostelun jälkeen, mikä johtaa erinomaisiin geenien vaimentamisominaisuuksiin.”
– Lipidi-nanopartikkelien jakelujärjestelmät siRNA-pohjaisille terapeuteille | Wan C, Allen TM, Cullis PR 5
Pienemmät eräkoot
Personalisoidut lääkevalmisteet valmistetaan usein pienissä eräkokoluokissa yksittäisille potilaille tai pienille populaatioille, ja lopputuloksena on usein alle litra tuotetta. Sitä vastoin tavanomaisten lääkkeiden perinteiset valmistuserät tuottavat usein tuhansia litroja lääketuotteita mittakaavassa. Yksilöllistetty lääketiede edellyttää ainutlaatuista lähestymistapaa, ja jokainen erä on valmistettava tiukoissa cGMP-olosuhteissa.
Kun yksilöllistetty lääketiede on noussut merkittäväksi painopisteeksi lääkekehityksessä, monet lääkkeiden valmistusteollisuuden yritykset ovat mukauttaneet putkilinjojaan siten, että ne pystyvät valmistamaan pienempiä potilasryhmille tarkoitettuja pienempiä lääke-eriä perinteisen suuren mittakaavan lääkkeiden valmistuksen lisäksi.
Exeleadissa on panostettu laajasti näille pienissä erissä valmistetuille terapia-ainevalmisteille, jotka vaativat usein kalliita vaikuttavia aineita (API-valmisteita) ja nopeita läpimenoajat. Potilas- tai antigeenispesifiset lääkkeet eivät jätä paljon aikaa siitä hetkestä, kun oligonukleotidi sekvensoidaan, siihen hetkeen, kun tuote on muotoiltava meillä. Nämä lyhytaikaiset ennusteet, joskus vain kuusi viikkoa, asettavat haasteita, jotka olemme pystyneet voittamaan hiomalla nykyisiä järjestelmiämme ja ottamalla käyttöön innovatiivisia formulointitekniikoita.
Laajasti levinneet sovellukset
Vaikka yksilöllistetyllä lääkkeellä on potentiaalia hoitaa melkein mitä tahansa tautia, tämänhetkisessä tutkimuksessa on keskitytty ensisijaisesti seuraaviin aihepiireihin: 1) immunoterapiat, 2) tavanomaiset lääkehoidot, joita on täydennetty farmakogenomiikan avulla, ja 3) biomarkkereihin liittyvät syöpähoidot. Liposomeja ja LNP:itä voidaan soveltaa kaikkien näiden lääkeryhmien jakelukanavina, mikä tekee niistä korvaamattoman voimavaran tällä lääkekehityksen uudella alalla.

Viiteartikkelit
- Gao W, Hu C-MJ, Fang RH, Zhang L. Liposome-like Nanostructures for Drug Delivery. Journal of materials chemistry B, Materials for biology and medicine. 2013;1(48):10.1039/C3TB21238F. doi:10.1039/C3TB21238F.
- Kraft JC, Freeling JP, Wang Z, Ho RJY. Liposomi- ja lipidi-nanohiukkas-lääkejakelujärjestelmien kehittyvät tutkimus- ja kliiniset kehityssuuntaukset. Journal of pharmaceutical sciences. 2014;103(1):29-52. doi:10.1002/jps.23773.
- Theresa M. Allen, Pieter R. Cullis. Liposomaaliset lääkeannostelujärjestelmät: Konseptista kliinisiin sovelluksiin. Advanced Drug Delivery Reviews. 2013 Jan;65(1):36-48
- Esposito L. What Does Personalized Medicine Really Mean? US News: Health Care. 2018 Jan;
- Wan C, Allen TM, Cullis PR. Lipidi-nanohiukkasten toimitusjärjestelmät siRNA-pohjaisille terapeuteille. Drug Deliv Transl Res. 2014 Feb;4(1):74-83. doi: 10.1007/s13346-013-0161-z.
- Vogenberg FR, Isaacson Barash C, Pursel M. Personalized Medicine: Part 1: Evolution and Development into Theranostics. Pharmacy and Therapeutics. 2010;35(10):560-576.