Introduction
Hepatiitti B -virusinfektio (HBV-infektio) on yleisin maksakirroosin ja hepatosellulaarisen karsinooman aiheuttaja suurimmassa osassa Aasiaa.1,2 Kroonisen hepatiitin patogeneesi välittyy isännän immuunireaktion ja HBV-antigeenejä esittelevien hepatosyyttien vuorovaikutuksesta.3,4 Aikaisemmat tutkimukset ovat osoittaneet, että HBV-antigeenien ilmentyminen hepatosyyteissä on tärkeässä yhteydessä kroonisen maksasairauden vaiheeseen ja aktiivisuuteen. Immuunitoleranssivaiheessa hepatiitti B:n ydinantigeenejä (HBcAg) esiintyy enimmäkseen ytimessä ja ne korreloivat HBV:n replikaation kanssa, kun taas sitä seuraavassa immuunipuhdistusvaiheessa tapahtuu HBcAg:n maksansisäinen siirtyminen ytimestä sytoplasmaan, ja se liittyy kroonisen hepatiitin histologiseen aktiivisuuteen5,6. Maksan sisäisen hepatiitti B:n pinta-antigeenin (HBsAg) ilmentymistapauksissa on raportoitu kolmea mallia – homogeenista tyyppiä, tyypin I maasälpähepatosyyttiä (GGH) ja tyypin II GGH:ta. Ryhmittäin, erillisinä tai haaleina esiintyviä homogeenisia malleja on havaittu potilailla, joilla on korkea viremia tai aktiivinen hepatiitti. Tyypin I GGH:t ovat tyypillisesti hajallaan yksittäisinä maksalohkoissa, joissa on inkluusion kaltainen tiheä homogeeninen ilmentymä, kun taas tyypin II GGH:t ilmentävät pinta-antigeeneja hepatosyyttien periferiassa, jotka ryhmittyvät ryhmiin, ja niitä esiintyy yleensä matalan replikaatiovaiheen aikana, ja ne yleistyvät aktiivisesta hepatiitista maksakirroosiin ja hepatosellulaariseen karsinoomaan.7-10 Näin ollen sekä maksan sisäiset HBcAg- että HBsAg-ekspressiot liittyvät läheisesti infektion luonnolliseen kulkuun ja HBV:n replikaatioon.
Kroonisen B-hepatiitin vaiheista immuunipuhdistusvaihetta tai HBeAg-positiivista kroonista B-hepatiittia esiintyi usein nuoremmissa väestöryhmissä, niillä oli vähemmän vakavia histologisia aktiviteetteja ja niissä esiintyi vähemmän precore A1896 -mutaatioita ja basaalisen ytimen promoottorin (basal core promoottori, BCP) T1762/A1764 -mutaatioita kuin HBeAg-negatiivisessa kroonisessa B-hepatiitissa.11-14 Kroonisen B-hepatiitin kulku on dynaaminen, mikä johtuu viruksen replikaation ja isännän immuunijärjestelmän vuorovaikutuksesta. Tämän vuoksi HBeAg-positiivisilla potilailla havaitaan yleisesti kliinisten piirteiden tai histologisen toiminnan monimuotoisuutta. Esimerkiksi 34-55 %:lla potilaista on maksan histologiassa siltaavaa fibroosia tai kirroosia, kun taas lopuilla potilailla on lievä fibroosi.15,16 HBsAg:n kertymisen hepatosyytteihin on osoitettu liittyvän tiettyihin virusmutaatioihin ja olevan yhteydessä taudin aktiivisuuteen.8,9 On mielenkiintoista tutkia maksansisäisen HBsAg:n ilmentymisen ominaispiirteitä potilailla, joilla on erilainen maksan histologian vaikeusaste.
Virusmutantit ovat tavallisesti kehittyneet isäntäväen immuunivalvonnan painostuksesta. Luonnossa esiintyvistä HBV-mutaatioista BCP T1762/A1764-mutaatiot yleistyivät taudin edetessä, ja niiden on usein todettu liittyvän pitkälle edenneeseen maksasairauteen ja hepatosellulaariseen karsinoomaan.17,18,18 Myös maksansisäisen HBsAg:n ilmentymismallit muuttuivat kroonisen hepatiitti B:n luonnollisen kulun aikana. BCP T1762/A1764 -mutaatioiden ja maksansisäisen HBsAg:n ilmentymisen yhteyttä ei vielä tunneta, ja sitä on vielä tutkittava.
Tämän vuoksi tämän tutkimuksen tavoitteena oli arvioida maksansisäisen HBsAg-ekspression piirteitä ja analysoida yhteyttä maksan histologiaan, viruksen replikaatiomarkkereihin ja HBV-mutaatioihin HBeAg-positiivisessa kroonisessa B-hepatiitissa.
Aineisto ja menetelmätPotilaat
Tutkimukseen otettiin retrospektiivisesti 181 hoitoa saanutta HBeAg-positiivista (HBeAg-positiivista) hepatiitti B:n eAntigeeniä (hepatiitti B e antigeeniä) käyttävää potilasta, jotka täyttivät sisäänottoperusteet. Sisäänottokriteerit olivat ikä yli 18 vuotta ja alle 70 vuotta, seerumin HBsAg-positiivisuus yli 6 kuukauden ajan ja seerumin HBV-DNA-taso ≥ 100 000 kopiota/ml, poikkeava seerumin alaniiniaminotransferaasitaso, ei muuta selitettävää kroonisen hepatiitin etiologiaa, mukaan lukien alkoholi, autoimmuunihepatiitti tai C-hepatiittiviruksen, D-hepatiittiviruksen tai ihmisen immuunikatovirusinfektion merkkiaineet, eikä HBV:n vastaista hoitoa ole ollut ja histologista arviointia varten ei ole käytettävissä maksabiopsianäytettä. Kaikkien potilaiden seerumista ja maksabiopsiasta otettiin näytteet ennen antiviraalisia hoitoja, ja näytteet säilytettiin -70 oC:ssa testaukseen asti. Tämä tutkimus hyväksyttiin National Cheng Kungin yliopistollisen sairaalan institutionaalisessa arviointilautakunnassa (nro: ER-99-398). Tutkimukseen saatiin tietoinen suostumus Helsingin julistuksen mukaisesti.
HBV-virologiset määritykset
HBV-genotyypin määritys tehtiin multiplex-polymeraasiketjureaktiolla, kuten muualla on kuvattu.19 Seerumin HBV-DNA-taso mitattiin COBAS Amplicor HBV Monitor -testillä (COBAS-AM assay, Roche Diagnostics, Branchburg, NJ). Seerumin HBsAg-taso kvantifioitiin Abbott Architect HB-sAg QT -testillä (Abbott Diagnostics, Rungis, Ranska), jonka dynaaminen alue on 0,05-250,0 IU/ml. Näytteet, joiden HBsAg-taso oli > 250 IU/ml, testattiin uudelleen laimennoksilla 1:20 ja 1:1000.
Polymeraasiketjureaktio ja precore- ja BCP-alueiden sekvensointi
HBV-DNA uutettiin 50 μl:stä seerumia käyttäen Blood and Tissue Genomic Mini Kit -pakettia (VIOGENE, Taipei, Taiwan). Ensimmäisen kierroksen PCR suoritettiin seuraavissa olosuhteissa: 96 oC 2 minuutin ajan, 94 oC 1 minuutin ajan, 54 oC 1 minuutin ajan ja 72 oC 2 minuutin ajan alukkeilla 5′-ACCTCTCTGCACGTAGTAGCATGG (eteenpäin) ja 3′-GGATTAAAGACAGGTACAGTAGAAG (taaksepäin). Toinen PCR-kierros suoritettiin samoissa olosuhteissa alukkeilla 5′-ATGTCAACGACCGACCGACCTTGA (eteenpäin) ja 3′-TTCCCACCTTATGAGTCTCCAAG (taaksepäin). Puhdistetut PCR-tuotteet sekvensoitiin sen jälkeen suoraan käyttäen automatisoitua DNA-sekvensseri ABI 310:tä ja ABI PRISM Big Dye Terminator Cycle Sequencing Ready Reaction Kit -reaktiosarjaa (Applied Biosystems), jossa käytettiin toisen kierroksen PCR:ssä käytettyä eteenpäin suuntautuvaa aluketta.
Maksan histologia
Maksan histologian arvioi yksi ainoa patologi, joka ei ollut tietoinen potilaiden taustoista. Nekroinflammaatio ja fibroosi arvioitiin Knodellin nekroinflammaatioasteen (vaihteluväli 0-18)20 ja Ishakin fibroosivaiheen (vaihteluväli 0-6)21 perusteella.
Immunohistokemialliset värjäykset tehtiin muualla kuvatulla tavalla.22 Lyhyesti sanottuna deparafinoidut 5 μm:n paksuiset leikkeet inkuboitiin monoklonaalisella hiiren anti-HBsAg:lla (klooni 3E7, Dako Corp., Carpinteria,USA) ja anti-HBcAg:lla (Novocastra Laboratories, Newcastle, Iso-Britannia) yön yli 4 °C:ssa. Anti-HBsAg:n tai anti-HBcAg:n optimaalinen laimennus määritettiin käyttämällä HBV-kantajan maksakudosta positiivisena kontrollina. Syntyneen immuunikompleksin havaitsemiseen käytettiin StrAviGen Super Sensitive MultiLink Kitiä (BioGenex). Peroksidaasiaktiivisuus visualisoitiin aminoetyylikarbatsolisubstraattisarjalla (Zymed Laboratory, Inc, San Francisco, CA). Lopuksi leikkeet vastavärjättiin hematoksyliinillä. Negatiivisena kontrollina primaarivasta-aine korvattiin inkubaatiossa hiiren immunoglobuliinilla, joka ei ollut immuuni. HBcAg:n ilmentymismallit tumaan, sytoplasmaan tai molempiin kirjattiin. HBsAg:n ilmentymismallit luokiteltiin homogeeniseksi, tyypin I GGH:ksi ja tyypin II GGH:ksi.22 Homogeenisesti värjäytyneet hepatosyytit luokiteltiin hepatosyyteiksi, joissa oli kohtalainen tai voimakas homogeeninen sytoplasmavärjäytyminen; tyypin I GGH:t luokiteltiin hepatosyyteiksi, joissa oli tiheä globulaarinen tai ”inkluusion kaltainen” värjäytyminen; tyypin II GGH:t luokiteltiin hepatosyyteiksi, joissa oli pinta-antigeenin värjäytyminen solun reuna-alueilla tai periferiatyypissä.6, 22 Tyypin I GGH:t hajaantuvat yksittäin tai ryhmittyvät maksalohkoihin, kun taas tyypin II GGH:t ryhmittyvät johdonmukaisesti kyhmyihin. HBcAg:n ja HBsAg:n ilmentymistasot pisteytettiin puolikvantitatiivisesti immunovärjättyjen solujen osuuden mukaan asteikolla 0-4+, mikä vastaa positiivisuutta 0, 1-10, 11-25, 25-50 % ja yli 50 %:ssa tutkituista hepatosyyteistä.
Statistiset analyysit
Tiedot ilmaistiin keskiarvona ± keskihajonta. Jatkuvia muuttujia verrattiin Mann-Whitneyn U-testillä tai Kruskal-Wallisin ANOVA:lla yksimuuttuja-analyysissä. Kategoriset muuttujat analysoitiin käyttämällä χ2-testiä tai Fisherin tarkkaa testiä. Riippumattomat tekijät, jotka olivat yhteydessä maksansisäisen HBsAg-ekspression tasoihin, toteutettiin käyttämällä monimuuttujaista logistista regressioanalyysiä. Tietojen käsittely ja tilastolliset analyysit suoritettiin SPSS-ohjelmiston Windows-versiolla 17.0 (SPSS Inc., Chicago, IL).
TuloksetOsallistuneiden potilaiden ominaisuudet
Taulukossa 1 luetellaan 181 osallistuneen potilaan demografiset ominaisuudet. Suurin osa potilaista oli miehiä (69,1 %), ja 63,0 %:lla heistä oli HBV-genotyyppi C. Precore A1896 -mutaatio havaittiin 20 potilaalla (11,0 %) ja BCP T1762/A1764 -mutaatio 38 potilaalla (21,0 %). Positiivinen HB-sAg-värjäys todettiin 181 potilaasta 105 potilaalla (58,0 %). Potilailla, joilla oli HBsAg-värjäytyminen, oli merkitsevästi korkeampi seerumin HBsAg-arvo (P
181 potilaan kliiniset, virologiset ja histologiset ominaisuudet.
| Ominaispiirteet | arvo | ||||
|---|---|---|---|---|---|
| HBsAg-ekspressio | P-arvo | ||||
| Kaikki potilaat (n = 181) | Negatiiviset (n = 76) | Positiiviset (n = 105) | |||
| Aika (v) ± SD | 36.4 ± 10.5 | 34.2 ± 9.2 | 38.0 ± 11.2 | 0.009 | |
| Sukupuoli (mies/nainen) | 125/56 | 50/26 | 75/30 | 0.418 | |
| Mean AST level (U/L) ± SD | 59.7 ± 51.2 | 58.7 ± 42.5 | 60.5 ± 56.8 | 0.634 | |
| Mean ALT level (U/L) ± SD | 116.3 ± 124.2 | 120.2 ± 100.8 | 113.5 ± 139.1 | 0.282 | |
| HBV-genotyyppi (B/C) | 114/67 | 66/10 | 48/57 | ||
| Precore: | 20/161 | 13/63 | 7/98 | 0.027 | |
| BCP:* mutantti/villi | 38/143 | 12/64 | 26/79 | 0.144 | |
| HBCP:* mutantti/villikka | 8.4 ± 1.1 | 4.0 ± 0.7 | 4.3 ± 0.7 | ||
| HBsAg-taso ((log IU/ml) | 4.2 ± 0.7 | 8.1 ± 1.0 | 8.6 ± 1.1 | 0.003 | |
| Mean Knodell necroinflammation grade ± SD | 5.0 ± 3.0 | 5.3 ± 2.8 | 4.7 ± 3.0 | 0.128 | |
| Mean Ishak fibroosiaste ± SD | 1.8 ± 1.6 | 1.7 ± 1.2 | 1.9 ± 1.7 | 0.703 | |
Mutantti, T1762 ja A1764; villi, A1762 ja T1764. χ2-testiä käytettiin sukupuolen, HBV:n genotyypin, precore- ja basaalisen ytimen promoottorimutaatioiden muuttujiin, kun taas Mann-Whitneyn U-testiä käytettiin muihin muuttujiin. AST: aspartaattiaminotransferaasi. ALT: alaniiniaminotransferaasi. BCP: basaalinen ydinpromoottori. HBV: hepatiitti B -virus.
HBsAg:n ilmentymisen jakaantumismallit
Kaikkien niiden 105 potilaan osalta, joilla HBsAg:n ilmentyminen oli todettu, homogeeninen kuvio (kuva 1A) havaittiin 34:llä (32.4 %) potilaista, tyypin I GGH (kuva 1B) havaittiin 50:llä (47,6 %), tyypin II GGH (kuva 1C) havaittiin seitsemällä (6,7 %) ja sekamuotoinen kuvio havaittiin 14:llä (13,3 %) potilaalla. Kuten taulukosta 2 käy ilmi, BCP T1762/A1764 -mutaatioiden esiintyvyys oli suurempi tyypin II GGH:ssa (P = 0,001) verrattuna muihin kuvioihin. HBsAg-ekspression ja seerumin viruksen replikaatiomarkkereiden välillä oli vastavuoroinen suhde. Kuviosta 1D käy ilmi, että potilailla, joilla oli tyypin II GGH:n ilmentymä, oli alhaisemmat HBV-DNA-tasot ja HBsAg-tiitterit, mutta korkeammat intrahepaattisen HBsAg:n ilmentymätasot (kuva 1D). Lisäksi maksan histologia näytti tyypin II GGH:n osoittavan huomattavasti vakavampaa maksan nekroinflammation ja fibroositoimintaa sekä korkeampaa maksansisäistä HBsAg-ekspressiotasoa (kuva 1E).
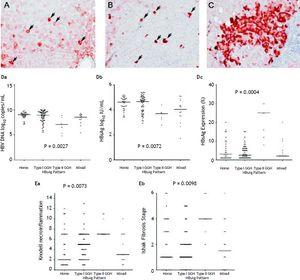
HBsAg:n sisältämiä kuvioita. A. Joitakin kohtalaisesti tai voimakkaasti homogeenisesti sytoplasmassa HBsAg:llä värjäytyneitä hepatosyyttejä (nuolet) heikosti värjäytyneiden hepatosyyttien taustalla. Kunkin homogeenisesti värjäytyneen hepatosyytin tuma sijaitsi solun keskellä. B. Tyypin I maasälpähepatosyytti (GGH), jossa oli tiheä globulaarinen tai ”inkluusion kaltainen” HBsAg-värjäytyminen (nuolet), oli hajallaan maksan parenkyymissä. C. Tyypin II GGH:n klusterissa oli HBsAg-värjäytymistä solun reunalla tai periferiassa. HBsAg:n ilmentymismallien ja seerumin HBV-DNA-tason (Da), seerumin HBsAg-tason (Db) ja maksan sisäisen HBsAg:n ilmentymistason (Dc) korrelaatiot. HBsAg:n ilmentymismallien ja Knodellin nekroinflammation asteen (Ea) ja Ishaken fibroosivaiheen (Eb) yhteys.
| HBsAg-kuvio (n = 105) | ||||||
|---|---|---|---|---|---|---|
| Mixed (n = 14) | Homogeeninen | Tyyppi I GGH | Tyyppi II GGH | P-arvo | ||
| (n = 34) | (n = 50) | (n = 7) | ||||
| Age (v) ± SD | 36.3 ± 9.2 | 36.3 ± 10.0 | 39.2 ± 12.7 | 40.0 ± 7.9 | 0.104 | |
| Sukupuoli (mies/nainen) | 11/3 | 26/11 | 35/15 | 6/1 | 0.720 | |
| Mean AST level (U/L) ± SD | 64.9 ± 56.5 | 61.1 ± 38.6 | 49.9 ± 28.3 | 122.4 ± 168.7 | 0.474 | |
| Mean ALT level (U/L) ± SD | 116.7 ± 112.4 | 114.6 ± 91.1 | 91.5 ± 63.8 | 259.1 ± 447.6 | 0.651 | |
| HBV-genotyyppi (B/C) | 10/4 | 15/19 | 22/28 | 1/6 | 0.085 | |
| Precore: G1896/A1896 | 0/14 | 3/31 | 4/46 | 0/7 | 0.594 | |
| BCP:* mutantti/villi | 4/10 | 4/30 | 12/38 | 6/1 | 0.001 | |
| HBV DNA (log kopioita/ml) | 3.9 ± 1.0 | 4.5 ± 0.5 | 4.4 ± 0.7 | 3.6 ± 0.5 | 0.001 | |
| HBsAg-taso ((log IU/ml) | 8.2 ± 1.1 | 8.9 ± 0.7 | 8.7 ± 1.1 | 6.9 ± 1.5 | ||
| Knodellin nekroinflammation aste ± SD | 4.2 ± 2.9 | 4.2 ± 3.3 | 4.7 ± 2.7 | 8.6 ± 2.0 | 0.003 | |
| Ishakin fibroosivaihe ± SD | 1.9 ± 1.9 | 1.9 ± 1.9 | 1.5 ± 1.3 | 4.1 ± 1.5 | 0.007 |
Mutantti, T1762 ja A1764; villi, A1762 ja T1764. χ2-testiä käytettiin sukupuolen, HBV:n genotyypin, precore- ja basaalisen ytimen promoottorimutaatioiden muuttujiin, kun taas Mann-Whitneyn U-testiä käytettiin muihin muuttujiin. AST: aspartaattiaminotransferaasi. ALT: alaniiniaminotransferaasi. BCP: basaalinen ydinpromoottori. HBV: hepatiitti B -virus.
HBsAg:n ilmentymistaso
Kuvissa 2A-2D esitetään HBsAg:n ilmentymisen semikvantitatiivisen mittauksen kuva. Tässä tutkimuksessa ei ollut yhtään potilasta, jonka HBsAg-ekspressioasteikko olisi ollut 4+. Viruksen replikaation ja maksan histologian välillä havaittiin vastavuoroinen suhde. Potilailla, joiden HBsAg-ekspressioasteikko oli 2+/3+, HBsAg-tiitterit ja HBV-DNA-tasot olivat alhaisemmat, mutta nekroinflammaatioaste ja fibroosivaihe olivat huomattavasti vakavammat kuin potilailla, joiden HBsAg-ekspressioasteikko oli 1+ ja HBsAg-värjäytyminen negatiivinen (kuva 2E). Niillä potilailla, joilla oli Knodellin nekroinflammaatioaste ≥ 5 pistemäärä tai Ishaken fibroosivaihe ≥ 1, oli merkittävästi korkeampi HBsAg-ekspressioprosentti (kuva 3).
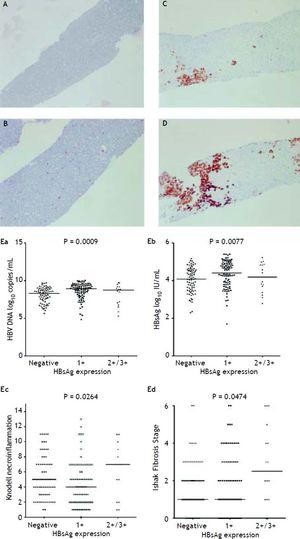
HBsAg-ekspressio mitattuna puolikvantitatiivisesti immunomerkittyjen solujen osuuden mukaan asteikolla 0-3+, mikä vastaa positiivisuutta (A) 0 %:ssa (0), (B) 1-10 %:ssa (C) 11-25 %:ssa (2+) ja (D) 25-50 %:ssa (3+) tutkituista hepatosyyteistä. HBsAg-ekspressiotason ja seerumin HBV-DNA:n (Ea) ja HBsAg-tasojen (Eb) sekä Knodellin nekroinflammation asteen (Ec) ja Ishakin fibroosivaiheen (Ed) korrelaatiot. Ryhmien väliset vertailut analysoitiin Mann-Whitneyn U-testillä.
Maksansisäisen HBsAg:n ilmentymisen korrelaatio Knodellin nekroinflammation asteen (A) ja Ishak-fibroosivaiheen (B) kanssa. Ryhmien väliset vertailut analysoitiin Mann-Whitneyn U-testillä.
Kliiniset piirteet HBsAg:n ilmentymisessä
Ensiksi tarkasteltiin virustekijöiden ja HBcAg/HBsAg:n ilmentymisen yhteyttä. HBsAg-ekspressio, ei HBcAg-ekspressio, osoitti merkitsevästi alhaisempaa tasoa precore-mutaation esiintyessä (P = 0,001). Potilailla, joilla oli genotyyppi C, maksan fibroosiaste oli suurempi (P = 0,004). Potilailla, joilla oli BCP T1762/A1764 -mutaatioita, nekroinflammaatioaste ja fibroosivaihe olivat merkitsevästi korkeammat ja HBcAg-ekspressio alhaisempi joko sytoplasmassa tai ytimessä. Kaikki nämä havainnot viittasivat aktiiviseen maksavaurioon. Lisäksi potilailla, joilla oli BCP T1762/A1764 -mutaatioita, oli suurempi maksan sisäinen HBsAg-ekspressio (9,3 ± 8,0 % vs. 4,3 ± 5,0 %, P = 0,008) (taulukko 3). Lisäksi tutkittiin tekijöitä, jotka voivat olla yhteydessä HB-sAg-ekspression tasoihin. Taulukossa 4 on 16 potilasta, joilla HBsAg-ekspression asteikko oli 2+/3+, ja 1+ asteikko 89 potilaalla. Yksilöllinen analyysi osoitti, että 2+/3+ asteikon HBsAg-ekspressio liittyi BCP T1762/A1764 -mutaatioihin ja vaikeampaan maksan nekroinflammatioon ja fibroosiin. Monimuuttujainen regressioanalyysi osoitti, että BCP T1762/A1764 -mutaatiot olivat riippumaton tekijä, joka oli yhteydessä maksansisäisen HBsAg-ekspression 2+/3+-asteikkoihin.
Potilaiden, joilla oli tai joilla ei ollut virusmutaatioita, kliiniset, virologiset ja histologiset ominaisuudet.
| Precore-mutaatio | P-arvo | BCP-mutaatiot | P-arvo | ||||
|---|---|---|---|---|---|---|---|
| Ei (n = 98) | Kyllä (n = 7) | Ei (n = 79) | Kyllä (n = 26) | ||||
| Age (v) ± SD | 37.8 ±11.0 | 40.0 ± 13.7 | 0.541 | 36.0 ± 10.6 | 43.8 ±11.1 | 0.005 | |
| Sukupuoli (mies/nainen) | 70/28 | 5/2 | 1.000 | 54/25 | 21/5 | 0.318 | |
| Mean AST level (U/L) ± SD | 60.0 ± 58.3 | 71.3 ± 30.5 | 0.072 | 51.5 ± 32.1 | 87.3 ± 95.6 | 0.007 | |
| Mean ALT level (U/L) ±SD | 112.2 ± 143.6 | 131.6 ± 39.1 | 0.031 | 98.2 ± 77.9 | 160.0 ± 242.0 | 0.080 | |
| HBV-genotyyppi (B/C) | 45/53 | 3/4 | 1.000 | 44/35 | 4/22 | ||
| Precore: G1896/A1896 | 6/73 | 1/25 | 0.678 | ||||
| BCP:* mutant/wild | 25/73 | 1/6 | 0.678 | ||||
| HBV-DNA (log-kopioita/ml) | 3.9 ± 1.0 | 4.5 ± 0.5 | 0.959 | 4.5 ± 0.6 | 3.7 ± 0.6 | ||
| HBsAg-taso ((log IU/ml) | 8.2 ± 1.1 | 8.9 ± 0.7 | 0.892 | 8.8 ± 0.9 | 7.7 ± 1.4 | ||
| Nodellinekroinflammation aste ± SD | 4.6 ± 3.0 | 6.1 ± 3.1 | 0.142 | 3.9 ± 2.7 | 7.2 ± 2.7 | ||
| Ishak-fibroosin aste ± SD | 1.8 ± 1.8 | 2.1 ± 0.9 | 0.286 | 1.3 ± 1.4 | 3.4 ± 1.6 | ||
| HBcAg-sytoplasman ekspressio (%) | 53.6 ± 25.8 | 44.3 ± 30.5 | 0.402 | 56.3 ± 25.4 | 42.7 ± 25.8 | 0.018 | |
| HBcAg-ydinekspressio (%) | 13.5 ± 17.3 | 17.6 ± 31.6 | 0.800 | 17.6 ± 20.0 | 2.3 ±4.1 | ||
| HBsAg-ekspressio (%) | 5.8 ± 6.5 | 2.4 ± 1.5 | 0.274 | 4.3 ± 5.0 | 9.3 ± 8.0 | 0.003 | |
Mutantti, T1762 ja A1764; villi, A1762 ja T1764. χ2-testiä käytettiin sukupuolen, HBV:n genotyypin, precore- ja basaalisen ytimen promoottorimutaatioiden muuttujiin, kun taas Mann-Whitneyn U-testiä käytettiin muihin muuttujiin. AST: aspartaattiaminotransferaasi. ALT: alaniiniaminotransferaasi. BCP: basaalinen ydinpromoottori. HBV: hepatiitti B -virus.
Demografisten ominaisuuksien ja HBsAg:n ilmentymisasteiden yhteys.
| Univariate | Multivariate | |||||
|---|---|---|---|---|---|---|
| HBsAg-ekspressio, asteikko | 1+ (n = 89) | 2+/3+ (n = 16) | P-arvo | Odds ratio (95 % CI) | P-arvo | |
| Age | 38.2 ±11.2 | 36.6 ±11.1 | 0.608 | 0.963 (0.903-1.026) | 0.242 | |
| Sukupuoli (mies/nainen) | 63/26 | 12/4 | 1.000 | |||
| AST-taso (U/L) | 55,0 ± 37,7 | 90,4 ± 113,2 | 0,234 | 1,026 (0,991∼1.063) | 0.142 | |
| ALT-taso (U/L) | 103.3 ± 84.4 | 170.1 ± 297.2 | 0.386 | 0.991 (0.978∼1.005) | 0.216 | |
| HBV-genotyyppi (B/C) | 42/47 | 6/10 | 0.589 | 0.994 (0.234∼4.231) | 0.994 | |
| Precore A1896-mutaatio (+/-) | 7/82 | 0/16 | 0.592 | 0.000 (0.000∼) | 0.999 | |
| BCP:*mutant/Wild | 17/72 | 9/7 | 0.003 | 6.356 (1.204∼33.356) | 0.029 | |
| HBsAg-taso (log10IU/ml) | 4.3 ± 0.7 | 4.2 ± 0.8 | 0.180 | 2.096 (0.598∼7.349) | 0.247 | |
| Serumin HBV-DNA (log10 kopioita/ml) | 8,6 ± 1,1 | 8,1 ± 1,4 | 0,135 | 0,731 (0,386∼1,383) | 0.335 | |
| Knodellin nekroinflammation luokitus | 4.4 ± 2.9 | 6.3 ± 3.3 | 0.027 | |||
| Ishak-fibroosin aste | 1.7 ± 1.6 | 2.9 ± 2.1 | 0.041 | |||
| HBcAg:n sytoplasminen ilmentyminen (%) | 53.1 ± 25.8 | 52.3 ± 28.5 | 0.915 | |||
| HBcAg:n ydinkudosekspressio (%) | 14.4 ± 18.3 | 10.1 ± 19.3 | 0.389 | |||
Mutantit, T1762 ja A1764; villit, A1762 ja T1764. Univariaattianalyysi: χ2-testiä käytettiin sukupuolen, HBV-genotyypin, precore- ja basaalisen core-promoottorin mutaatioiden muuttujiin, kun taas Mann-Whitneyn U-testiä käytettiin muihin muuttujiin. Monimuuttuja-analyysi: Logistinen regressioanalyysi ilmaistuna odds-suhteena 95 prosentin luottamusvälillä ja P-arvoilla. AST: aspartaattiaminotransferaasi. ALT: alaniiniaminotransferaasi. BCP: basaalinen ydinpromoottori. HBV: hepatiitti B -virus.
Keskusteluja
Intrahepaattinen HBsAg:n ilmentyminen liittyy erilaisiin replikaatiovaiheisiin ja taudinkehitykseen kroonisen B-hepatiitin luonnollisessa taudinkulussa.7,10,23 Tyypin I GGH esiintyi pääasiassa aktiivisessa hepatiittivaiheessa, kun taas tyypin II GGH esiintyi pääasiassa inaktiivisessa tai kirroosivaiheessa.8 Tässä tutkimuksessa osoitimme, että tyypin II GGH liittyi vaikeampaan maksan histologiaan, johon liittyi merkittävästi alhaisemmat seerumin HBV-DNA-pitoisuudet ja HBsAg-tiitterit sekä suhteellisesti korkeammat maksansisäisen HBsAg:n ilmentymisasteet. Tämä maksan histologian ja HBV:n replikaation välinen vastavuoroinen suhde osoitti, että tyypin II GGH:n esiintyminen saattaa olla pitkälle edenneen maksasairauden merkki taudin kehittyessä HBeAg-positiivisessa kroonisessa B-hepatiitissa. HB-sAg:n ilmentymismallien on raportoitu liittyvän erilaisiin virusmutaatioihin, jotka vaikuttavat HBV:n replikaation säätelyyn ja pinta-antigeenin erittymisen häiriöihin hepatosyyteissä9,24 . Tyypin II GGH:ssa esiintyi johdonmukaisesti Pre-S2-deletiomutaatioita, jotka vähensivät keskimmäisten pintaproteiinien synteesiä ja johtivat sitten suurten pintaproteiinien kertymiseen hepatosyyteihin ja HBsAg:n erittymisen häiriöön.25 Tässä tutkimuksessa suoritimme seerumin HBsAg:n ja HBV-DNA:n korrelaation potilaiden välillä, joilla oli tai ei ollut tyypin II GGH. Näiden kahden HBV:n replikaatioindikaattorin välillä oli kohtalainen korrelaatio potilailla, joilla ei ollut tyypin II GGH:ta (r = 0,686, P 26,27 Pre-S-deleetio voisi johtaa ER-stressiin ja aktivoida stressiin liittyvän signaalinsiirron. Hepatosyyttien DNA:n oksidatiivinen vaurio ja sen jälkeen stimuloidut DNA:n korjausmekanismit saattavat johtaa genomiseen epävakauteen, joka pahentaa maksavaurioita ja altistaa karsinogeneesille.28
Havaitsimme HBsAg:n ilmentymismallien lisäksi, että korkeampiin ilmentymismääriin liittyi vaikeampia maksan histologisia toimintoja ja korkeampi BCP T1762/A1764 -mutaatioiden määrä. BCP T1762/A1764 -mutaatiot ovat vahvasti yhteydessä vaikeaan maksan histologiseen toimintaan ja maksasyöpään.29,30 Tietojemme mukaan genotyypin C ja BCP T1762/A1764 -mutaatioiden esiintymisen välillä on vahva yhteys.30 Tässä tutkimuksessa genotyypillä C ei näyttänyt olevan merkitystä HBsAg:n ilmentymistasoon. Sitä vastoin BCP T1762/A1764 -mutaatioilla oli vahva yhteys HBsAg-ekspressioon. Virusmutaatioiden osalta BCP T1762/A1764 -mutaatiot voivat tarjota perustan muille HBV-mutaatioille, kuten pre-S-deletiolle ja kompleksisille mutaatioille, joita esiintyy usein BCP T1762/A1764 -mutaatioiden yhteydessä. Kompleksiset HBV-mutantit osoittivat osittaisia tai täydellisiä vikoja e:n, ytimen ja pintaproteiinien ilmentymisessä ja erittymisessä.31 Heikentynyt hepatiitti B:n pinta-antigeenin eritys korreloi pintaproteiinien poikkeavan lokalisoitumisen kanssa ER:ssä ja johti korkeaan HBsAg:n ilmentymiseen. Lisäksi BCP T1762/A1764 -mutaation katsotaan olevan seurausta viruksen kyvykkyydestä isännän immuunivalvonnan aiheuttaman valintapaineen vuoksi. Vastaavasti pre-S2-mutaatiot, jotka kätkeytyvät tyypin II GGH:ssa, osuvat yksiin ihmisen leukosyyttiantigeenille rajoitettujen T- ja B-soluepitooppien kanssa.32 Tyypin II GGH:n ympärillä ei yleensä esiinny solunekroosia tai T-lymfosyytti-infiltraatiota, mikä viittaa siihen, että HBV:llä, jolla on syntynyt pre-S2-deleetio-mutaatio, on myös mahdollisesti uusia pakenemismutaatioita.33 Pinta-antigeenin kertyminen hepatosyyteihin voisi kuitenkin tapahtua ilman, että kantaisi mitään tunnetuista viruksen mutaatioista pre-S- tai S-genomissa tai pintapromoottoreissa.31,34 Siksi HBsAg:n ilmentyminen voisi olla sekvenssi yhdessä viruksen mutaatioiden kanssa tai ilman niitä.
Tässä tutkimuksessa oli useita mahdollisia rajoituksia. Tämän tutkimuksen havainnot perustuivat retrospektiiviseen poikkileikkausasetelmaan, mutta pitkittäisseurantaa ei suoritettu. HBsAg:n ilmentymistaso hepatosyyteissä ja histologinen vaikeusaste voivat vaihdella yksittäisen potilaan maksan eri osissa; maksabiopsia sinänsä ei voi edustaa täsmällisesti mitään maksakudosta biopsiaydintä lukuun ottamatta.
Yhteenvetona voidaan todeta, että potilailla, joilla oli tyypin II GGH-kuvio tai korkeampi maksansisäinen HBsAg:n ilmentymistaso, oli vastavuoroinen suhde vaikeamman maksan histologisen toiminnan ja alhaisemman HBV:n replikoitumisvalmiuden välillä. Vahva yhteys maksansisäisen HBsAg-ekspression ja BCP T1762/A1764 -mutaatioiden välillä osoitti, että HBsAg-ekspressiota voitaisiin mahdollisesti pitää histologisena ilmentymänä HBV:n genomisen evoluution aikana isännän immuunipaineen alaisena.
Lyhenteet
- –
BCP: basal core promoter.
- –
GGH: ground glass hepatocyte.
- –
HBcAg: hepatiitti B:n ydinantigeeni.
- –
HBeAg: hepatiitti B:n e antigeeni.
- –
HBsAg: hepatiitti B:n pinta-antigeeni.
- –
HBV: hepatiitti B-virus.
Interressiristiriidat
T.-T. C. on saanut tutkimusrahoitusta Gilead Sciences, Bristol-Myers Squibb Company, Glaxo-SmithKline, Merck Sharp & Dohme (I.A.) Corporation ja Pfizer Inc. Muilla kirjoittajilla ei ole eturistiriitoja.