Konjunktivaan interpalpebraaliseen tilaan kehittyy usein epäsäännöllisiä kudosmuutoksia, jotka ovat useimmiten minimaalisen patologisia tai eivät lainkaan patologisia. Tämä paikka altistuu ultraviolettisäteilylle (UV-säteilylle) ja ilmakehän ärsyttäville aineille ja on altis kuivumiselle; näin ollen pingueculaen ja pterygian kaltaiset vauriot ovat yleisesti esiintyviä silmänpinnan epäsäännöllisyyksiä, ja ne herättävät yleensä minimaalista huomiota tutkimuksessa.
Samettumatautia esiintyy kuitenkin satunnaisesti. Invasiivista sidekalvon levyepiteelikarsinoomaa edeltää usein histologisesti sidekalvon sisäinen epiteelisolukasvain (CIN), joka edustaa yleisimmin esiintyvää sidekalvon neoplastista kasvua. Nämä vauriot – jotka usein diagnosoidaan virheellisesti tyypillisemmiksi silmänpinnan kasvaimiksi – ovat hitaasti eteneviä, paikallisesti invasiivisia eikä niillä ole metastaattista potentiaalia. Ne voivat kuitenkin toisinaan aiheuttaa merkittäviä paikallisia silmänpinnan vaurioita ja edetä invasiivisemmaksi okasolusyöväksi. Sekä CIN:n diagnosointi että hoito voivat olla haastavia. Tämä artikkeli tarjoaa oivalluksia niille silmälääkäreille, jotka eivät ehkä törmää CIN:iin liian usein ja jotka haluaisivat kliinisen katsauksen.
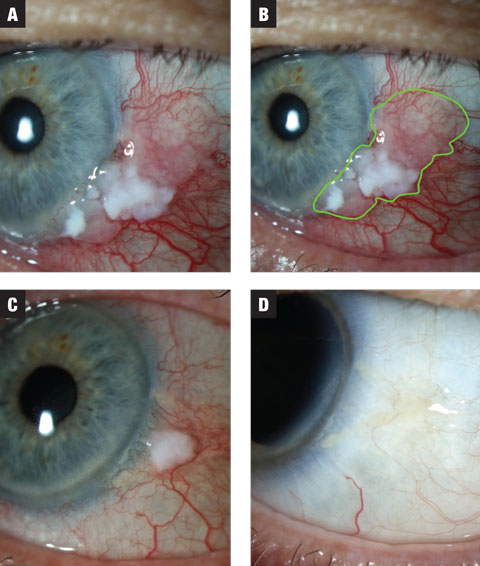
Kuva 1a. Tapauksessa 1 leesiossa on sekä leukoplakia- että hyytelömäisiä vyöhykkeitä. Hoito aloitettiin MMC 0,02 % QID:llä. Kuva 1b. Vaurion arvioitu laajuus korostettuna. Kuva 1c. Ensimmäisen kolmen viikon hoitojakson jälkeen vaurion koko pienenee huomattavasti. Potilaalle asetettiin kahden viikon huuhtelujakso ja häntä ohjeistettiin odottamaan toista MMC-kuuria. Kuva 1d. Vaurio on täysin hävinnyt huuhtelun jälkeen. Klikkaa kuvaa suurentaaksesi.
SYÖVÄN KEHITYS
Epiteelisyöpäsolupopulaation eli karsinooman synty edellyttää sarjaa muutoksia solujen käyttäytymisessä. Soluissa, joissa esiintyy tätä dysplasiaa, esiintyy epäjärjestäytynyttä kasvua ja kypsymistä, mikä johtaa epäkypsien solujen ylitarjontaan, jonka vastakohtana on samanaikaisesti tämän linjan kypsien solujen suhteellinen vähyys. Vaikka dysplasia on palautuva prosessi, dysplastiset solut voivat muuttua edelleen, mikä johtaa neoplastiseen transformaatioon, jolloin soluista tulee epäherkkiä kasvun estäjille ja ne muuttuvat invasiivisiksi.
Neoplastiset karsinoomat voivat olla paikallisesti rajoittuneita tyvikalvoon – tunnetaan nimellä carcinoma in situ – tai ne voivat olla invasiivisia, jolloin leesiolle on ominaista, että se murtautuu kyseisen tyvikalvon läpi ja leviää paikallisesti. Tässä vaiheistuksessa ei kuitenkaan viitata kahteen erilliseen kokonaisuuteen, vaan karsinooma in situ edustaa pikemminkin esivaihetta samassa neoplasian jatkumossa. Jos karsinooma in situ jätetään rauhaan, se voi lopulta muuttua invasiiviseksi.
Vaikka levyepiteelikarsinooma voi ohittaa CIN-vaiheen, se on usein taudin etiologian keskipiste. CIN on sidekalvon (ja mahdollisesti sarveiskalvon) epiteelisolujen epänormaali rivi, ja se edustaa joko yksinkertaista dysplasiaa (epiteelikudoksen osittaista paksuutta) tai karsinooma in situ -leesiota, kun leesio on täysipaksuinen.1-4 CIN on osa sidekalvon ja sarveiskalvon neoplastisten sairauksien kirjoa, joka tunnetaan kollektiivisesti nimellä silmän pinnan levyepiteelisolujen neoplasia (OSSN). Jos CIN muuttuu invasiiviseksi läpäisemällä tyvikalvon, se luokitellaan invasiiviseksi levyepiteelikarsinoomaksi (SCC).
Vaikka CIN on harvinainen, se on Yhdysvalloissa yleisin sidekalvon kasvain.4 CIN:n ja kaikkien OSSN:n muotojen kehittymisen riskitekijöitä ovat UV-altistus (erityisesti UV-B), miehen sukupuoli, altistuminen öljytuotteille, runsas tupakansavu, ihmisen immuunipuutosvirus (HIV) ja ihmisen papilloomavirus (HPV) tyyppi 16, vaikkakin viimeksi mainittu riski on edelleen kiistanalainen.1,3-5 CIN:n ennuste on tavallisesti hyvä, lukuun ottamatta tapauksia, joissa kasvain on epätavallisen suuri. Kun leesio rikkoo tyvikalvon ja muuttuu invasiiviseksi, ennuste on huonompi ja vaatii usein aggressiivista hoitoa, kuten enukleaatiota tai eksteneraatiota. Näissäkin tapauksissa etämetastaasin riski on pieni.
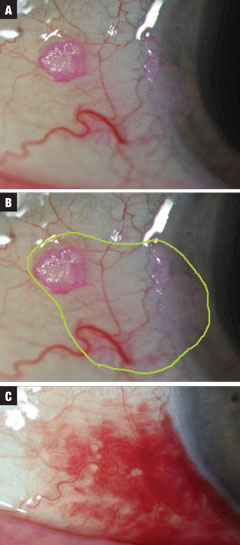
Kuvat 2a-c (ylhäältä alas). Tapaus 2 koski pientä epäiltyä CIN-leesiota, joka löydettiin satunnaisesti tutkimuksessa. Hoito aloitettiin INF-a2b QID, kunnes 10 ml:n pullo oli tyhjä. Neoplastisten marginaalien arvioitu kokonaislaajuus on korostettu vihreällä. Lopulta havaittiin resoluutio, ja samanaikainen SCH liittyi valsalvaan (ei lääkityksen aiheuttama). Hoito vaati kuukauden yhden miljoonan IU:n QID-hoitoa ja sen jälkeen 10 päivää QID-hoitoa kolmella miljoonalla IU:lla INF-a2b:tä. Klikkaa kuvaa suurentaaksesi.
Kliininen esitys
CIN:n kliininen ulkonäkö on epänormaali, hieman koholla oleva, lihaisa massa, joka sijaitsee tyypillisesti interpalpebraalisella limbaalisella vyöhykkeellä (95 %:lla kaikista leesioista).6 Etenemispainotteisuus tälle alueelle johtuu todennäköisesti sen ominaisuuksista. UV-B-altistus on suurinta interpalpebraalisella vyöhykkeellä, ja limbuksen kantasoluvyöhyke on sarveiskalvon ja sidekalvon epiteelin välinen siirtymätila. Tämä siirtymävyöhyke aiheuttaa todennäköisesti kudokselle erityisen riskin saada dysplasiaa.
Sidekalvomuutokset voivat olla hyytelömäisiä, papillaarisia tai harvemmin leukoplakia, joka syntyy hyperkeratoosin seurauksena. Nämä leesiot ovat yleensä hyvin rajattuja, ja niissä näkyy jonkinasteista syöttöverisuonistoa.3,7,8 Yhdeksänkymmentäviisi prosenttia tapauksista koskee limbusta.6 Sarveiskalvon ilmenemismuodoissa on samanlaista valkaisua, ja niissä voi näkyä harmaita, fimbrioituneita (eli sormimaisia) epiteeliprojektioita limbuksesta. Klassisesti leesiot osoittavat positiivista värjäytymistä tai pistemäistä värjäytymistä ruusubengalilla, mikä voi olla hyödyllistä CIN:n kliinisessä erottelussa muista sidekalvon leesioista.8,9
Paperilla suhteellisen näkyvästä löydöksestä huolimatta CIN- ja SCC-leesioita voi olla haastavaa erottaa tavanomaisemmista sidekalvon kasvaimista, kuten pingueculaeista, pterygiaeista ja nevoista. Tämä voi johtaa jopa 60 prosentissa tapauksista väärään diagnoosiin, vaikka kokeneet lääkärit arvioisivat ne, mikä tekee histologiseen arviointiin perustuvasta biopsiasta mahdollisesti arvokkaan.3
Diagnostinen testaaminen
Historiallisesti testaukseen on kuulunut kirurgisen poiston yhteydessä suoritettu karsiva biopsia. Lääkärit käyttävät kuitenkin nykyään kemoterapiaa ensisijaisena hoitomuotona, mikä saattaa rajoittaa pääsyä biopsian ottoon.
Uudemman diagnostiikan väline on impressionaalinen sytologia, joka tehdään levittämällä suodatinpaperi leesioon, poistamalla pinnallinen epiteeli ja mahdollistamalla minimaalisesti invasiiviset histologiset tutkimukset. Tämä menetelmä on noin 80-prosenttisesti herkkä, mutta sen heikkoutena ovat edelleen väärät negatiiviset tulokset, koska keräyspaperi saattaa jumiutua leesion liialliseen keratoosiin; toistetut yritykset onnistuvat yleensä paremmin.8. Eräs tutkimus osoittaa, että ultrakorkearesoluutioinen OCT, vaikkei sitä tällä hetkellä olekaan saatavilla, on erittäin herkkä OSSN:n ja pterygiumin erottamisessa leesion epiteelin paksuuden perusteella.10
Hoito
CIN:n perinteinen hoito on leikkaus, jonka marginaalit ovat 1 mm:n ja 5 mm:n välillä riippuen primaaristen ja toistuvien leesioiden laajuudesta ja historiasta. Sarveiskalvon osallistuminen poistetaan kirurgisella terällä, ja kylmähoitoa käytetään sängyn ja sidekalvon reunoille. Sklera jätetään paljaaksi. Tämä onnistuu yleensä hyvin, mutta uusiutumista on raportoitu 10-52 %, riippuen leikkauksen jälkeisen histologian perusteella määritellyn selvän leikkausmarginaalin osuudesta.6-11 Osuus laskee 5 %:iin, jos selkeät marginaalit saavutetaan; valitettavasti tutkimukset osoittavat, että on vaikea taata selkeitä marginaaleja.8,9,9 Nämä luvut näyttäisivät tukevan mahdollisimman laajojen marginaalien käyttöä; laajalla sidekalvon poistolla on kuitenkin seurauksia: ihomuutokset, limbaalisten kantasolujen puutos, skleraalinen sulaminen, kyynelfilmin merkittävä häiriö ja epäsäännölliset muutokset sarveiskalvon astigmatismissa.
Topikaaliset vaihtoehdot
Viime aikoina paikallisista kemoterapeuteista on tullut suosittuja CIN:n hoidossa, sillä niiden etuna on koko silmänpinnan hoitaminen, ja kun niitä käytetään harkitusti, ne näyttävät olevan hyvin siedettyjä.
Mitomysiini. Mitomysiinit, jotka löydettiin 1950-luvulla, ovat Streptomyces caespitosus -organismin fermentoinnin sivutuotteita. Mitomysiini-C (MMC), viimeinen näistä löydetyistä molekyyleistä, on antimetaboliitti, jota käytetään silmälääketieteen ulkopuolella kasvainten kemoterapia-aineena.12,13 MMC toimii alkyloivana aineena, joka estää DNA:n pilkkoutumisen solujen mitoosin aikana, muutos, joka on erittäin myrkyllinen.1 Yksikin näistä ristisilloituksista voi olla solulle kohtalokas.13 Lisäksi MMC voi tuottaa reaktiivisia happi spesieettejä ja lisätä kasvainnekroositekijän (TNF) synteesiä.
Vaikka sen juuret ovat onkologiassa, MMC:n käyttö on yleistynyt erityisesti silmienhoidossa pyrkimyksenä rajoittaa liiallista postoperatiivista arpimuodostusta. Leikkauspotilaita hoitavat optometristit saattavat tuntea sen intraoperatiivisen käytön arpeutumisen estämiseksi glaukooman suodatusleikkauksen läpikäyneillä potilailla ja sen käytön PRK:ssa sarveiskalvon sameuden estämiseksi. Sen jälkeen, kun MMC:tä ensimmäisen kerran käytettiin OSSN:n yhteydessä 1990-luvun puolivälissä, se on osoittautunut tehokkaaksi, ja sen onnistumisprosentit ovat olleet 82-100 prosenttia. Annostelu on tyypillisesti 0,04 %:n pitoisuus, joka annetaan QID:nä yhden viikon mittaisissa jaksoissa tai 0,02 %:n pitoisuutta annostellaan jatkuvasti neljän viikon hoitojaksoissa.4 Lääkkeen toksisuus on suurempaa pitkäkestoisilla hoidoilla tai suuremmilla pitoisuuksilla
Koska MMC on erityisen voimakas, potentiaalisesti vaarallinen lääkeaine, sen haittavaikutukset – esimerkiksi raajojen kantasolujen vajaatoiminta ja skleraalisulatus – voivat olla vakavia. Yleisemmin esiintyvät haittavaikutukset, kuten sarveiskalvon ja sidekalvon epiteeliopatia ja sidekalvon injektio, ovat ohimeneviä.4,14 MMC:tä käytettäessä se vaatii huolellista seurantaa ja lääkityksen lopettamista, kun epäillään mitä tahansa merkittävää haittavaikutusta.
5-Fluorourasiili (5-FU). Tämä on toinen antimetaboliitti, jota käytetään dermatologisten kasvainten hoidossa ja myös glaukoomakirurgit käyttävät. Sen mekanismi estää DNA-synteesiä häiritsemällä tymidylaattisyntaasientsyymiä. OSSN:n hoidossa 5-FU:ta annostellaan yleensä 1 %:n pitoisuutena QID-annoksena yksi kuukausi, yksi kuukausi, kunnes se on hävinnyt. Useimmat tapaukset häviävät yhdellä tai kahdella hoitojaksolla, mutta joissakin tapauksissa hoito kestää jopa viisi hoitojaksoa. Epiteelitoksisuus, joka johtaa eroosioon tai irtoamiseen, on yleistä. Eräässä tutkimuksessa hoidon kesto määriteltiin ajaksi, joka kului siihen asti, kunnes hilseilyä esiintyi, ja hoitoaika päättyi siihen asti, kunnes epiteeli palautui. Tästä kivuliaasta komplikaatiosta huolimatta 5-FU:n sivuvaikutukset eivät näytä olevan yhtä vakavia kuin MMC:n, ja uusiutumisprosentit ilmoitetaan yleensä vastaaviksi.4,14
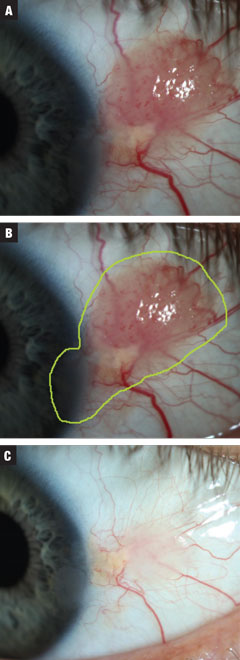
Kuva 3a. Tapaus 3 sisälsi keskikokoisen oletetun papillomatoottisen CIN:n. Potilaalle aloitettiin hoito INF-a2b kolme miljoonaa IU 10 päivän ajan. Kuva 3b. Vaurion arvioitu kokonaiskoko. Kuva 3c. Hoidon jälkeen. Kasvu on lähes täysin hävinnyt ja sarveiskalvon epiteeli on edelleen epäsäännöllinen. Vastoin neuvoja potilas valitsi tarkkailun tällä kertaa. Klikkaa kuvaa suurentaaksesi.
Interferoni alfa 2b (INF-a2b). Interferonit ovat sytokiineiksi kutsuttujen luonnossa esiintyvien tulehdusproteiinien alaryhmä. Niitä tuottavat aktivoituneet immuunisolut, ja niillä on vaihtelevia antineoplastisia, antiviraalisia ja antimikrobisia vaikutuksia. Ensimmäisen kerran INF-a2b:n käytöstä raportoitiin vuonna 1994, kun CIN-vaurio saatiin onnistuneesti korjattua paikallisesti käytettynä.5 Sittemmin INF-a2b:tä on käytetty hyvällä tuloksella OSSN:n hoidossa sekä paikallisesti että subkonjunktivaalisesti.
Perileesioannostelulla on suurin teho, 87 %:sta 100 %:n resoluutio viiden viikon aikana (kun injektioita annetaan jopa kolme kertaa viikossa).4,14,15 Useat injektiot ovat välttämättömiä tämän tehon saavuttamiseksi, mikä johtaa siihen, että jopa 100 %:lle potilaista kehittyy systeemisiä myalgioita ja kuumetta.5,14 Paikallinen annostelu vastaa teholtaan karkeasti MMC:n annostelua.14,15 Sitä annostellaan konsentraatiossa miljoona kansainvälistä yksikköä (IU) millimetriä kohden, ja sitä annostellaan neljännesvuosittaisena annosteluna kliinisen resoluution jälkeisen kuukauden ajan. Jos paranemista ei tapahdu, pitoisuutta voidaan nostaa jopa kolmeen miljoonaan IU:hun, myös QID. Yleisesti ottaen, hoitopitoisuudesta riippumatta, apteekit valmistavat pullon yhdestä miljoona IU:n valmisteesta. Tätä miljoonan IU:n valmistetta voidaan väkevöittää edelleen vähentämällä kantaja-aineen määrää pullossa. Paikallisesti käytettävän INF-a2b:n haittavaikutukset ovat lieviä, ja hyperemiaa ja follikulaarista sidekalvotulehdusta raportoidaan usein; keratiittia raportoidaan harvemmin.4
Paikallisesti käytettävät vs. kirurgia
Vaikka biopsia ja kirurginen poisto olivat perinteisesti ensisijainen hoito, paikallisesti käytettävät solunsalpaajahoitolääkkeet, joilla on jonkin verran teoreettisia hyötyjä leikkaukseen nähden, ovat saavuttaneet jonkin verran hyväksyntää etulinjan hoitomuotona. Leikkauksessa on mahdotonta taata selkeitä marginaaleja, joita tarvitaan parhaan ennusteen saavuttamiseksi. Mitä enemmän kudosta poistetaan selvien marginaalien varmistamiseksi, sitä suurempi on mahdollisuus silmän pinnan pitkäaikaiseen vaurioitumiseen. Paikallisilla aineilla hoidetaan koko silmänpinta, jolloin marginaalien tunnistaminen ei ole tarpeen ja neoplastisia solupopulaatioita, joita ei voida selvästi tunnistaa mikroskooppisella analyysillä, voidaan hoitaa tehokkaasti – tämä hyöty voi johtaa siihen, että paikalliset aineet yhdistetään kirurgisen poistoleikkauksen kanssa suurten leesioiden kokonaishoitoprotokollaksi. Paikallishoidon haittapuolena on tietenkin se, että koska koko silmänpinta altistuu lääkkeelle – teknisesti ottaen kyseessä on ylihoito – voi esiintyä komplikaatioita, ja erityisesti MMC:n tapauksessa nämä komplikaatiot voivat olla vakavia, vaikka ne ovatkin harvinaisia.
Tehokkuuden osalta kaikki OSSN:n hoidossa käytettävät paikalliset kemoterapia-aineet toimivat kohtuullisen hyvin. INF-a2b:llä on tehty tehokkuustutkimuksia verrattuna kirurgiseen resektioon, ja sen on osoitettu poistavan leesion vertailukelpoisella nopeudella, ja uusiutumisprosentit saattavat itse asiassa olla INF-a2b:n kohdalla alhaisemmat verrattuna resektioon.4 Seurantatutkimusten mukaan sen käyttö on tarkoituksenmukaisempaa yksinkertaisissa tai pienissä leesioissa, kun taas leikkaus on suositeltavampi pitkälle edenneissä leesioissa, vaikkakin paikallishoito voi olla suositeltavampaa uusiutuvissa leesioissa.4,15
MMC:n hoitojakso on yleensä lyhin, mutta se on toksisin ja siihen liittyy suurin komplikaatioriski. 5-FU:n sivuvaikutusprofiili ja hoidon kesto ovat keskinkertaiset; se on myös ryhmästä edullisin. INF-a2b:llä on parempi siedettävyys, mutta siihen liittyy usein pidempi hoitoaika ja suuremmat kustannukset.4,13-16
Kustannukset voivat varmasti olla huomionarvoinen seikka, kun päätetään paikallissytostaattisten kemoterapeuttisten lääkkeiden käytöstä. Vakuutusyhtiöt kieltäytyvät joskus korvaamasta näitä lääkkeitä ja ilmoittavat niiden käytön olevan kokeellista. Lyhyissä hoitojaksoissa ja verrattaessa vain terveydenhuollon kokonaiskustannuksia paikallisesti käytettävät kemoterapeuttiset lääkkeet ovat edullisempia kuin leikkaus; ne voivat kuitenkin ylittää leikkauskustannukset useiden hoitojaksojen jälkeen.
Tästä mahdollisesta kompastuskivestä huolimatta, kun otetaan huomioon teho, mahdollisuus välttää leikkaus ja yleinen siedettävyys, paikallisesti käytettävät solunsalpaajahoitolääkkeet vaikuttavat valvotusti käytettynä hyvältä vaihtoehdolta sidekalvon sisäisten epiteelin sisäisten kasvainvaurioiden hoidossa.
Tohtori Bronner on henkilökunnan optometristi Pacific Cataract and Laser Institutessa Kennewickissä, Washingtonissa.
1. Kiire CA, Dhillon B. The aetiology and associations of conjunctival intraepithelial neoplasia. Br J Ophthalmol. 2006:90(1);109-13.
2. Birkholz ES et al. Treatment of ocular surface squamous cell intraepithelial neoplasia with and without mitomycin C. Cornea. 2011;30:37-41.
3. Lee GA, Hirst LW. Silmän pinnan levyepiteelisoluinen neoplasia. Survey of Ophthalmology. 1995; 39:429-50.
4. Nelson KD, McSoley JJ. Sidekalvon sisäisen epiteelin neoplasian kliiniset löydökset ja hoito. Optometria. 2011; 82:15-21.
5. Nanji AA, Sayyad FE, Karp CL. Ajankohtainen kemoterapia silmän pinnan levyepiteelisyöpään. Current Opinion in Ophthalmology. 2013; 24:336-42.
6. Warner M, Jakobiec F. Squamous Neoplasms of the Conjunctiva. In: Krachmer JH, Mannis MJ, Holland EJ eds. Cornea. 2nd ed. St Louis: Mosby; 2004:557-70.
7. Rapuono CJ, Luchs JI, Kim T. Conjunctival and External Disease. Anterior Segment: Rekvisiitta. Ed. Krachmer, JH. Mosby. 2000;33-6.
8. Huerva V ja Ascaso FJ. Conjunctival Intraepithelial Neoplasia – Clinical Presentation, Diagnosis and Treatment Possibilities. Srivstava S (toim.) ISBN: 978-953-307-987-5, InTech.
9. Nelson KD, McSoley JJ. Sidekalvon sisäisen epiteelin sisäisen neoplasian kliiniset löydökset ja hoito. Optometria. 2011;82:15-21.
10. Kieval JZ1, Karp CL, Abou Shousha M, et al. Ultra-high resolution optical coherence tomography for differentiation of ocular surface squamous neoplasia and pterigia. Invest Ophthalmol and Vis Sci. 2011; 52:1741.
11. Peksayar G, Soyturk MK, Demiryont M: Kylmähoidon pitkäaikaistulokset sidekalvon pahanlaatuisissa epiteelikasvaimissa. Amer J of Ophthalmol. 1989;107: 337.
12. Santhiago MR, Netto MV, Wilson SE. Mitomysiini C: Biologiset vaikutukset ja käyttö taittokirurgiassa. Cornea. 2012; 31:311-21.
13. Tomaz M. Mitomysiini C: pieni, nopea ja tappava (mutta hyvin selektiivinen). Chem and Biol. 1995; 2:575-9.
14. Majmudar PA, Epstein RJ. Antimetaboliitit silmänpinnan kasvaimissa. Curr Opin in Ophthalmol. 1998; 9:35-9.
15. Besley J, Pappalardo J, Lee GA. Silmänpinnan levyepiteelisolujen uusiutumisen riskitekijät paikallisen mitomysiini C:n ja interferoni alfa 2b:n hoidon jälkeen. Amer J of Ophthalmol 2014; 157:287-93.
16. Boehm M ja Huang AJW. Toistuvan sarveiskalvon ja sidekalvon intraepiteelin sisäisen neoplasian hoito paikallisesti käytettävällä interferoni alfa-2b:llä. Ophthalmol. 2004; 111:1755-61.