US Pharm. 2012;37(5):HS-2-HS-7.
Kipu on yleisin syy siihen, että ihmiset hakeutuvat lääkärin hoitoon.1 Tuoreessa tutkimuksessa on arvioitu, että kipu koskettaa kymmeniä miljoonia amerikkalaisia ja maksaa Yhdysvalloille vuosittain 635 miljardia dollaria, koska se lisää sairaanhoidon kulutusta ja aiheuttaa välillisiä kustannuksia, jotka johtuvat menetetyistä työpäivistä ja tuottavuuden menetyksestä.2 Kroonisen kivun hoito lääkkeillä, kuten opioideilla, on yleinen strategia, mutta krooninen kipu voi jatkua tai pahentua aggressiivisesta opioidihoidosta huolimatta. Tämän artikkelin tarkoituksena on valottaa ilmiötä, jossa opioideja määrätään kivun hoitoon, mutta ne aiheuttavat uutta tai paradoksaalisesti pahenevaa kipua.Tätä tilaa kutsutaan opioidien aiheuttamaksi hyperalgesiaksi (OIH). OIH voidaan muodollisemmin määritellä lisääntyneeksi nociceptiviseksi herkistymiseksi, joka johtuu altistumisesta opioideille.3OIH eroaa selvästi toleranssista, riippuvuudesta, riippuvuudesta ja sairauden etenemisestä. OIH:n kliinistä esiintyvyyttä ei tunneta.4
Diagnoosi ja esittely
Yksi suurimmista ongelmista OIH:n oikeassa diagnosoinnissa on sen läheinen samankaltaisuus opioiditoleranssin kanssa. Toleranssille ja OIH:lle on yhteistä, että analgeettinen vaste opioidiannokselle vähenee, ja niillä on todennäköisesti monia samoja solumekanismeja.5Toleranssi voidaan voittaa lisäämällä opioidiannosta, kun taas sama lisäys johtaa OIH:ta sairastavalla potilaalla kivun pahenemiseen.4 Lisäksi toleranssi kehittyy yleensä hitaasti ajan mittaan, kun taas OIH:ta sairastavalla potilaalla opioidihoidon aiheuttama kivun paheneminen tapahtuu suhteellisen nopeasti. Usein OIH eroaa sietokyvystä siinä, että kivun voimakkuus on voimakkaampaa kuin alun perin ilmoitettiin.6
Allihoidettu kipu on toinen mahdollisuus, joka olisi suljettava pois. Jos opioidihoito ei ole optimaalista, annoksen suurentamisen pitäisi johtaa kivun lievittymiseen; jos OIH:ta esiintyy, asian pitäisi olla päinvastoin. Jotta OIH voidaan diagnosoida tarkasti, kivun on katoava, kun opioidihoito lopetetaan.6 Asiaa mutkistaa entisestään se, että opioidien vieroituksesta johtuva hyperalgesia on hyvin dokumentoitu ilmiö.7 Näin ollen kivun katoaminen opioidihoidon lopettamisen jälkeen OIH:ssa ei ole välitöntä ja vaatii kärsivällisyyttä. Tämä asettaa omat haasteensa sekä lääkärille että potilaalle.
OIH:lla on taipumus esiintyä muitakin erityispiirteitä (TAULUKKO 1).OIH:hen liittyvä kipu on yleensä hajanaisempaa ja heikkolaatuisempaa, ja haitalliset ärsykkeet ovat yleensä kivuliaampia kuin normaalisti odotettaisiin. OIH:ssa kipu ilmenee usein alueilla, jotka ulottuvat vamman tai kudosvaurion alueen ulkopuolelle. OIH:ssa kipu voi jatkua huolimatta alkuperäisen kipulähteen poistamisesta tai vaurioituneen kudoksen paranemisesta.OIH:ssa opioidihoidon edetessä kipu voi antaa vaikutelman, että kipu pahenee alkuperäistä pahemmaksi huolimatta ajasta, lepoajasta ja muista toimenpiteistä, jotka normaalisti mahdollistaisivat kliinisesti merkityksellisen määrän paranemista.5 Lisäksi allodynia on osoitettu useissa ihmisillä ja eläimillä tehdyissä OIH-tutkimuksissa.8

Etiologia
OIH:n syystä on olemassa useita teorioita. Teoria, jota on tutkittu eniten ja joka saa tällä hetkellä eniten huomiota, on neuroexcitatorinen malli. Uskotaan, että tietytopioidit ja niiden metaboliitit agonisoivat N-metyyli-D-aspartaatti(NMDA)-reseptoria. NMDA-reseptorin aktivoituminen aiheuttaa kalsiumin virtauksen, joka lisää huomattavasti hermosolun herätettävyyttä. Kun NMDA-reseptori ja vastaavat neuronit ovat aktiivisempia, ne pystyvät helpommin välittämään kipuärsykkeitä, jotka on käynnistetty kiertävällä aineella Por muilla haitallisilla ärsykkeillä. Glutamaatti on NDMA-reseptorin ensisijainen endogeeninen agonisti.9
Tutkimukset, jotka osoittavat OIH:n lievittyvän NMDA-reseptoriantagonistien antamisen jälkeen, tukevat tätä teoriaa NMDA-reseptorin aktivoitumisen säätelemästä pronociceptionista. Nämä antagonistit sitoutuvat ei-kompetitiivisesti NMDA-kanavan fensyklidiinikohtaan ja estävät kalsiumin sisäänvirtauksen, joka tapahtuisi, kun reseptori sitoo glutamaattia tai muuta agonistia.10 Eläin- ja ihmistutkimukset ovat osoittaneet, että OIH:ta sairastavilla koehenkilöillä, joille annettiin ketamiinia, NMDA-reseptorin antagonistia, oli paremmat tulokset kontrolloidun kipuärsykkeen testauksen aikana. Eräässä tutkimuksessa rotille annettiin intratekaalisia morfiini-injektioita useiden päivien ajan, kunnes ne osoittivat lämpöherkkää OIH:ta. NMDA:n estäjän, dizocilpiinin, antaminen oli tehokasta lämpöhyperalgesian ainakin osittaisessa kumoamisessa.5 Muut NMDA-reseptoriantagonistit, kuten dekstrometorfaani, ovat osoittaneet jonkin verran näyttöä hyperalgeettisten tilojen lievittämisestä NMDA-reseptorin eston kautta.
Opioidit, kuten kodeiini, hydromorfoni ja morfiini, käyvät läpi useita biotransformaatioita osana normaalia aineenvaihduntaprosessia.Kodeiini metaboloituu morfiiniksi CYP2D6-entsyymin avulla. Morfiini metaboloituu useiksi molekyyleiksi, mutta se metaboloituu pääasiassa glukuronidaation kautta morfiini-3-glukuronidiksi (M3G) ja vähäisemmässä määrin morfiini-6-glukuronidiksi (M6G) (KUVA 1).11
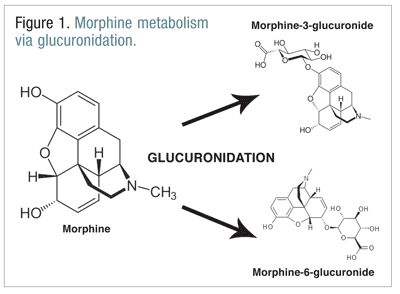
M6G on terapeuttisesti tärkeä metaboliitti. Sillä on samanlainen mu-reseptoriin sitoutumisaffiniteetti kuin morfiinilla, ja se kykenee aiheuttamaan analgesiaa, hengityslamaantumista ja muita samanlaisia vaikutuksia kuin morfiini. M3G ei kuitenkaan ole mu-reseptorin agonisti, ja sillä on pieni affiniteetti mu-reseptoriin verrattuna morfiiniin. Toisin kuin morfiini, M6G ja muut opioidit, M3G on NMDA-agonisti. Glukuronidaation kautta M3G muuntuu noin kuusi kertaa nopeammin kuin M6G.12 Muilla opioideilla on epäilty olevan NMDA-agonistista aktiivisuutta ja paradoksaalisia hermostoa kiihdyttäviä vaikutuksia.6
Tukena teorialle, jonka mukaan OIH:n aiheuttaa mu-opioidireseptorin ohella muidenkin kuin mu-opioidireseptorin aktiivisuus, on näyttöä siitä, että OIH:n oireyhtymää ei helpota opioidiantagonistien (esim. naloksonin) antaminen. Potilailla, jotka kokivat OIH:ta suuren annoksen opioidihoidon aikana, naloksonin antaminen aiheutti kivun pahenemisen.13 Siirtämällä opioidin pois mu-reseptorista naloksoni esti opioidia tarjoamasta sitä analgesiaa, joka oli mahdollista mu-reseptorin aktivoitumisen kautta, kun taas samanaikaisesti hyperalgesia säilyi kiistämättömänä.14
Dynorfiini saattaa myös olla osallisena OIH:n kehittymisessä.15Dynorfiini on endogeeninen opioidipeptidi, joka sitoutuu ensisijaisesti kappa-opioidireseptoriin ja vähäisemmässä määrin mu-opioidi- ja NMDA-reseptoreihin. Uskotaan, että dynorfiinin kappa-opioidireseptorin ja NMDA-reseptorin agonismilla on merkitystä OIH:n pronociceptiossa huolimatta puhtaiden mu-reseptoriagonistien esiintymisestä. Tutkimukset ovat osoittaneet, että dynorfiinin kumoaminen voi palauttaa morfiinin analgeettiset vaikutukset, kun koehenkilöille annetaan dynorfiiniantiseerumia. Lisäksi dynorfiinin tiedetään lisääntyvän pitkäaikaisen opioidiannostelun aikana. Dynorfiiniaiheuttaa myös kiihottavien neuropeptidien vapautumista keskushermoston eri paikoissa.
Hoitovaihtoehdot
Kun OIH-diagnoosi on tehty, on olemassa useita hoitovaihtoehtoja, joista on valittava huolellisesti. Jos alkuperäinen kivulias vamma tai kudosvaurio on korjaantunut ja kipu jatkuu opioidihoidosta huolimatta ja sen vuoksi, suoraviivaisin lähestymistapa on lopettaa haitallisen opioidin käyttö. Tämä olisi tehtävä asteittain, jotta haitalliset vieroitusoireet jäisivät mahdollisimman vähäisiksi. On huomattava, että hyperalgesia voi todennäköisesti pahentua lopettamisprosessin alkuvaiheessa.16 Tämä aiheuttaa haastavan eettisen tilanteen, jossa lääkärillä voi olla vaikeuksia vakuuttaa potilasta siitä, että kivun hoitoon määrätty lääkitys on saattanut aiheuttaa kipua tai pahentaa sitä ja että kipu voi pahentua vielä ennen kuin se lopulta häviää.17
Jos oikeutettu kipu jatkuu ja tarvitaan jonkin verran kipua lievittävää lääkitystä opioideilla, on harkittava muita strategioita kuin opioidien lopettamista kokonaan. OIH:sta kärsivät potilaat voivat saada helpotusta vähentämällä opioidiannosta.4 On raportoitu potilaista, jotka ovat löytäneet hyväksyttävän tasapainon analgesian ja hyperalgesian lievittämisen välillä opioidiannosta pienentämällä.
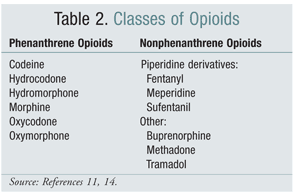
Vaihtaminen yhdestä opioidirakenneluokasta toiseen on joissakin tutkimuksissa ollut tehokas vaihtoehto OIH:n lievittämiseksi. Tähänastiset tutkimukset ovat osoittaneet, että OIH liittyy voimakkaammin fenantreeniluokan opioideihin (TAULUKKO 2).4 Fenantreeniopioidin titraus ja siirtyminen toiseen opioidiin voi ratkaista OIH:n. Kodeiini, hydromorfoni, morfiini ja rakenteellisesti samankaltaiset opioidit glukuronidoituvat osana metaboliaan. NMDA-reseptoria aktivoivan glukuronidimetaboliitin välttäminen on mahdollista siirtymällä rakenteellisesti ainutlaatuiseen opioidiin, kuten fentanyyliin. Tätä kirjoitettaessa OIH:ta ei ole osoitettu oksimorfonilla tehdyissä tutkimuksissa.4
Opioidihoidon täydentäminen syklo-oksigenaasi 2:n (COX-2) estäjällä on toinen strategia, jolla on jonkin verran kannatusta. Vähentämällä prostaglandiinisynteesiä COX-2:n estäjät voivat vähentää pronociceptiivisten neuronien herkistymistä. Ei-steroidisilla tulehduskipulääkkeillä (NSAID-lääkkeet) ja COX-2:n estäjillä näyttää olevan analgeettisia vaikutuksia, jotka eivät riipu niiden kyvystä estää prostaglandiinisynteesiäperifeerisesti.9 COX-2:n estäjät ovat myös osoittaneet kykenevänsä antagonisoimaan NMDA-reseptoria. Keskushermostossa tulehduskipulääkkeet kykenevät antagonisoimaan NMDA-reseptoria estämällä glutamaattia, aine P:tä ja muita kiihdyttäviä aminohappoja. Tästä riippumatta NMDA-reseptorin aktivoituminen voi säädellä COX-2:n ilmentymistä.18
Koska NMDA-reseptoriin on kiinnitetty huomiota sen vuoksi, että sillä on merkitystä OIH:ssa, tämän reseptorin antagonisointi näyttäisi olevan järkevä hoitostrategia. Ketamiinia on tutkittu paljon, mutta sen haittavaikutukset voivat olla vakavia. Vaikka se antagonisoi NMDA:ta ja tuottaa anesteettisen vaikutuksen, joka edistäisi analgesiaa, haittavaikutukset ovat yleisiä, moninaisia ja vakavia.19 Näihin vaikutuksiin kuuluvat takyarytmia, verenpainetauti, kognitiiviset häiriöt ja psykomimeettiset reaktiot, mukaan luettuina mielialan muutokset, elävät unet, delirium, hallusinaatiot ja sedaatio. Ketamiini on tehokas kumoamaan hyperalgesiaa ja lisäämään opioidien vaikutuksia suuria annoksia saavilla potilailla, mutta sen haittavaikutukset estävät sitä olemasta käyttökelpoinen hoitovaihtoehto.
Deksstrometorfaani on toinen NMDA-reseptoriantagonisti, jota on tutkittu OIH:n hoidossa. Yhdistelmävalmistetta, joka sisältää morfiinin ja dekstrometorfaanin 1:1-sekoitusta, on tutkittu.20Tutkimukset eivät osoittaneet, että yhdistelmähoidolla voitaisiin saavuttaa parempaa analgesiaa verrattuna pelkkään morfiiniin. Samanlainen epäonnistuminen tapahtui tutkimuksessa, jossa käytettiin samojen aineiden 2:1-sekoitusta.Tutkimuksia on kritisoitu siitä, että dekstrometorfaanin määrä oli riittämätön NMDA-reseptorin riittävään antagonisointiin.21Vielä ei tiedetä, mikä on se dekstrometorfaaniannos, joka tarvitaan joko lisäämään opioidin analgesiaa tai estämään NMDA-reseptorin aktivoitumisen aiheuttama OIH.
Metadoni on opioidi, jolla on ainutlaatuisia ominaisuuksia, jotka tekevät siitä vakuuttavan vaihtoehdon OIH-potilaan kivun hoidossa. Sen lisäksi, että metadoni vaikuttaa analgeettisesti sitoutumalla mu-opioidireseptoriin, se on heikko NMDA-reseptorin antagonisti.4 On raportoitu, että jopa pienen metadoniannoksen lisääminen on ollut tehokasta hyperalgesian vähentämisessä. Eräässä tapauksessa matala-annoksisen metadonin lisääminen (10 mg kahdesti päivässä) paransi kiputuntemuksia huomattavasti, ja opioidien kokonaisannos pieneni 40-50 prosenttia.22 Vaihtaminen haitallisesta opioidista metadoniin on ollut suosittu hoitostrategia. Tramadolilla ja meperidiinillä on myös jonkin verran NMDA-reseptorin antagonistista aktiivisuutta.
Toinen hoitomuoto, jolla on jonkin verran potentiaalia OIH:n hoidossa, on buprenorfiini.23,24 Buprenorfiini on osittainen opioidiagonisti mu-reseptorissa, ja sillä on myös kappareseptorin antagonistista aktiivisuutta.4Dynorfiinin, kappareseptorin agonistin, tiedetään lisääntyvän opioidien hoidon aikana. Kappareseptorin aktivoituminen pitkältiantagonisoi opioidien mu-reseptorivälitteisiä vaikutuksia.25 Buprenorfiinin kliinistä hyötyä OIH:n hoidossa ei ole vielä täysin selvitetty.
Johtopäätös: Paljon työtä on vielä tehtävä, ennen kuin voidaan julistaa, että OIH onymmärretty. Tarkkaa solumekanismia ja signaalireittejä, jotka ovat vastuussa tästä ilmiöstä, ei ole määritelty. Tämän lisäksi on olemassa ristiriitaisia raportteja siitä, ovatko tietyt komponentit avainasemassa vai onko niillä lainkaan merkitystä. Suurin osa OIH:n patofysiologian selvittämistä koskevasta tutkimuksesta on tehty eläinmallilla. Tästä on jonkin verran hyötyä, mutta ihmismallista saatuja tietoja on niukasti.
Tilan syyn heikko ymmärtäminen aiheuttaa epävarmoja hoitovaihtoehtoja. Paras käytettävissä oleva strategia on ongelmallisen opioidin käytön täydellinen lopettaminen, mutta siitä ei ole juurikaan hyötyä potilaalle, joka tarvitsee opioidityyppistä kivunlievitystä.Useita muita hoitomuotoja on tutkittu, mutta ne kaikki hyötyisivät lisätutkimuksesta. Suurin osa ihmisillä tehdyistä tutkimuksista koskee kirurgisia potilaita, toipuvia huumeriippuvaisia ja kokeellisia kipumalleja. Nämä tutkimukset eivät ole arvottomia, mutta nämä populaatiot eivät vastaa kroonista kipupopulaatiota. Saatavilla olevien hoitovaihtoehtojen muihin rajoituksiin kuuluvat heikot tulokset, liiallinen toksisuus kohtalaisesta menestyksestä huolimatta ja pienet tutkimukset, jotka tuottavat heikkoja johtopäätöksiä.
Tätä kirjoitettaessa on meneillään tai suunnitteilla useita kliinisiä tutkimuksia, joissa käytetään NMDA-reseptoriantagonistia memantiinia OIH:n hoidossa.26Siltikin on olemassa ristiriitaisia raportteja NMDA-reseptoreiden tarkasta roolista OIH:ssa. On tehtävä lisätutkimuksia, jotta voidaan määrittää OIH:ssa esiintyvät keskeiset reseptorit ja mekanismit. Tutkimusten otoskoon kasvattaminen auttaa tukemaan jo tehtyjä päätelmiä siitä, mitkä hoitoaineet aiheuttavat OIH:ta ja ovat tehokkaita sen hoidossa. Tutkimukset, joissa keskitytään krooniseen kipuun eikä akuutin kivun malleihin, voivat tuoda kliinisesti merkityksellistä tietoa lääkäreille.
Chapman ja kollegat ovat nostaneet esiin erityiskysymyksiä, joihin on vastattava, ennen kuin OIH:n diagnoosi voidaan tehdä ja tehokasta hoitoa voidaan antaa.27 Miten opioidiannos ja opioidien annostelu ja kesto liittyvät OIH:hen? Minkä tyyppisessä kivussa tai minkä tyyppisillä potilailla OIH:n kehittyminen on todennäköisempää? Näiden kysymysten on ohjattava tulevaa kliinistä tutkimusta.
1. Parselis Kelly J, Cook SF, Kaufman DW, et al. Opioidien käytön yleisyys ja ominaisuudet Yhdysvaltain aikuisväestössä. Pain. 2008;138:507-513.
2. Institute of Medicine. Relieving Pain in America: A Blueprint for Transforming Prevention, Care, Education, and Research. Washington, DC: The National Academies Press; 2011.
3. Chu LF, Angst MS, Clark D. Opioidien aiheuttama hyperalgesia ihmisillä: molekyylimekanismit ja kliiniset näkökohdat. Clin J Pain. 2008;24:479-496.
4. Lee M, Silverman SM, Hansen H ym. kattava katsaus opioidien aiheuttamaan hyperalgesiaan. Kipulääkäri. 2011;14:145-161.
5. Mao J. Opioidien aiheuttama epänormaali kipuherkkyys: vaikutukset kliiniseen opioidihoitoon. Kipu. 2002;100:213-217.
6. Raffa RB, Pergolizzi JV Jr. Opioidien aiheuttama hyperalgesia: onko sillä kliinistä merkitystä kipupotilaiden hoidossa? Pain Manage Nurs. 2011;1-17.
7. Li X, Clark JD. Hyperalgesia opioidiabstinenssin aikana: glutamaatin ja aine P:n välittäminen. anesth analg. 2002;95:979-984.
8. Pud D, Cohen D, Lawental E, Eisenberg E. Opioidit ja epänormaali kiputuntemus: uutta näyttöä kroonisten opioidiriippuvaisten ja terveiden koehenkilöiden tutkimuksesta. Drug Alcohol Depend. 2006;82:218-223.
9. Malmberg AB, Yaksh TL. Selkärangan glutamaatti-tai aine P-reseptorin välittämä hyperalgesia, joka estyy selkärangan syklo-oksygenaasin estolla. Science. 1992;257:1276 -1279.
10. Fisher K, Coderre TJ, Hagen NA. N-metyyli-D-aspartaattireseptorin kohdentaminen kroonisen kivun hoidossa. Prekliiniset eläinkokeet, viimeaikaiset kliiniset kokemukset ja tulevaisuuden tutkimussuuntaukset. J Pain Symptom Manage. 2000;20:358-373.
11. Lötsch J. Opioidien metaboliitit. J Pain Symptom Manage. 2005;29:S10-S24.
12. Skarke C, Lötsch J. Morfiinin metaboliitit: kliiniset vaikutukset. Semin Anesth, Perioperative Med Pain. 2002;21:258-264.
13. Juni A, Klein G, Kest B. Morfiinin hyperalgesia hiirillä ei liity opioidien aktiivisuuteen, analgesiaan tai toleranssiin: todisteet monista erilaisista hyperalgesiajärjestelmistä. Brain Res. 2006;1070:35-44.
14. Angst M, Clark JD. Opioidien aiheuttama hyperalgesia: laadullinen systemaattinen katsaus. Anestesiologia. 2006;104:570-587.
15. Vanderah TW, Gardell LR, Burgess SE, et al. Dynorfiini edistää epänormaalia kipua ja selkärangan opioidien antinociceptiivistä toleranssia. J Neurosci. 2000;20:7074-7079.
16. Hooten WM, Mantilla CB, Sandroni P, Townsend CO. Lämpökivun havaitsemisen ja opioidiannoksen väliset yhteydet kroonista kipua sairastavilla potilailla, jotka ovat opioidien kapenemisvaiheessa. Pain Med. 2010;11:1587-1598.
17. Silverman S. Opioidien aiheuttama hyperalgesia: kliiniset vaikutukset kipulääkärille. Pain Physician. 2009;12:679-684.
18. Li SQ, Xing YL, Chen WN, et al. NMDA-reseptorin aktivoituminen liittyy COX-2:n ilmentymisen ylös-regulaatioon selkärangan selkärangan dorsaalisarvessa nociceptive inputsin aikana rotilla. Neurochem Res. 2009;34:1451-1463.
19. Okon T. Ketamiini: johdatus kipu- ja palliatiivisen lääketieteen lääkärille. Pain Physician. 2007;10:493-500.
20. Galer BS, Lee D, Ma T, et al. MorphiDex (morfiinisulfaatti/dekstrometorfaanihydrobromidiyhdistelmä) kroonisen kivun hoidossa: kolmessa monikeskuksisessa, satunnaistetussa, kaksoissokkokontrolloidussa, kontrolloidussa kliinisessä tutkimuksessa ei pystytä osoittamaan lisääntynyttä opioidianalgesiaa tai toleranssin vähentymistä. Pain. 2005;115:284-295.
21. Wiesenfeld-Hallin Z. Yhdistetyt opioidi-NMDA-antagonistihoidot. mitä etuja ne tarjoavat kipuoireyhtymien hallinnassa? Lääkkeet. 1998;55;1-4.
22. Vorobeychik Y, Chen L, Bush MC, Mao J. Opioidien analgeettinen vaikutus paranee opioidiannoksen pienentämisen jälkeen. Pain Med. 2008;9:724-727.
23. Baron MJ, McDonald PW. Merkittävä kivun väheneminen kroonisilla kipupotilailla suurten opioidiannosten vieroituksen jälkeen. J Opioid Manag. 2006;2:277-282.
24. Koppert W, Ihmsen H, Körber N, ym. buprenorfiinin aiheuttaman analgesian ja antihyperalgesian erilaiset profiilit ihmisen kipumallissa. Pain. 2005;118:15-22.
25. Pan ZZ. Kappa-opioidireseptorin Mu-oppositiovaikutukset. Trends Pharmacol Sci. 1998;19:94-98.
26. Ballantyne JC, Mao J. Kroonisen kivun opioidihoito. N Engl J Med. 2003;349:1943-1953.
27. Chapman CR, Lipschitz DL, Angst MS, et al. Opioidilääkehoito krooniseen ei-syöpäkipuun Yhdysvalloissa: tutkimusohjeistus näyttöpohjan kehittämiseksi. J Pain. 2010;11:807-829.