Vetysidoksen määritelmä
Vetysidos on vetovoima osittain positiivisesti varautuneen vedyn ja osittain negatiivisesti varautuneen atomin (happi ja typpi) välillä. Tämä on hyvin heikko sidos ja vetysidoksen vahvuus (5-10 Kcal sidosta kohti) on paljon pienempi kuin kovalenttisen sidoksen vahvuus. Vetysidokset esitetään yleensä kahden atomin välisenä katkoviivana. Esimerkiksi kahden vesimolekyylin välinen vetysidos on esitetty alla:
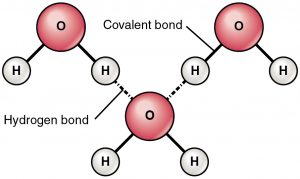
Vetysidoksen syy
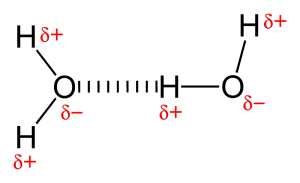
Hapen tai typen kaltaisen hyvin elektronegatiivisen atomin läsnäolon vuoksi hapen ja vedyn välinen jaettu elektronipari vetäytyy elektronegatiivisempaa atomia kohti. Tämä elektroniparin epätasainen jakautuminen johtaa kahden osittaisen dipolin muodostumiseen. Osittain positiivisesti varautunut vety vetää tällöin puoleensa toista osittain negatiivisesti varautunutta happea tai typpeä kutsutaan vetysidokseksi.
Vetysidoksen tyypit
Vetysidos voi tapahtua kahden saman molekyylin atomin välillä tai kahden eri molekyylin atomin välillä. Riippuen siitä, että vetysidoksia on kahta tyyppiä:
- Sisämolekulaarinen vetysidos
- Intramolekulaarinen vetysidos
Sisämolekulaarinen vetysidos
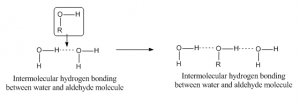
Kun vetysidos syntyy eri molekyylin atomien välille, niin sitä kutsutaan molekyylien väliseksi vetysidokseksi. Tällaista sidosta varten toisella molekyylillä tulisi olla osittain positiivinen vety akseptoriatomina ja toisella molekyylillä osittain negatiivinen tai luovuttajaatomi. Esimerkkinä aldehydin ja vesimolekyylin välinen vetysidos on esitetty alla:
2. Intramolekulaarinen vetysidos
Kun vetysidos tapahtuu saman molekyylin kahden osittain varautuneen atomin välillä, sitä kutsutaan intramolekulaariseksi vetysidokseksi. Tämä tapahtuu, kun kaksi funktionaalista ryhmää on samassa molekyylissä ja ne ovat siten, että ne voivat vetää toisiaan puoleensa muodostaen vetysidoksen. Esimerkiksi salisyylihapossa on kaksi funktionaalista ryhmää, alkoholi ja karboksyylihappo. Tällöin intramolekulaarinen vetysidos syntyy alkoholiryhmän vetyatomin ja karboksyylihapporyhmän happiatomin välille.
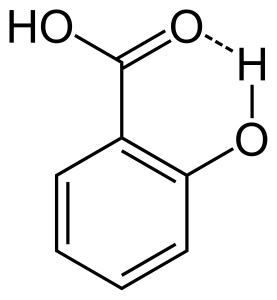
Vetysidoksen vaikutus
Kiehumispisteeseen
On odotettavissa, että saman tai samankaltaisen molekyylipainon omaavilla aineilla pitäisi olla sama tai samankaltainen kiehumispiste. Molekyylipainoltaan samankaltaisten eetterin ja alkaanin kiehumispisteet eivät ole kaukana toisistaan. Alkoholien kiehumispiste on kuitenkin paljon korkeampi kuin molekyylipainoltaan samanlaisen eetterin. Tämä voidaan selittää vetysidoksilla. Alkoholin kiehumispiste nousee vetysidosten vuoksi. Vetysidoksen katkaisemiseen tarvitaan ylimääräistä energiaa ennen kiehumista. Koska vetysidoksia ei ole, alkaaneilla ja eettereillä on alhainen kiehumispiste.

Liukoisuudesta
Alkoholit liukenevat veteen, mutta alkaanit eivät. Tämä johtuu siitä, että molekyylien väliset vetysidoksiset yhdisteet voivat liueta molekyylien väliseen vetysidoksiseen liuottimeen. Polaarinen molekyyli, kuten alkoholi, voi liittyä kahteen vesimolekyyliin muodostaen vetysidoksen, kun taas pooliton aine, kuten alkaanit, ei voi. Alkoholien hiiliketjun kasvaessa liukoisuus kuitenkin vähenee, koska pitkä ketju haittaa vetysidoksen muodostumista.
Yhteenveto
- Vetysidos on vetovoima osittain positiivisesti varautuneen vedyn ja osittain negatiivisesti varautuneen atomin välillä.
- Kun vetysidos syntyy eri molekyylin atomien välille, sitä kutsutaan molekyylien väliseksi vetysidokseksi.
- Kun vetysidos tapahtuu saman molekyylin kahden osittain varautuneen atomin välillä, sitä kutsutaan intramolekulaariseksi vetysidokseksi.
- Molekyylien välisen vetysidoksen vuoksi polaaristen yhdisteiden kiehumispiste on korkeampi kuin ei-polaaristen yhdisteiden kiehumispiste, joilla on sama a.
- Organisen yhdisteen vedyn ja veden välisen vetysidoksen vuoksi liukoisuus on jossain määrin mahdollista.