Esittely
Immunofluoresenssissa (IF) käytetään vasta-aineita ja fluoresoivaa havaitsemista tutkittaessa kohdeproteiinien lokalisaatiota, suhteellista ilmentymistä ja aktivoitumistiloja kiinnitetyissä soluissa tai kudoksissa. IF:tä käytetään laajalti monilla eri tutkimusaloilla.
IF:n avulla voidaan vastata esimerkiksi seuraaviin kysymyksiin:
- mitkä solut tai kudokset ilmentävät kohdeproteiini(e)a?
- Miten kohdeproteiinini ilmentyminen ja/tai aktivaatio muuttuu vasteena kokeellisiin häiriöihin?
- Mihin kohtaan solussa/kudoksessa kohdeproteiini on lokalisoitunut?
- Mikä on eri kohdeproteiinien välinen tilallinen suhde solu- tai kudosarkkitehtuurin yhteydessä?
Immunofluoresenssi käsittää useita toisiinsa liittyviä tekniikoita, jotka ovat kehittyneet ajan myötä. Kaikissa näissä tekniikoissa hyödynnetään biologisten kohteiden spesifistä tunnistamista vasta-aineilla ja fluoresoivien raportoijien havaitsemista sytometrisessä analyysissä. Sen varmistaminen, että biologinen näyte säilyy hyvin ja kohdeantigeenit ovat vasta-aineiden saatavilla, on tärkeää, mutta siihen voi liittyä haasteita, jotka vaihtelevat näytteen, kohteen ja vasta-aineen mukaan.
Tälle sivulle olemme koonneet resursseja, joiden avulla voit tutustua protokolliin, vastata yleisimpiin kysymyksiin ja suunnitella onnistuneita IF-kokeita.
Oikean IF-tekniikan ja -protokollan valitseminen
Optimaaliseen IF-tekniikkaan/-protokollaan vaikuttavat biologisen materiaalin tyyppi, näytteen käsittelyvaiheet, kohdeantigeenin ominaisuudet ja käytettävä vasta-aine.
Huomioon otettavia seikkoja ovat:
- Tulostusmateriaalit voivat olla viljeltyjä solulinjoja, jäädytettyä kudosta tai formaliiniin kiinnitettyä, parafiiniin upotettua (FFPE) kudosta.
- Viljeltyjä solulinjoja ja primaarisia soluja varten etsi vasta-aineita, jotka on validoitu immunofluoresenssi-immunosytokemiaan (IF-IC).
- Monissa laboratorioissa ”immunohistokemiaa/IHC:tä” käytetään yleisnimityksenä, joka kattaa kudoksen, joka on joko parafiiniin sulautettu tai pakastettu, ja sitä voidaan käyttää sisältämään sekä kromogeenisen että fluoresoivan osoituksen. cellsignal.com-sivustolla sovelluksissa erotetaan toisistaan jäädytetyt (IF-F) ja parafiiniin sulautetut kudosvalmisteet.
- FFPE-kudosnäytteiden osalta immunohistokemiaan (IHC-P) validoituja vasta-aineita voidaan käyttää myös fluoresoivalla detektiolla ilman vahvistusta, jos kohdeantigeenia on runsaasti, tai multipleksoidussa IHC:ssä (mIHC), jossa signaalia on vahvistettu.
- Vastaaine voidaan validoida yhteen tai useampaan edellä luetelluista sovelluksista. Protokollasuositukset ovat tulosta tutkijoiden validointiprosessin aikana tekemistä testeistä.
- Tuotekohtaiset protokollat löytyvät kunkin tuotteen verkkosivuilta. IF-validoitujen vasta-aineiden osalta valitse ”IF” tuotesivulla nähdäksesi IF-validointitiedot ja -protokollan. Kunkin vasta-aineen perustiedot (laimennokset/työkonsentraatio, validoidut sovellukset, lajireaktiivisuus, isäntälajit) löytyvät tuotetiedotteesta.
- Yleisimmin käytetyt IF-protokollat löytyvät myös protokollasivulta.
- Etkö tarvitse tai halua käyttää fluoresenssidetektiota kudosnäytteissäsi? Vaihtoehtoinen lähestymistapa on kromogeeninen detektointi, jota käsitellään IHC-sivulla.
Vasta-aineiden valinta IF:tä varten: vasta-aineiden validoinnin merkitys
Parhaat vasta-aineet tuottavat vahvan, spesifisen signaalin minimaalisella taustalla. On tärkeää valita vasta-aineet, jotka on validoitu käyttämässäsi sovelluksessa. Vasta-aineen validointi IF:ssä voi sisältää positiivisia ja negatiivisia ekspressiokokeita (käyttäen knockout-solulinjoja, geneettisiä malleja, CRISPR:ää tai RNAi:tä), kohdeproteiinin lokalisaation tai posttranslationaalisten modifikaatioiden kokeellista manipulointia ja protokollan optimointia.
Vasta-aineen suorituskyky vaihtelee sovelluksittain. Vasta-aine, joka toimii hyvin esimerkiksi western blot -kokeessa, voi toimia tai olla toimimatta IF:ssä. Uusien vasta-aineiden testauksen aikana joillakin vasta-aineilla on vähäistä kohteen ulkopuolista sitoutumista; näitä vasta-aineita ei koskaan suositella IF- tai muihin kuin WB-sovelluksiin. Lisäksi vasta-aine voi toimia hyvin pakastekudoksessa mutta ei FFPE-kudoksessa tai päinvastoin. Vasta-aineen herkkyys ja suorituskyky voivat muuttua riippuen siitä, miten näyte on kiinnitetty ja käsitelty sekä vasta-aineen työskentelyolosuhteista.
Kun olet päättänyt, minkä tyyppisiä biologisia näytteitä käytät kokeessasi ja miten ne valmistetaan, helpoin tapa selata vasta-aineita cellsignal.com-sivustolla on valita ensin sopiva sovellus. Sen jälkeen voit syöttää hakusanoja tai valita muita ominaisuuksia (kuten isäntälaji, tutkimusalue jne.) tarkentaaksesi hakua ja valitaksesi vasta-aineen, joka on validoitu tarvitsemassasi sovelluksessa.
Kontrollikokeiden suunnittelu IF:tä varten
Voidaksesi luottaa koesuunnitelmaan ja tuloksiin sekä siihen, että vasta-aineesi raportoi uskollisesti kohteensa, positiiviset ja negatiiviset kontrollikokeet voivat olla informatiivisia. Esimerkiksi:
- Sekundäärikontrollit voivat kertoa, onko sekundäärivasta-aineen sitoutuminen epäspesifistä.
- Varmista primaarivasta-aineen spesifisyys suunnittelemalla Knockout/siRNA-kokeita tai vertaamalla tunnetusti ekspressoivia ja ei-ekspressoivia solulinjoja.
- Yksittäistä kohdetta koskevia kokeita käytetään spektraalisen sekoittumattoman kuvantamisen määrittämisessä. Tämäntyyppinen koe voi auttaa määrittämään, johtuuko värjäytymisen puute steriilisestä esteestä, jota esiintyy, kun kaksi antigeenia on lähellä toisiaan.
- Käsittele näytteitä fosfataasilla, jotta voit varmistaa, että fosforispesifiset vasta-aineet tunnistavat IF:ssä vain fosforyloituneen kohteen.
- Jos epäilet fiksaatioon tai permeabilointiin liittyviä ongelmia, vianmäärityksessä voi olla apua tarkistamisesta vasta-aineella, joka on toiminut laboratoriossasi aiemmin.
Cell Signaling Technologyn (CST) tiedemiehet suorittavat rutiininomaisesti tämäntyyppisiä tarkastuksia osana validointiprosessiamme (katso esimerkki). Voi olla kannattavaa perustaa samanlaisia kontrolleja omassa kokeellisessa mallijärjestelmässäsi, erityisesti jos sinulla on vaikeuksia saada haluamiasi tuloksia.
Primääriset vs. sekundääriset vasta-aineet ja suora vs. epäsuora värjäys
Primääriset vasta-aineet tarjoavat kohdeantigeenin spesifisen tunnistuksen. Sekundääriset vasta-aineet sitoutuvat primaarisiin vasta-aineisiin sen lajin perusteella, jossa ne on kasvatettu. Primäärivasta-aineet, jotka on kasvatettu kaniinissa tai hiiressä, voidaan havaita vastaavasti anti-kaniini- tai antihiirivasta-aineilla.
Primäärivasta-aineen ja sekundäärivasta-aineen (joka on spesifinen primäärivasta-aineen isäntälajille), joka on konjugoitu fluorofooriin, yhdistämistä kutsutaan epäsuoraksi värjäykseksi. Fluoroforeihin konjugoitujen primaarivasta-aineiden käyttöä ilman sekundaarivasta-aineita kutsutaan suoraksi värjäykseksi. Suorat värjäysmenetelmät säästävät aikaa ja mahdollistavat multipleksoinnin käyttämällä samassa isäntälajissa kasvatettuja vasta-aineita. Epäsuora värjäys tarjoaa perinteisesti suuremman herkkyyden signaalin vahvistumisen ansiosta, joka tapahtuu, kun useat sekundääriset vasta-aineet sitoutuvat yhteen primaariseen vasta-aineeseen.
Muitakin muunnelmia näistä tekniikoista on saatavilla, kuten biotinyloitujen primaaristen vasta-aineiden käyttö avidiiniin/streptavidiiniin konjugoidun fluorokromin kanssa. Fluorofoorikonjugoidut F(ab’)2-sekundäärivasta-ainefragmentit (joista puuttuu Fc-domeeni) voivat auttaa vähentämään taustaa. mIHC:ssä käytetään piparjuuriperoksidaasiin (HRP) konjugoituja sekundäärivasta-aineita katalysoimaan tyramidi-fluoroforikonjugaattien laskeutumista.
Vasta-aineiden fluorofoorien valinta
Vasta-aineiden fluorofoorien valinta
Vasta-aineiden fluorofoorien valinta
Miten monta kohdetta/vasta-ainetta voidaan multipleksoida?
Multipleksoinnissa käytetään useamman kuin yhden kohteen havaitsemista kerrallaan useiden vasta-aineiden avulla ja eri aallonpituuksien (värien) havaitsemista kunkin kohteen osalta. Epäsuorassa värjäyksessä multipleksointikyky perustuu fluorofoorikonjugoitujen, lajispesifisten sekundäärivasta-aineiden yhdistämiseen kuhunkin primaarivasta-aineeseen. Erilaisiin isotyyppeihin kuuluvia hiiren vasta-aineita voidaan myös multipleksoida käyttämällä isotyyppispesifisiä sekundääriväriaineita, jolloin voidaan havaita jopa 5 hiiren vasta-ainetta kerralla. Suoraa värjäystä varten kukin primaarivasta-aine on kytkettävä eri fluoroforiin. Tämä mahdollistaa useiden saman lajin/isotyypin vasta-aineiden yhdistämisen ja myös ”hiiri hiirellä” -värjäyksen, koska hiiren vasta-aineiden epäspesifinen sitoutuminen hiiren kudokseen ei ole ongelma.
Multipleksi-IF-kokeita suunniteltaessa on otettava huomioon fluoresenssimikroskoopin spektriominaisuudet, mukaan luettuina käytettävissä olevat herätteen lähteet ja suodatussarjat, jotta vältetään spektraalinen läpilyönti. Nykyaikaisilla epifluoresenssi- ja konfokaalisilla fluoresenssimikroskoopeilla on tyypillisesti kyky erottaa 3 tai useampia kanavia.
Vasta-ainevärjäyksen yhdistäminen väriaineisiin tai tunnisteisiin
Soluväriaineet, jotka levitetään fiksaation jälkeen, tai fiksoitavat elävien solujen merkinnät voidaan sisällyttää IF-työnkulkuun. Organellien leimausta käytetään usein kohteen subcellulaarisen lokalisoinnin todentamiseen. Ekspressoituja merkkejä, kuten GFP:tä, käytetään usein transfektoitujen solujen seuraamiseen tai mosaiikkikokeissa; jos GFP:n fluoresenssisignaali on heikko, IF:ssä voidaan käyttää anti-GFP-vasta-ainetta. Väriaineiden tai fluoresoivien proteiinien käyttö vie fluoresenssikanavia, jolloin vasta-aineille jää vähemmän vapaata tilaa.
Fluorofoorien valitseminen koetta varten
Tämä riippuu käytettävissäsi olevan herätelähteen spektriominaisuuksista ja heräte/emissiosuodatuksesta. Arvioi fluorofoorin heräte- ja emissioprofiili ennen kokeen suorittamista fluoresenssin läpilyönnin välttämiseksi. CST tarjoaa erilaisia fluorofoorikonjugoituja primaari- ja sekundäärivasta-aineita, mukaan lukien Alexa Fluor® -sarjan väriaineet.
Näytteen valmistelu
Kudos
Kudosleikkeet voidaan valmistaa joko pakastamalla nopeasti optimaalisessa leikkauslämpötilassa (OCT) olevassa väliaineessa tai kiinnittämällä ja upottamalla parafiiniin. Pakastetut näytteet voidaan leikata kryostaatilla ja antaa niiden kuivua ilmakuivana objektilasilla 10-15 minuuttia ennen kiinnittämistä ennen seuraavaa vaihetta. FFPE-kudosnäytteiden osalta keräys-, fiksaatio- ja parafiiniin upottamisvaiheita koskevat vaatimukset voivat vaihdella kudostyypeittäin.
Pakastettu vs. FFPE-kudos
Yleisesti FFPE-kudos antaa paremman morfologian kuin OCT:hen upotettu pakastettu kudos. Tämä saattaa helpottaa positiivisten solujen kvantifiointia tai värjäysten välisten rajojen tunnistamista. FFPE-kudos on myös hyvin stabiili; kun kudos on upotettu, kudoslohkoja voidaan säilyttää vuosia. Tämäntyyppistä kudosta on myös helpompi kuljettaa laboratorioiden välillä, ja se on suositeltavin käsittelymenetelmä ihmisen patologianäytteille.
Toisaalta FFPE-kudoksessa suoritetaan useita ylimääräisiä käsittelyvaiheita, jotka vähentävät antigeenin kokonaismäärää proteiinien hajoamisen vuoksi, vaativat peittämisvaiheita jäljelle jäävän antigeenin havaitsemiseksi ja pahentavat aldehydin aiheuttamaa autofluoresenssia. Ellei kyseessä ole erittäin runsasproteiininen proteiini, jäljelle jäävää antigeenia voi olla vaikea havaita epäsuoralla IF-menetelmällä, ja se saattaa vaatia monistamista sopivan värjäyksen aikaansaamiseksi. On myös mahdollista, että antigeenin talteenotto saattaa paljastaa antigeenejä, joita ei normaalisti havaittaisi, ja vasta-aine, joka muuten antaa odotetun värjäytymismallin, saattaa antaa epäspesifisen värjäytymisen. Yhtä hyvin on mahdollista työskennellä kohteen kanssa, jossa kohde-epitoopin havaitseminen edellyttää erityistä antigeenin talteenottomenetelmää. Siksi on tärkeää harkita, miten vasta-aine on validoitu ja mitä vaiheita sen käyttäminen edellyttää.
OCT:hen upotetun pakastekudoksen tapauksessa käsittelyn vähentäminen asetetaan morfologian edelle. Tämä on nopein menetelmä immunovärjäystulosten saamiseksi, koska objektilasit ovat käyttövalmiita sillä hetkellä, kun kudos leikataan, ja ennen upottamista on vähemmän käsittelyvaiheita. Proteiinien hajoaminen on vähäisempää, ja enemmän antigeeniä on käytettävissä vasta-aineen sitomiseen ilman, että tarvitaan ylimääräisiä, vaativia talteenottovaiheita. Koska tämä menetelmä ei vaadi monistamista, se on herkempi kudoksen laadulle. Kiinnitystyyppi (alkoholi vs. aldehydi), kesto (jotkin kohteet, kuten transkriptiotekijät, vaativat lyhyemmän kiinnitysajan) ja kudoksen ikä (erityisesti leikkelyn jälkeen) ovat kaikki tärkeitä tekijöitä, ja ne vaihtelevat kohteittain. Jäädytetyn kudoksen käyttäminen antaa enemmän joustavuutta kohteen valinnassa, koska käsittely voi tapahtua leikkaamisen jälkeen, mikä mahdollistaa paremman mukauttamisen määrityksen suunnittelussa.
Viljellyt solut
Solut on kylvettävä tukimateriaalille, joka on yhteensopiva fluoresenssimikroskopian kanssa. Tyypillisiä tukimateriaaleja ovat lasipohjaiset soluviljelymaljat, polylysiinillä ja/tai solunulkoisen matriksin komponenteilla valmistetut lasiset kansilevyt (joita säilytetään muoviviljelymaljoissa), jotka on valmistettu tukemaan tarttuvaa soluviljelyä, sekä kaupallisesti saatavilla olevat monikaivokammiot, jotka on kiinnitetty mikroskooppien kanssa yhteensopiviin lasilevyihin.
Huomaa, että soluviljelyolosuhteet voivat vaikuttaa solujen terveydentilaan, morfologiaan ja kohdeproteiinisi ilmentymiseen/paikallistumiseen, ja ne voivat viime kädessä vaikuttaa IF-tietojesi laatuun. Varmista, että solusi ovat terveitä tarkistamalla säännöllisesti kasvatusmedia pH:n muutosten varalta ja tarkastelemalla solustressin merkkejä (kuten monitumaisia soluja) pienellä suurennoksella mikroskoopilla. Tarkista myös, että solujen konfluenssi on sopiva solutyypille ja kohteelle.
Näytteen fiksaatio
Ideaalinen fiksatiivi säilyttää ”elämänkaltaisen” tilannekuvan samalla, kun se pysäyttää nopeasti hajoamisprosessin eli autolyysin ristisilloittamalla ja inhiboimalla endogeenisiä entsyymejä, ja se esittää antigeenin vasta-aineen tunnistettavaksi. Valitettavasti ei ole olemassa yhtä ainoaa fiksaatiomenetelmää, joka toimisi ihanteellisesti jokaiselle näytteelle ja jokaiselle antigeenille. Jopa saman kohdeproteiinin eri antigeenien välillä voi olla eroja eri menetelmien välillä. Tämän vuoksi paras protokolla voi vaihdella paitsi näytetyypeittäin myös epitoopeittain (ja vasta-aineittain).
Kudos
Tuoreen pakastetun kudoksen osalta jäädytetyt ja kryostaattileikatut leikkeet on nyt käsiteltävä fiksatiivilla. Vaihtoehtoisesti kudosnäytteet voidaan säilyttää fiksoimalla ensin transkardiaalisella perfuusiolla tai upottamalla, jälkifiksaatio- ja kryosäilytysvaiheilla, minkä jälkeen ne pakastetaan ja leikataan.
FFPE-kudoskäsittelyssä kudos säilytetään upottamalla se fiksoimalla formaliinilla (tai muulla aldehydipohjaisella fiksaatioaineella) tai perfuusiolla edellä mainitulla tavalla, minkä jälkeen kudos upotetaan parafiiniin ja leikataan. Ennen inkubointia vasta-aineen kanssa leikkeet on deparafinoitava, rehydraatio ja antigeenin talteenotto, jotta vasta-aineet pääsevät näytteeseen ja sitoutuvat kohdemolekyyleihin.
Solut
Solujen huuhtelu lämpimällä proteiinittomalla väliaineella tai PBS:llä välittömästi ennen fiksaatiota voi estää solunulkoisten proteiinien ja roskien saostumisen. Nopea fiksaatio saadaan aikaan vaihtamalla väliaine nopeasti fiksatiiviliuokseen.
Aldehydifiksaatio vs. alkoholifiksaatio
Aldehydipohjaisia fiksatiiveja, kuten formaldehydiä, formaliinia (liuenneen formaldehydin ja pienemmän metanoliprosenttiosuuden seos) ja glutaraldehydiä, käytetään yleisimmin silloin, kun rakenteen säilyminen on ensiarvoisen tärkeää. Useimmille vasta-aineille CST suosittelee kiinnittämistä 4 prosentin formaldehydillä (metanoliton). Aldehydit reagoivat soluproteiinien primaaristen amiinien kanssa ja sitovat ne ristiin ja stabiloivat näytteen. Lisäksi solujen entsyymit, mukaan lukien fosfataasit ja proteaasit, deaktivoituvat ristisilloituksessa. Aldehydit läpäisevät plasmakalvon ja kiinnittävät liukoisia proteiineja paremmin kuin alkoholit, mutta jotkin kohteet voivat menettää antigeenisyytensä aldehydien ristisilloittamisen myötä.
Dehydratoivat/denaturoivat alkoholin kiinnitysaineet, kuten metanoli, syrjäyttävät vettä solumakromolekyylien ympäriltä, jolloin ne denaturoituvat ja saostuvat in situ. Kohteena olevan proteiinin denaturoituminen voi paljastaa hautautuneita epitooppeja, mikä tekee tästä lähestymistavasta edullisemman kuin aldehydifiksaatio joidenkin vasta-aineiden osalta. Dehydratoivat fiksatiivit soveltuvat kuitenkin huonommin liukoisille kohteille ja modifikaatiotilaspesifisille vasta-aineille, kuten fosforivasta-aineille. Tarkista tuotteen tietolehdestä optimaalinen fiksaatiomenetelmä.
Permeabiloivan aineen valinta
Jos käytetään ristisilloittavaa fiksatiivia, plasmakalvo on edelleen ehjä, jolloin solunsisäiset kohteet eivät ole vasta-aineiden saavutettavissa. Siksi permeabilointi olisi suoritettava ristisilloitusfiksoinnin jälkeen, elleivät vasta-aineesi tunnista solunulkoisia epitooppeja. Optimaalinen permeabilointimenetelmä vaihtelee vasta-aineesta riippuen; tarkista aina tuotesivulta suositeltu protokolla.
Triton® X-100 -permeabiloinnin käyttö fiksaation jälkeen on yleistä. Triton ja muut detergentit, kuten NP-40, TWEEN®, Saponin, Digitonin ja DOTMAC, ovat vuorovaikutuksessa solukalvojen kanssa luoden vaihtelevan kokoisia ”huokosia” ja sallien vasta-aineen pääsyn.
Vaihtoehtoisesti voidaan suorittaa alkoholipermabilointi etanolilla tai metanolilla fiksaatiovaiheen jälkeen. Tässä menetelmässä yhdistyvät ristisilloittavien fiksatiivien nopea kiinnittyminen sekä proteiinien denaturoituminen ja kalvon delipidoituminen. Tämä voi parantaa signaalia tietyille kohteille, erityisesti niille, jotka liittyvät organelleihin tai sytoskelettiin.
Mitä fiksaatio-/permabilaatio-olosuhteita käytän, kun teen multipleksointia?
Jos teet multipleksointia sellaisten vasta-aineiden kanssa, jotka vaativat erilaisia CST-protokollia, sinun on ehkä asetettava etusijalle se, mitä vasta-ainetta käytät sen optimaalisissa olosuhteissa. Esimerkki mIHC:ssä suoritetusta järjestyksen optimoinnista on esitetty tässä sovellusohjeessa (PDF). Pienimuotoisen koeajon suorittaminen vertailemalla eri protokollia voi olla informatiivista ennen kokeiden skaalaamista.
Blokkausreagenssin valitseminen
Yleisin suositus on 5 %:n normaali vuohen seerumi (tai seerumi, joka on peräisin samasta lajista kuin sekundäärivasta-aineen seerumi) PBS:ssä + 0,3 %:n Triton® X-100. Tarkista tietolehdestä suositeltu estoaine.
Jos näytteessä on Fc-reseptoreita, vasta-ainesignaali tulee sekoituksesta, joka koostuu spesifisestä kohdetunnistuksesta (vasta-aineen antigeenin sitoutumiskohdan/vaihtelevan alueen kautta) sekä epäspesifisestä absorptiosta, joka johtuu vasta-aineen raskaan ketjun sitoutumisesta Fc-reseptoreihin. Eläinten seerumissa oleva kokonais-IgG estää Fc-reseptoreita estääkseen primaari- ja sekundäärivasta-aineiden sitoutumisen ja vähentääkseen taustakohinaa. Valitsemalla fluorofoorikonjugoituja F(ab’)2-fragmentteja vältetään myös sekundäärisen vasta-aineen (mutta ei primaarisen vasta-aineen)
Muissa vasta-aineisiin perustuvissa sovelluksissa, kuten western blottauksessa, estovaiheet vähentävät taustasignaalia, joka aiheutuu primaaristen ja sekundaaristen vasta-aineiden epäspesifisestä, alhaisemman affiniteetin sitomisesta muihin kohtiin kuin tarkoitettuun kohteeseen. Olemme kuitenkin havainneet, että rekombinanttiset kanin monoklonaaliset vasta-aineet, jotka on testattu tiukasti IF:ssä, toimivat hyvin monissa näytteissä blokkauksen kanssa tai ilman sitä. Viime kädessä immunofluoresenssissa validoitujen laadukkaiden vasta-aineiden valitseminen auttaa pitkälle taustakohinan välttämisessä.
Vasta-aineen konsentraatio ja signaali-kohinasuhde IF:ssä
Signaali-kohinasuhde (signaali-kohinasuhde, S/N) liittyy vasta-aineen spesifisyyteen ja herkkyyteen tietyssä sovelluksessa. S/N voidaan laskea vertaamalla fluoresenssin voimakkuuden ”signaalia” soluissa, jotka ilmentävät kiinnostuksen kohteena olevaa kohdetta, niiden solujen ”taustakohinaan”, joissa ei ole ilmentymistä. Jos vasta-ainetta käytetään liian pieninä pitoisuuksina, fluoresenssisignaali on liian himmeä erotettavaksi taustakohinasta. Toisaalta liian suuri konsentraatio lisää taustavärjäytymistä, jolloin S/N pienenee. Tarkista aina tuotteen tietolehdestä suositeltu laimennos, joka perustuu vasta-aineen validoinnin aikana suoritettuihin titrauksiin.
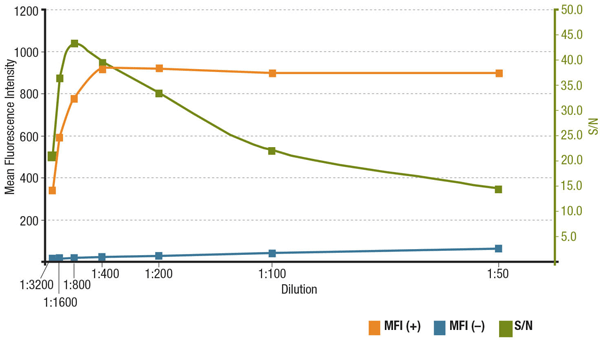
S/N-analyysi MUC1 (D9O8K) XP® Rabbit mAb #14161 -laimennokselle. Keskimääräisen fluoresenssin intensiteetin kvantitointi ilmentävissä (MFI(+), oranssi) ZR-75-1-soluissa ja ei-ilmentävissä (MFI(-), sininen) HCT 116 -soluissa sekä laskettu S/N (vihreä).
Analyysi S/N:stä MUC1 (D9O8K) XP® Rabbit mAb #14161 -laimennokselle. Keskimääräisen fluoresenssin intensiteetin kvantitointi ekspressoivissa (MFI(+), oranssi) ZR-75-1-soluissa ja ei-ekspressoivissa (MFI(-), sininen) HCT 116 -soluissa sekä laskettu S/N (vihreä).
Vasta-aineen inkubaatioaika
Yleisesti yön yli tapahtuva inkubaatio 4 °C:ssa johtaa voimakkaaseen signaaliin. Inkubaatioajan ja lämpötilan muuttaminen voi muuttaa signaalia ja S/N:ää. Eri vasta-aineet voivat reagoida muuttuneisiin inkubaatio-olosuhteisiin eri tavoin; lisätietoja on tässä blogikirjoituksessa.
Tarvitaanko IF:n suorittamiseen konfokaalimikroskooppi?
IF voidaan suorittaa millä tahansa fluoresenssimikroskoopilla, jossa on asianmukainen herätelähde ja suodatus, mukaan lukien epifluoresenssi-, skannaava- ja pyörivälevyiset konfokaalimikroskoopit. Immunofluoresenssi on myös yleensä yhteensopiva erikoistuneiden fluoresenssitekniikoiden kanssa, mukaan lukien sisäinen kokonaisheijastusfluoresenssi (Total Internal Reflection Fluorescence, TIRF), valolehtimikroskopia ja jotkin superresoluutiotekniikat.
Yhteensopivuus automatisoidun korkean läpimenotehon seulonnan/korkean analyysin (High Content Analysis, HCA) kanssa
Kaikkea immunofluoresenssia (IF-IC:tä) varten sallittua vasta-ainetta voidaan käyttää korkean läpimenotehon (High Throughput Seulonta) -seulonnassa (High Throughput Screening) ja korkean analyysin menetelmissä (High Content Analysis). Nämä kokeet perustuvat tavanomaisiin IF-tekniikoihin, joihin sisältyy automaatio.
Kohtaatko ongelmia IF-kokeen kanssa? Klikkaa tästä saadaksesi vianmääritysohjeet.
Cell Signaling Technology, CST ja XP ovat Cell Signaling Technology, Inc:n tavaramerkkejä. Kaikki muut tavaramerkit ovat omistajiensa omaisuutta.