Au début de la chimie organique, les alcènes étaient décrits comme « insaturés » car, contrairement aux alcanes « saturés », on trouvait qu’ils réagissaient facilement avec des substances telles que les halogènes, les halogénures d’hydrogène, les agents oxydants, et ainsi de suite. Par conséquent, l' »affinité chimique » des alcènes était considérée comme insatisfaite ou « insaturée ». (Voir aussi la section 1-1I.)
Une des raisons pour lesquelles les alcènes et les alcynes réagissent plus facilement que les alcanes est que les liaisons carbone-carbone d’une liaison multiple sont individuellement plus faibles que les liaisons simples carbone-carbone normales. Considérez les énergies de liaison impliquées. D’après le tableau 4-3, les forces des liaisons simples, doubles et triples carbone-carbone sont respectivement de \(83 \), \(146 \), et \(200 \ : \text{kcal}\). À partir de ces valeurs, nous pouvons calculer que le clivage de la moitié d’une double liaison carbone-carbone devrait nécessiter \(63 \ : \text{kcal}\) et le clivage du tiers d’une triple liaison carbone-carbone devrait nécessiter \(54 \ : \text{kcal}\):

En conséquence, les réactions d’addition aux liaisons multiples devraient être d’environ \(20 \)-\(30 \ : \text{kcal}\) plus exothermiques que les réactions de clivage correspondantes des liaisons simples carbone-carbone, comme estimé ici pour la réaction avec le brome :
La différence substantielle entre les chaleurs de réaction de l’éthane, de l’éthène et de l’éthyne avec le brome se reflète dans une considération pratique très importante dans la manipulation de l’éthyne (acétylène), à savoir sa stabilité thermodynamique par rapport au carbone solide et à l’hydrogène gazeux. Contrairement à l’éthane, on peut montrer, à partir des énergies de liaison, que l’éthène et l’éthyne sont instables par rapport à la formation de carbone solide et d’hydrogène gazeux :
Bien que cela ne semble pas poser de problèmes particuliers avec l’éthène, une décomposition explosive de l’éthyne en carbone et en hydrogène peut se produire si le gaz est comprimé à \(10\) -\(20\ : \text{kg cm}^{-2}\). Même l’éthyne liquide (bp \sim 83^\text{o}\)) doit être manipulé avec précaution. L’éthyne n’est pas utilisé commercialement sous pression, sauf s’il est mélangé à un gaz inerte et manipulé dans un équipement robuste. L’éthyne brûle avec de l’oxygène pur pour donner une flamme très chaude qui est largement utilisée pour le soudage. À cette fin, le gaz est dissous sous environ \(15 \ : \text{kg cm}^{-2}\) dans du 2-propanone (acétone, 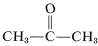 , pb \(56,5^\text{o}\)) et contenu dans des cylindres emballés avec de la terre de diatomée.
, pb \(56,5^\text{o}\)) et contenu dans des cylindres emballés avec de la terre de diatomée.
Pourquoi l’éthyne est-il tellement moins stable que l’éthène ou l’éthane ? Tout d’abord, les liaisons \(\ce{C-C}\) ne sont pas aussi fortes que les liaisons \(\ce{C-H}\). Il faut donc s’attendre à un gain de stabilité lorsque les liaisons \(\ce{C-H}\) sont établies au détriment des liaisons \(\ce{C-C}\) ; l’éthène et l’éthane ont chacun plus de liaisons \(\ce{C-H}\) que l’éthyne. Deuxièmement, l’éthyne possède six électrons maintenus entre les deux carbones et ces électrons subissent une répulsion interélectronique mutuelle considérable. Cela explique le fait que la force moyenne de la liaison \(\ce{C-C}\) pour la triple liaison d’un alcyne est \(200/3 = 67 \ : \text{kcal}\), comparé à \(146/2 = 73 \ : \text{kcal}\) pour la double liaison d’un alcène et \(83 \ : \text{kcal}\) pour une liaison simple normale d’un alcane.
- John D. Robert et Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, deuxième édition. W. A. Benjamin, Inc. Menlo Park, CA. ISBN 0-8053-8329-8. Ce contenu est protégé par le droit d’auteur dans les conditions suivantes : » Vous êtes autorisé à reproduire, distribuer, afficher et exécuter cette œuvre à titre individuel, à des fins éducatives, de recherche et à des fins non commerciales, sous quelque format que ce soit. «