Évaporation
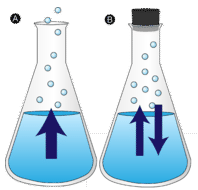
Une flaque d’eau laissée sans être perturbée finit par disparaître. Les molécules liquides s’échappent dans la phase gazeuse, devenant de la vapeur d’eau. La vaporisation est le processus par lequel un liquide est transformé en gaz. L’évaporation est la conversion d’un liquide en sa vapeur en dessous de la température d’ébullition du liquide. Si l’eau est au contraire conservée dans un récipient fermé, les molécules de vapeur d’eau n’ont aucune chance de s’échapper dans l’environnement et le niveau de l’eau ne change donc pas. Lorsque certaines molécules d’eau se transforment en vapeur, un nombre égal de molécules de vapeur d’eau se condense pour revenir à l’état liquide. La condensation est le changement d’état d’un gaz à un liquide.
Pour qu’une molécule liquide s’échappe à l’état gazeux, la molécule doit avoir suffisamment d’énergie cinétique pour surmonter les forces d’attraction intermoléculaires dans le liquide. Rappelons qu’un échantillon liquide donné contient des molécules ayant une large gamme d’énergies cinétiques. Les molécules liquides qui ont ce certain seuil d’énergie cinétique s’échappent de la surface et deviennent de la vapeur. En conséquence, les molécules liquides qui restent ont maintenant une énergie cinétique plus faible. Au fur et à mesure de l’évaporation, la température du liquide restant diminue. Vous avez observé les effets du refroidissement par évaporation. Par une journée chaude, les molécules d’eau de votre transpiration absorbent la chaleur corporelle et s’évaporent de la surface de votre peau. Le processus d’évaporation laisse la transpiration restante plus froide, qui absorbe à son tour plus de chaleur de votre corps.
Un liquide donné s’évapore plus rapidement lorsqu’il est chauffé. Cela est dû au fait que le processus de chauffage fait qu’une plus grande fraction des molécules du liquide a l’énergie cinétique nécessaire pour s’échapper de la surface du liquide. La figure ci-dessous montre la distribution de l’énergie cinétique des molécules de liquide à deux températures. Le nombre de molécules qui ont l’énergie cinétique nécessaire pour s’évaporer est indiqué dans la zone ombrée sous la courbe à droite. Le liquide à température plus élevée \(\left( T_2 \right)\) possède plus de molécules capables de s’échapper dans la phase vapeur que le liquide à température plus basse \(\left( T_1 \right)\).

A 29 029 pieds \(\left( 8848 \ : \text{m} \right)\), le mont Everest dans la chaîne de l’Himalaya à la frontière entre la Chine et le Népal est le point le plus élevé de la planète. Son altitude pose de nombreux problèmes pratiques aux alpinistes. La teneur en oxygène de l’air est beaucoup plus faible qu’au niveau de la mer, d’où la nécessité d’emporter des bouteilles d’oxygène (bien que quelques alpinistes aient atteint le sommet sans oxygène). Un autre problème est celui de l’ébullition de l’eau pour la cuisson des aliments. Alors que l’eau bout à 100° au niveau de la mer, le point d’ébullition au sommet de l’Everest n’est que de 70°. Cette différence rend très difficile l’obtention d’une tasse de thé décente (ce qui a certainement frustré certains des alpinistes britanniques).