Gaz réels et idéaux
Un gaz idéal est un gaz qui suit les lois des gaz dans toutes les conditions de température et de pression. Pour ce faire, le gaz devrait se conformer complètement à la théorie cinétique-moléculaire. Les particules de gaz doivent occuper un volume nul et ne doivent présenter aucune force d’attraction les unes envers les autres. Comme aucune de ces conditions ne peut être remplie, il n’existe pas de gaz idéal. Un gaz réel est un gaz qui ne se comporte pas selon les hypothèses de la théorie cinétique-moléculaire. Heureusement, dans les conditions de température et de pression que l’on rencontre normalement dans un laboratoire, les gaz réels ont tendance à se comporter très largement comme des gaz idéaux.
Dans quelles conditions alors les gaz se comportent-ils le moins idéalement ? Lorsqu’un gaz est soumis à une pression élevée, ses molécules sont forcées de se rapprocher car l’espace vide entre les particules est diminué. Une diminution de l’espace vide signifie que l’hypothèse selon laquelle le volume des particules elles-mêmes est négligeable est moins valable. Lorsqu’un gaz est refroidi, la diminution de l’énergie cinétique des particules entraîne leur ralentissement. Si les particules se déplacent à une vitesse plus lente, les forces d’attraction entre elles sont plus importantes. Une autre façon de voir les choses est que le refroidissement continu du gaz finira par le transformer en liquide et un liquide n’est certainement plus un gaz idéal (voir l’azote liquide dans la figure ci-dessous). En résumé, un gaz réel s’écarte le plus d’un gaz idéal à basse température et à haute pression. Les gaz sont les plus idéaux à haute température et à basse pression.

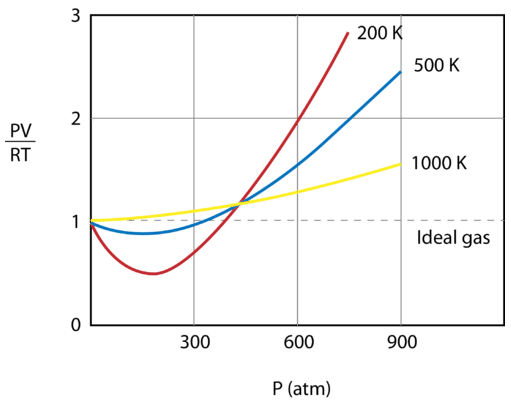
La figure ci-dessous montre un graphique de \(\frac{PV}{RT}\) en fonction de la pression pour \(1 \ : \text{mol}\) d’un gaz à trois températures différentes – \(200 \ : \text{K}\), \(500 \ : \text{K}\), et 1000 \ : \text{K}\). Un gaz idéal aurait une valeur de 1 pour ce rapport à toutes les températures et pressions et le graphique serait simplement une ligne horizontale. Comme on peut le voir, des déviations par rapport à un gaz idéal se produisent. Lorsque la pression commence à augmenter, les forces d’attraction font que le volume du gaz est moins important que prévu et la valeur de \(\frac{PV}{RT}\) passe sous 1. Si l’augmentation de la pression se poursuit, le volume des particules devient significatif et la valeur de \(\frac{PV}{RT}\) devient supérieure à 1. Remarquez que l’ampleur des déviations par rapport à l’idéal est la plus grande pour le gaz à \(200 \ : \text{K}\) et la plus petite pour le gaz à \(1000 \ : \text{K}\).
L’idéalité d’un gaz dépend également de la force et du type de forces d’attraction intermoléculaires qui existent entre les particules. Les gaz dont les forces attractives sont faibles sont plus idéaux que ceux dont les forces attractives sont fortes. À température et pression égales, le néon est plus idéal que la vapeur d’eau car les atomes du néon ne sont attirés que par de faibles forces de dispersion, tandis que les molécules de la vapeur d’eau sont attirées par des liaisons hydrogène relativement plus fortes. L’hélium est un gaz plus idéal que le néon parce que son plus petit nombre d’électrons signifie que les forces de dispersion de l’hélium sont encore plus faibles que celles du néon.